Разработка новых подходов к коррекции дисбиотических нарушений вагинальной микрофлоры, наиболее частым из которых является бактериальный вагиноз (БВ), является предметом многочисленных научных изысканий последних лет. В основе БВ всегда лежит анаэробный дисбиоз [1], однако этиология заболевания до сих пор не ясна [2], а в лечении также не достигнуто существенных успехов. Стандартная терапия метронидазолом и клиндамицином далеко не всегда приводит к желаемым результатам: рецидивы БВ в течение года после лечения могут наблюдаться у 50% пациенток [3]. Предполагают, что низкая эффективность терапии БВ метронидазолом и клиндамицином связана с тем, что микроорганизмы, ассоциированные с данным состоянием, часто находятся в биопленках [4, 5]. Низкая эффективность стандартной терапии БВ заставляет искать новые подходы для борьбы с данным патологическим состоянием.
Эксперименты и клинические исследования показали, что достаточно эффективным средством сенсибилизации биопленок к антимикробным агентам может быть обработка влагалища растворами лекарственных средств, кавитированных низкочастотным ультразвуком (НУЗ). Биоакустический эффект ультразвукового воздействия проявляется в уменьшении жизнеспособности бактерий в биопленках в результате одновременного воздействия низкочастотного ультразвука и антимикробных препаратов [6]. Предложена методика обработки влагалища раствором хлоргексидина 0,05%, кавитированным НУЗ, и показана ее эффективность в лечении инфекционно-воспалительных заболеваний гениталий, возможности профилактики инфекционных осложнений после внутриматочных вмешательств [7, 8]. Также была продемонстрирована микробиологическая эффективность данной методики для коррекции дисбиотических процессов во влагалище у беременных пациенток: после обработки влагалища раствором хлоргексидина 0,05%, кавитированным НУЗ снижалась общая обсемененность влагалища и увеличивалась относительная доля лактобацилл в микробиоценозе [9].
Одним из подходов к восстановлению вагинальной микрофлоры является применение пробиотических препаратов, как правило, на основе живых лактобацилл. Наиболее привлекательным кандидатом для пробиотических препаратов является вид L. crispatus, который часто выявляется во влагалище здоровых женщин, и наоборот, крайне редко – у пациенток с БВ [10]. В России в настоящее время зарегистрирован единственный пробиотический препарат на основе L. сrispatus – биологически активная добавка экофемин флораваг (ЭФ). В состав препарата входят живые лактобациллы трех видов, в том числе штамм L. crispatus LMG 9479. Препарат предназначен для перорального приема, что обеспечивает восстановление микрофлоры как репродуктивного, так и желудочно-кишечного тракта. Кроме того, пероральный прием препарата повышает приверженность лечению у пациенток. Однако данные о клинической и микробиологической эффективности ЭФ для коррекции дисбиоза влагалища ограничены.
Учитывая положительные результаты применения в целях немедикаментозной коррекции дисбиоза раствора хлоргексидина 0,05%, кавитированного НУЗ [9], перспективным представляется вариант комбинированного последовательного применения описанных методов для коррекции дисбиоза влагалища: орошение влагалища кавитированным НУЗ раствором хлоргексидина 0,05% на первом этапе и назначение пробиотического препарата, содержащего штаммы L. crispatus, на втором. Эффективность данного терапевтического алгоритма должна быть оценена по двум критериям: клиническим и микробиологическим.
Цель исследования: оценить клиническую и микробиологическую эффективность двухэтапной схемы коррекции дисбиоза влагалища с использованием кавитированного НУЗ 0,05% водного раствора хлоргексидина и пробиотического препарата ЭФ.
Материал и методы исследования
В исследование были включены 88 женщин в возрасте от 18 до 49 лет (средний возраст 30,9±5,4 года) с установленным на основании клинического обследования и полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) (тест-система Фемофлор16, ДНК-Технология, Москва) дисбиозом влагалища. На момент обследования 30 (34,2%) женщин были беременны (гестационный срок 5–13 недель), у 15 из них (17,05%) беременность была первой. Критерии включения в исследование: клинические признаки дисбиоза влагалища, подтвержденные методом ПЦР-РВ. В зависимости от выраженности дисбиотических нарушений обследованные были разделены на две группы: 33 женщины с умеренным анаэробным дисбиозом (I группа) и 55 женщин с выраженным анаэробным дисбиозом (II группа). Критериями исключения являлись наличие ВИЧ-инфекции, сифилиса, гепатитов B и C, генитальных инфекций, вызванных облигатными патогенами (C. trachomatis, N. gonorhaeae, M. genitalium, T. vaginalis), выявление дрожжеподобных грибов рода Candida при микроскопии, получение местной или системной антибиотикотерапии в течение 4 предшествующих обследованию недель.
Для коррекции дисбиоза влагалища была применена двухэтапная схема коррекции. На первом этапе проводили обработку влагалища кавитированным НУЗ водным 0,05% раствором хлоргексидина с помощью аппарата АУЗХ-100 в соответствии с методическими указаниями [11] (время воздействия – 1–2 минуты, мощность – 6–8 единиц, объем используемого раствора – 150–200 мл, кратность – один раз в день в течении трех дней подряд). На втором этапе все пациентки получали препарат ЭФ по 2 капсулы 1 раз в сутки в течение 10 дней перорально.
Клиническую оценку нижних отделов гениталий проводили до начала и после окончания лечения. Состояние микробиоценоза и видовой состав лактофлоры влагалища методом ПЦР-РВ исследовали трехкратно: до лечения – на этапе первичного консультирования (1-я точка); непосредственно после третьей обработки влагалища кавитированным НУЗ водным 0,05% раствором хлоргексидина (2-я точка); через месяц после окончания приема ЭФ (3-я точка).
Материал для исследования собирали с задне-боковой стенки влагалища в пробирку Эппендорф, содержащую 1 мл физиологического раствора, хранение и транспортировку материала проводили согласно действующим нормативным документам. ДНК выделяли с использованием комплекта реагентов ПРОБА-ГС (ООО «НПО ДНК-Технология»). ПЦР-РВ проводили согласно инструкции производителя. Интерпретацию результатов ПЦР-РВ проводили в соответствии с ранее разработанными критериями [12], всех пациенток по состоянию микробиоценоза делили на 4 группы: абсолютный нормоценоз (АН), условный нормоценоз (УН), умеренный дисбиоз (УД) и выраженный дисбиоз (ВД). Для оценки видового состава нормофлоры провели определение количества Lactobacillus spp. и генотипирование 6 видов лактобацилл (L. crispatus, L. iners, L. jensenii, L. gasseri, L. johnsonii, L. vaginalis) методом ПЦР-РВ с использованием реагентов для научного применения (OOO «НПО ДНК-Технология»). Для анализа были отобраны только те пробы, в которых сумма всех выделенных видов лактобацилл была сопоставима с общим количеством определенных Lactobacillus spp. и составляла не менее 70%. При выявлении нескольких видов лактобацилл доминирующим считали тот, доля которого в составе лактофлоры составляла более 50%.
В качестве средних величин при оценке доли лактобацилл использовали медианы. Для описания вариации признака в исследуемых группах рассчитывали 0,25 и 0,75 перцентили. Для оценки достоверности различий между долями лактобацилл рассчитывали критерий Манна–Уитни в программе IBM SPSS Statistics 20. Для оценки достоверности различий между частотными показателями рассчитывали точный двусторонний критерий Фишера в программе WinPepi. Различия интерпретировали как достоверные при минимальном уровне значимости α=0,05.
Результаты исследования
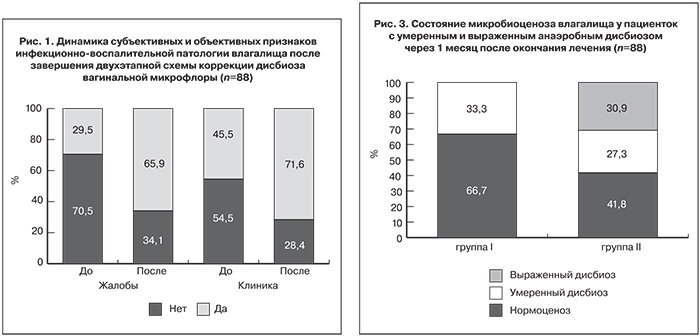
При первичном осмотре жалобы предъявляли 62 (70,4%) женщины, в том числе 20 (22,7%) отмечали выделения с неприятным запахом, 17 (19,3%) – зуд и жжение в области наружных половых органов, 22 (25,0%) – обильные выделения без запаха, 3 (3,4%) жаловались на дискомфорт после половых контактов (рис. 1). При осмотре клинические признаки вагинита или вагиноза присутствовали у 48 (54,5%) обследованных, в том числе патологический характер белей выявлен у 41 (46,5%), гиперемия слизистой влагалища – у 18 (20,4%) женщин. Жалобы и клинические симптомы, указывающие на инфекционно-воспалительную патологию влагалища, отсутствовали на момент обращения у 16 (18,8%) женщин. Исследование микробиоценоза влагалища было проведено им в рамках прегравидарной подготовки либо в 1-м триместре беременности.
После проведенного курса терапии жалобы на патологические бели или дискомфорт в области гениталий предъявляли только 30 (35,2%) женщин, клинические признаки инфекционной патологии влагалища определялись у 25 (28,4%) обследованных. Таким образом, предложенная двухэтапная схема немедикаментозной коррекции дисбиоза влагалища без применения системной антибактериальной терапии позволила добиться клинического излечения у каждой второй пациентки.
Положительная динамика состояния микробиоценоза по данным ПЦР-РВ была отмечена после завершения курса орошений влагалища (рис. 2 см. на вклейке). Доля женщин с выраженным анаэробным дисбиозом снизилась с 62,5 до 29,9%, с умеренным дисбиозом – с 37,5 до 24,1% среди всех обследованных женщин. При этом у 46,0% женщин произошло восстановление микробиоценоза до нормоценоза, в том числе у 36,7% – до абсолютного нормоценоза.
Ранее было показано, что у пациенток с умеренным и особенно выраженным дисбиозом восстановление доли лактофлоры до нормальных значений после орошений влагалища кавитированным НУЗ раствором хлоргексидина происходит в 35,7% случаев [9], что обосновывает целесообразность назначения пробиотика на втором этапе терапии. Однако после приема ЭФ дальнейшего увеличения доли пациенток с нормоценозом отмечено не было. При этом сократилось число женщин с выраженным дисбиозом по сравнению, как с первой, так и со второй точкой наблюдения.
Оценка индивидуальной динамики доли лактофлоры и состояния микробиоценоза влагалища до и после курса лечения в зависимости от тяжести дисбиотических нарушений позволила более точно оценить эффективность предложенной двухэтапной схемы коррекции (рис. 3).
В I группе (у пациенток с умеренным дисбиозом) восстановление доли лактофлоры до показателей, соответствующих нормоценозу, произошло в 22 (66,6%) случаях, а в 3 (9,1%) случаях был отмечен прирост доли лактофлоры в пределах 27–30%. У 9 (24,3%) женщин доля лактофлоры оставалась практически неизменной на протяжении курса лечения. Таким образом, индивидуальная положительная динамика была зафиксирована у 25 (75,7%) из 33 женщин I группы.
Во II группе восстановление нормоценоза зарегистрировано только у 23 (41,8%) из 55 женщин. Еще у 15 (27,3%) женщин выраженный дисбиоз сменился умеренным. Прирост доли лактофлоры у этих пациенток был в пределах 16–71%, однако с учетом крайне низкого содержания лактобацилл на старте наблюдения достичь нормоценоза у этих женщин не удалось. Таким образом, положительная динамика была зафиксирована у 38 (69,1%) из 55 женщин с выраженным дисбиозом, а ее отсутствие – у 17 (31,4%) пациенток, в том числе у 3 пациенток, у которых лактобациллы не выявляли на всех этапах наблюдения.
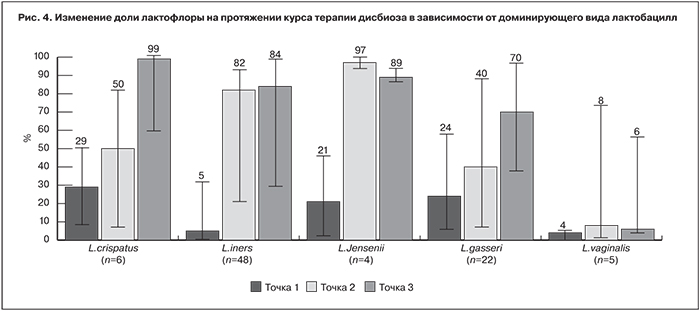
При генотипировании лактобацилл у каждой пациентки одновременно выявляли от 1 до 4 видов, при этом доминирующим считали тот, доля которого в составе лактофлоры составляла более 50%. Чаще других в качестве доминирующего вида присутствовал L. iners – у 48 (54,5%) обследованных, вторым по частоте видом был L. gasseri – у 22 (25%) женщин. Еще реже доминировали L. vaginalis и L. jensenii – у 5 (6,8%) и 4 (4,5%) женщин, соответственно. Наиболее благоприятный для сохранения стабильного нормоценоза вид L. crispatus до начала терапии преобладал только у 6 (6,8%) женщин. У 3 (3,4%) женщин лактобациллы не были выявлены ни при первичном обследовании, ни после курса ЭФ.
Была предпринята попытка установить взаимосвязь между доминирующим видом лактобацилл и эффективностью предложенной схемы коррекции дисбиоза (рис. 4). Прирост доли лактофлоры в составе микробиоценоза оценивали непосредственно после завершения курса влагалищных орошений (2-я точка) и через месяц после дотации лактофлоры (3-я точка). Выраженная положительная динамика во 2-й точке наблюдалась при всех видах лактобацилл за исключением L. vaginalis. Но нормоценоз был достигнут только у женщин с доминированием L. iners и L. jensenii. Дальнейший существенный рост доли нормофлоры с достижением нормоценоза после приема ЭФ наблюдался только у женщин с L. crispatus. При доминировании L. gasseri прирост доли лактофлоры также был ощутимым в 3-й точке, однако восстановления нормоценоза в большинстве случаев не наступало. Таким образом, наилучший эффект двухэтапной схемы коррекции дисбиоза отмечали при доминировании вида с выраженными протективными свойствами – L. crispatus.
При доминировании L. iners дальнейшего прироста доли лактофлоры на фоне приема ЭФ не наблюдалось. Ранее было установлено, что непосредственно после обработки влагалища кавитированным НУЗ раствором хлоргексидина происходит снижение общей бактериальной массы в 10–100 раз преимущественно за счет условно-патогенной микрофлоры [9]. Назначение женщинам пробиотического препарата на втором этапе коррекции дисбиоза было нацелено на поддержание доминирования лактофлоры по отношению к условно-патогенным микроорганизмам в период восстановления численности вагинальной микробиоты. Сохранение достигнутого уровня лактофлоры на протяжении месяца после окончания пробиотической терапии демонстрирует эффективность предложенной схемы.
Дискутабельным является вопрос о возможности замены собственной нормофлоры пробиотическим штаммом лактобацилл, обладающим высоким протективным потенциалом – L. crispatus. В ходе настоящего исследования не было зарегистрировано ни одного случая заселения влагалища L. crispatus после курса терапии ЭФ при исходном отсутствии данного вида в составе лактофлоры. После проведенной терапии у 72 (81,8%) обследованных женщин доминирующий вид лактофлоры остался без изменения. У 13(14,7%) пациенток произошла замена доминирущего вида лактобацилл на вид, представленный ранее в микробиоте, но в меньшем количестве. L. crispatus в качестве доминирующего вида выявляли в два раза чаще после лечения, однако у всех этих пациенток данный вид присутствовал в меньшем количестве в составе вагинальной микрофлоры до лечения. Полученные данные позволяют утверждать, что видовой состав нормофлоры у каждой конкретной женщины стабилен и мало изменяется под воздействием как физико-химических факторов, так и пробиотических штаммов микроорганизмов. Можно предположить, что назначение пробиотика на втором этапе коррекции дисбиоза влагалища скорее способствует восстановлению популяции собственной лактофлоры, чем изменению ее видового состава.
Выводы
- Двухэтапная схема немедикаментозной коррекции дисбиоза влагалища, включающая трехкратную обработку влагалища кавитированным НУЗ 0,05% водным раствором хлоргексидина и пробиотического препарата ЭФ, демонстрирует высокую эффективность: клиническое выздоровление и восстановление нормоценоза было достигнуто у каждой второй пациентки.
- Возможности коррекции дисбиоза влагалища зависят от исходного состояния микробиоценоза. При умеренном дисбиозе восстановление нормоценоза без применения антибактериальных препаратов происходит в два раза чаще, чем при выраженном. В целом увеличение доли лактофлоры было достигнуто у 75,7% пациенток с умеренным анаэробным дисбиозом и у 69,1% с выраженным анаэробным дисбиозом.
- В ходе настоящего исследования не было зарегистрировано ни одного случая выявления L. crispatus после курса терапии ЭФ при отсутствии данного вида в составе лактофлоры на старте наблюдения.
- Видовой состав нормофлоры у каждой конкретной женщины стабилен и мало изменяется под воздействием физико-химических и биологических факторов. Назначение пробиотика, содержащего L. crispatus, не приводит к вытеснению ими иных доминирующих видов лактобацилл, но способствует восстановлению популяции собственной лактофлоры.



