Известно, что микрофлора влагалища играет исключительно важную роль, и ее следует рассматривать как своеобразную экологическую систему, реагирующую на любые изменения состояния организма женщины [1]. На состав влагалищной микрофлоры, наряду с изменениями в соответствии с фазой менструального цикла, также могут оказывать воздействие сексуальная активность и использование контрацептивных средств [2].
Гормональные контрацептивные средства используют 12,5% женщин репродуктивного возраста, внутриматочные средства (ВМС) – 12,9% [3, 4]. Спектр возможностей выбора метода контрацепции в настоящее время чрезвычайно широк: оральные контрацептивы, импланты, пластыри, влагалищные кольца, внутриматочные спирали, хирургические методы (женская и мужская стерилизация), барьерные средства, методы естественного планирования беременности (календарный, оценка цервикальной слизи), прерванный половой акт, метод лактационной аменореи, экстренная контрацепция. В основе данных контрацептивных стратегий лежат разнообразные механизмы предупреждения нежелательной беременности, эффективность их также существенно различается [5, 6].
Рядом исследователей описано развитие вульвовагинальных симптомов у пациенток, использующих влагалищное кольцо [7]. В рамках сравнительного исследования по изучению влияния влагалищного кольца и комбинированных оральных контрацептивов (КОК) на микробиоценоз влагалища с оценкой вагинальных выделений с использованием бактериоскопического и бактериологического исследования (оценка роста культур дрожжеподобных грибов и лактобактерий) до и через 2–4 месяца использования контрацепции не было отмечено увеличения количества вагинитов [8, 9].
Однако существуют работы, которые указывают, что применение КОК ассоциируется с повышением частоты кандидоза влагалища за счет влияния эстрогенного препарата. Так, предполагают, что эстрогены способствуют формированию обогащенной гликогеном среды влагалища, благоприятной для роста грибов рода Candida и других видов дрожжевых грибов. Аналогичный механизм имеет место и при введении контрацептивного вагинального кольца [9].
Таким образом, тенденция к применению контрацепции не только с целью предупреждения нежелательной беременности, но и изучения ее влияния на биоценоз влагалища, остается актуальным и окончательно не решенным вопросом [10].
Цель исследования: определить факторы риска и частоту встречаемости нарушения биоценоза влагалища на фоне применения различных методов гормональной контрацепции у женщин репродуктивного возраста при помощи клинических и молекулярно-генетических методов исследования
Материалы и методы
Были проанкетированы 300 женщин в возрасте от 18 до 45 лет, обратившихся в научно-поликлиническое отделение по поводу подбора метода контрацепции. Средний возраст пациенток составил 30,7±7,03 года. Согласно критериям включения и исключения, в исследование были отобраны 120 пациенток, которые методом случайных чисел были разделены на 4 равные по численности группы.
В I группу были включены 30 пациенток, использующих барьерные методы контрацепции.
Во II группу были включены 30 пациенток, использующих монофазный комбинированный оральный эстроген-гестагенный контрацептивный препарат, содержащий 20 мкг этинилэстрадиола и 3 мг дроспиренона.
В III группу вошли 30 пациенток, которые использовали влагалищное кольцо, содержащее эстроген – этинилэстрадиол (11,7 мг) и гестаген – этоногестрел (2,7 мг). В сутки выделяется 15 мкг этинилэстрадиола и 120 мкг этоногестрела.
В IV группу были включены 30 пациенток, которые использовали внутриматочную рилизинг-систему, содержащую 52 мг левоноргестрела. Ежедневно выделяется в полость матки до 20 мкг гормона.
Критериями включения в исследование явились: репродуктивный возраст (18–45 лет), регулярный менструальный цикл, отсутствие приема антибактериальных препаратов в течение 3 месяцев до обследования, заинтересованность в надежной контрацепции, соматическое и психическое здоровье, регулярная половая жизнь, отсутствие приема гормональных контрацептивов в предшествующие 3 месяца, отсутствие инфекций, передающихся половым путем (ИППП).
Критерии исключения формировались согласно рекомендациям приемлемости и безопасности гормональной контрацепции ВОЗ (2015). Для влагалищного кольца дополнительно: цервикальные интраэпителиальные неоплазии умеренной и тяжелой степени, выпадение шейки матки, грыжа мочевого пузыря. Для ВМС дополнительно: воспалительные заболевания органов малого таза в настоящее время, ИППП (в настоящее время), туберкулез внутренних половых органов, количество половых партнеров больше 1, врожденная аномалия половых органов (двурогая матка, седловидная матка, однорогая матка, перегородка в матке), миома матки (субмукозный узел или узел, деформирующий полость матки), трофобластическая болезнь, пузырный занос, хориокарцинома (в анамнезе).
Все женщины, включенные в исследование, подписали информированное согласие.
Для оценки видового состава лактофлоры проводили определение количества Lactobacillus spp. и 8 видов лактобацилл (L. crispatus, L. iners, L. jensenii, L. gasseri, L. johnsonii, L. vaginalis, L. acidophilus, L. plantarum) методом ПЦР-РВ с использованием реагентов для научного применения (ООО «НПО ДНК-Технология», Москва). Для анализа структуры нормофлоры были отобраны только те образцы, в которых сумма всех выделенных видов лактобацилл была сопоставима с общим количеством Lactobacillus spp. и составляла не менее 50%.
Изучение полиморфизма генов
Выделение ДНК проводили из периферической крови по методу Higuchi (R. Higuchi, H. Erlich, 1989) с некоторыми модификациями. Определение замен одиночных нуклеотидов проводили модифицированным методом «примыкающих проб» (adjacentprobes, kissingprobes), используя оригинальные олигонуклеотиды.
Полимеразную цепную реакцию (ПЦР) и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия). В работе определяли следующие генные полиморфизмы: CD14: -260 (-159) C>T (rs2569190), IL10: -592 A/C (rs1800872), IL1A: -889 C>T (rs1800587), IL1B: -31 T>C (rs1143627), IL1B: 3953 (3954) C>T (rs1143633), IL1R1: Pst11970 C>T (rs2234650), IL1RN: 11100 msp1 T>C (rs315952), IL4: -33 C>T (rs2070874), IL4: -590 C>T (rs2243250), IL4R: 1902 A>G (Gln576Arg) (rs1801275), IL6: 174 C>G (rs1800795), IL6R: 1510 (1073) A>C (Asp358Ala) (rs2228145 (rs8192284)), IL8: -251 A>T (rs4073), TGFB1: -509 C>T ( rs1800469), TLR9: -1486 T>C ( rs187084), TNF: -238 G>A (rs361525).
Статистический анализ
Математическая обработка данных выполнена с помощью электронных таблиц Microsoft Excel и пакета прикладных программ IBM SPSS Statistica v23 (США). Числовые параметры представлены в формате Мe (Q25%–Q75%), где Мe – медиана, а Q25% и Q75% – верхний и нижний квартили; качественные показатели представлены в виде абсолютных, количественных и относительных величин (абс./общее количество (относит. %)). В работе использовались точный критерий Фишера, критерий Манна–Уитни, рассчитывалось отношение шансов и соответствующий 95% доверительный интервал (ДИ).
Результаты и обсуждение
У 78/120 (65,0%) пациенток до начала применения контрацепции состояние влагалищной микрофлоры соответствовало критериям нормоценоза, у 7/120 (5,8%) – выраженного дисбиоза и у 35/120 (29,2%) – умеренного дисбиоза. Значимых различий по частоте встречаемости дисбиоза на момент назначения контрацепции между группами выявлено не было. В структуре умеренных дисбиозов доминировали анаэробные дисбиозы – 28/35 (80%), а при выраженных дисбиозах определялось увеличение роли факультативных анаэробов – 3/7 (42,9%). При этом у всех пациенток с дисбиозом в качестве доминирующих в составе микробиоценоза облигатных анаэробов чаще всего выявляли Gardnerella spp. и Eubacterium spp., среди факультативных анаэробов – Enterobacteriaceae spp. Однако значимых различий по абсолютному количеству микроорганизмов между группами не выявлено.
Статистически значимых различий в распределении женщин с дисбиозом микрофлоры по группам выявлено не было (р>0,05): в I группе – 9/30 (30,0%), во II группе – 11/30 (36,7%), в III группе – 12/30 (40,0%), в IV группе – 10/30 (33,3%).
Несмотря на отсутствие клинических проявлений у пациенток, нарушение микробиоценоза влагалища исходно было выявлено у 12/120 (10,0%) женщин, что, возможно, обусловлено пониженной индивидуальной реактивностью данных пациенток. Статистически значимых различий в распределении женщин с нарушением микробиоценоза влагалища по группам выявлено не было (р>0,05): 2/30 (6,7%) – в I группе, 3/30 (10%) – во II группе, 4/30 (13,3%) – в III группе, 3/30 (10,0%) – в IV группе. Уже через 1 месяц применения контрацепции в исследуемых группах нами выделена подгруппа женщин, предъявляющих жалобы на выделения из половых путей, дискомфорт в области вульвы. В связи с этим через 1 месяц после начала применения контрацепции 14/120 (11,7%) пациенткам была назначена местная антибактериальная терапия. При этом в I группе лечение было назначено 11/30 (36,7%) пациенткам, в III группе – 3/30 (10,0%), а во II и IV группах ни одна пациентка не нуждались в лечении. Все 14 пациенток, получавших противовоспалительную терапию, были выделены в отдельную подгруппу для дальнейшего анализа.
Дополнительно установлено, что 10/14 (71,4%) пациенток, которые в дальнейшем нуждались в лечении, уже до назначения контрацепции имели дисбиоз. Полученные данные позволили считать дисбиотическое состояние микрофлоры влагалища при назначении контрацепции фактором риска развития в последующем воспалительных заболеваний влагалища. Дисбиоз влагалища увеличился через 1 месяц на фоне применения контрацепции наиболее существенно в I и III группах – 19/30 (63,3%) и 20/30 (66,7%) соответственно; во II группе – 14/30 (46,7 %), в IV группе – 12/30 (40,0%).
Анализ возможных предикторов возникновения воспалительных заболеваний показал, что профиль микроорганизмов, выявленных на первом визите у пациенток, которые в дальнейшем нуждались в лечении, был в целом сходен с таковым у пациенток, не нуждавшихся в лечении, однако нами были обнаружены некоторые различия.
Исходно абсолютное количество G. vaginalis у пациенток, впоследствии получивших лечение, было статистически значимо выше, чем у женщин, не нуждавшихся в лечении (4,9 (3,1–6,6) и 3,2 (2,4–4,9) ГЭ/образец, р=0,02 соответственно). При этом в первом случае доля G. vaginalis в структуре биоценоза была достаточно значительной и составляла 8,13 (0,04–41,50)% по сравнению со здоровыми женщинами, у которых данный микроорганизм не превышал 1% (0,02 (0–0,88)%). Также для этих пациенток характерно наличие значительного количества U. parvum – 3,7 (0–4,3) ГЭ/образец (р=0,03).
Следует отметить, что U. parvum не является прямым антагонистом лактобактерий и может существовать как при дисбиозе, так и на фоне сохранной нормофлоры. Среди 35/104 (33,7%) пациенток, не требовавших лечения, в 23/35 (65,7%) случаев при наличии U. parvum наблюдалось преобладание нормофлоры, т.е. условный нормоценоз. При этом не было статистически значимых различий в частоте встречаемости нормоценоза при наличии и отсутствии U. parvum. У пациенток, в дальнейшем нуждавшихся в лечении, наблюдалось обратное соотношение: U. parvum был выявлен в 9/14 (64,3%) случаев, 7/9 (77,8%) женщин с U. parvum имели дисбиоз различной степени выраженности, тогда как условный нормоценоз, обусловленный U. parvum, выявлялся только у 2/9 (22,2%) пациенток. Такое распределение свидетельствует о вторичности наблюдаемых изменений. Появление U. parvum в составе микробиоценоза, по-видимому, не является этиологически значимым и свидетельствует о снижении колонизационной резистентности. Терапия таких пациенток должна основываться на элиминации этиологически значимых групп микроорганизмов, в первую очередь G. vaginalis, и нормализации микробиоценоза в целом.
Обращали на себя внимание различия в частоте возникновения дисбиозов в зависимости от типа используемой контрацепции. Учитывая высокую частоту необходимости лечения в группе использующих барьерные методы контрацепции, нами было сделано предположение о более благоприятном воздействии гормональной контрацепции на влагалищную микрофлору, а выраженность эффекта зависела от метода контрацепции. В ходе динамического наблюдения частота выявления дисбиоза во II и IV группах существенно не менялась, хотя и имела незначительную тенденцию к снижению.
У 4/42 (9,5%) женщин без клинических признаков дисбиотических процессов во влагалище были выявлены дрожжеподобные грибы в количествах более 104 ГЭ/мл. Учитывая отсутствие каких-либо клинических признаков воспаления и дискомфорта, данное состояние рассматривалось нами как вариант нормального микробиоценоза.
Была проанализирована структура нормофлоры в зависимости от состояния микробиоценоза влагалища. При нормоценозе в структуре нормофлоры чаще наблюдалось доминирование одного вида бактерий. Так, из 48/120 (40%) случаев нормоценоза L. iners доминировал в 44/48 (91,7%) случаях, тогда как при дисбиозе – только в 24/42 (57,1%) (OR=8,25 (2,5–27,18), p=8,0×10-5). Аналогичная картина наблюдалась для L. jensenii – 46/54 (85,2%) при нормоценозе против 11/31 (35,5%) при дисбиозе (OR=10,5 (3,7–29,5); p=7,0×10-6) и для L. gasseri – 26/26 (100%) против 38/55 (69,1%) (OR=24,1 (1,5–397); p=8,2×10-4). Для L. crispatus имела место аналогичная тенденция, однако из-за редкой встречаемости этого вида в обоих группах различия не имели статистической значимости.
Значимых различий в структуре нормофлоры в зависимости от метода контрацепции в исследуемых группах на протяжении периода наблюдения выявлено не было, что свидетельствует об отсутствии отрицательного влияния контрацепции на условия существования лактобактерий во влагалище.
В ходе поиска генетических предикторов развития клинической картины дисбиоза, потребовавшей применения местной антибактериальной терапии, было установлено, что статистически значимые различия между пациентками, нуждавшимися и не нуждавшимися в лечении, наблюдались для полиморфного локуса гена IL4 (гаплотип -33 C>T/-590 С>T) (р=0,02), гена IL1R1: Pst11970 C>T (р=0,0001) и гена IL1RN: 11100 msp1 T>C (р=0,014). Для установления наиболее вероятной модели наследования для каждого из полиморфных локусов, различавшихся по распределению аллелей между пациентками, нуждавшимися и не нуждавшимися в лечении, был проведен статистический анализ аутосомно-доминантной и аутосомно-рецессивной модели для каждого аллеля. Для полиморфного локуса гена IL4 (гаплотип -33 C>T/-590 С>T) распределение генотипов соответствовало аутосомно-рецессивной модели наследования, ассоцированной с гаплотипом ТТ. Гомозиготные носительницы этого гаплотипа имели повышенный риск возникновения воспалительных заболеваний нижнего отдела полового тракта на фоне применения гормональной контрацепции, требующих проведения терапии (OR=3,51 (1,55–7,93); р=0,0006).
Для полиморфного локуса IL1R1: Pst11970 C>T статистически значимыми оказались обе проверяемые модели. Исходя из значения р=0,0001, наиболее вероятным представляется аутосомно-доминантная модель. Согласно аутосомно-доминантной модели, OR для носителей аллеля Т полиморфного локуса IL1R1: Pst11970 C>T составило 4,31 (1,12–16,56); р=0,0001.
Для полиморфизма IL1RN: 11100 msp1 T>C была выявлена ассоциация частотного аллеля T с возникновением необходимости применения антибактериальной терапии. Генотипическая частота этого аллеля среди женщин, нуждавшихся в лечении, составляла 12/14 (85,7%) по сравнению с 64/106 (60,4%), не нуждавшихся в терапии (р=0,017). Малое количество пациенток, нуждавшихся в лечении, не позволило однозначно определить вероятную модель наследования для данного локуса. Широкое распространение носителей аллеля Т полиморфного локуса IL1RN: 11100 msp1 в популяции (83% по нашим данным) приводит к низкой прогностической ценности положительного ответа и нецелесообразности использования данного маркера в диагностических целях. Тем не менее перспективными представляются дальнейшие исследования в этой области (таблица).
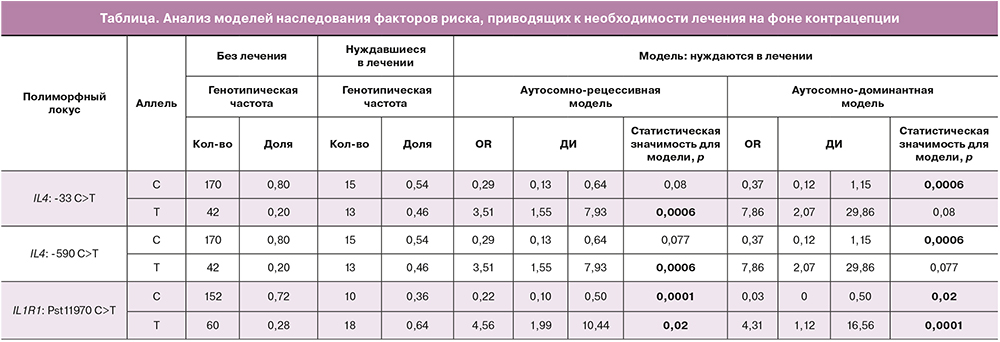
Таким образом, носительство гаплотипа ТТ по локусам -33 С>T и -590 C>T гена IL4 в гомозиготном состоянии или аллеля Т полиморфного локуса IL1R1: Pst11970 C>T ассоциировано с повышенным риском возникновения необходимости лечения воспалительных заболеваний нижнего отдела полового тракта женщин на фоне применения гормональной контрацепции. Многофакторный анализ для выявления сочетанного влияния нескольких факторов риска на возникновение необходимости лечения на фоне гормональной контрацепции не проводился.
Заключение
У женщин, принимающих гормональную контрацепцию, значимым фактором риска развития воспалительных заболеваний является дисбиоз влагалища, обусловленный повышением доли G. vaginalis. Оценку состояния биоценоза влагалища на фоне использования гормональной контрацепции целесообразно проводить 1 раз в 12 месяцев.
Пациентки с генотипом IL4: -590 T/T или носители аллеля Т полиморфного локуса IL1R1: Pst11970 C>T имеют высокий риск развития воспалительных заболеваний и требуют контроля микробиоценоза влагалища на фоне применения гормональной контрацепции.



