Преэклампсия (ПЭ) является одной из основных причин материнской заболеваемости и смертности и частым осложнением беременности, которым в год страдает более 4,1 млн женщин во всем мире [1–3].
Эпидемиологические исследования последних десятилетий предоставили информацию о том, что ПЭ носит семейный характер. Для родственников первой степени родства заболевших женщин отмечено увеличение риска развития ПЭ в 2–3 раза; кроме того, для женщины, родившейся от беременности с ПЭ, риск иметь ПЭ в 2 раза выше [2, 4].
Полученные результаты GWAS по ПЭ (Genome-wide association study – полногеномный поиск генных ассоциаций) в различных популяциях весьма противоречивы в силу ограниченной статистической мощности большинства исследований, а также влияния микроэволюционных факторов в конкретных этнических популяциях [5, 6]. Метаанализ предоставил доказательства генетической связи полиморфизма генов, кодирующих факторы свертывания крови – II и V, ренин-ангиотензиновой системы и эндотелиальных факторов, таких как MTHFR и eNOS3, с развитием ПЭ [7–15]. Важная составляющая поиска генетической компоненты любого мультифакторного заболевания, каковым является ПЭ, – это обязательное последующее проведение репликативных исследований значимых генетических маркеров в независимых популяционных выборках, что позволит уточнить этиопатогенетические механизмы развития ПЭ. По данным GWAS-анализа, отобраны 10 значимых SNP-полиморфизмов (р<10-4), предрасполагающих к развитию ПЭ, и проведено их независимое репликативное генотипирование в казахской популяции [5, 6].
Цель исследования: изучение генетического вклада полиморфизмов генов свертывающей системы FV (rs6025), FII (rs1799963), фолатного метаболизма MTHFR (rs1801133, rs1801131), MTRR (rs1801394), MTR (rs1805087); ангиотензин-рениновой системы eNOS3 (rs1799983), ACE (rs4340), AGTR1 (rs5186) и липидного обмена АроС3 (rs5128) в развитие ПЭ в казахской популяции.
Материалы и методы
Проспективное исследование проводили в поликлиническом отделении Научного центра акушерства, гинекологии и перинатологии (НЦАГиП), в акушерском отделении многопрофильной областной больницы Алматинской области и городском Перинатальном центре г. Алматы. Временной период – 2012–2014 гг.
Основную группу с ПЭ составили 205 беременных или родильниц казахской национальности с установленным диагнозом ПЭ, контрольная группа представлена 300 беременными и родильницами без ПЭ и с неосложненным течением беременности. Возраст обследуемых составил 18–45 лет, объем общей выборки представлен 505 беременными и родильницами.
Критерии включения (пациентки отобраны в соответствии с международными критериями диагностики ПЭ): систолическое артериальное давление (САД) ≥140 мм рт.ст., диастолическое артериальное давление (ДАД) ≥90 мм рт.ст.; протеинурия (>500 мг/л) в суточном анализе или двукратно >300 мг/л в случайных анализах мочи; срок беременности выше 20-й недели [2]. Все обследуемые имели казахскую национальность и были сопоставимы по паритету родов и анамнезу.
Все обследуемые были проинформированы о целях выполняемого проекта и подписали добровольное согласие на использование своих образцов крови и анамнестических данных. Разрешение биоэтической комиссии НЦАГиП МЗ РК на проведение данных исследований было получено.
Материалом исследования послужили 505 образцов ДНК, выделенные методом разделения магнитных частиц M-PVA на автоматическом анализаторе Prepitto (PerkinElmer) с использованием комплекта реагентов Prepito DNA Cyto Pure.
Молекулярно-генетические исследования проведены TaqMan методом единой сайт специфичной амплификации и генотипирования в реальном времени (Real-Time PCR) с использованием тест-систем («Тест Ген», Россия) для молекулярно-генетических исследований.
Статистический анализ: частота встречаемости генотипов и аллелей полиморфизмов изученных генов представлены в абсолютных и относительных (%) величинах. Статистическую значимость отличий по частотам встречаемости генотипов и аллелей полиморфизмов генов между исследуемыми группами определяли по критерию χ2 Пирсона. Результаты анализа считали статистически значимыми при уровне р<0,05. Оценку влияния носительства полиморфных вариантов генов на риск развития заболевания проводили с помощью отношения шансов (OШ) с учетом 95% доверительного интервала (95% ДИ). Статистическая обработка данных проводилась с помощью программы PLINK [16].
Результаты
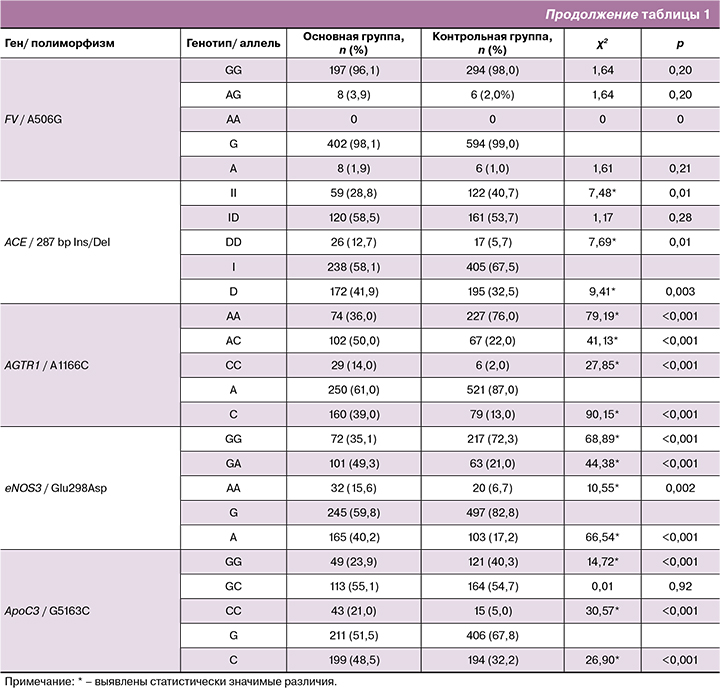
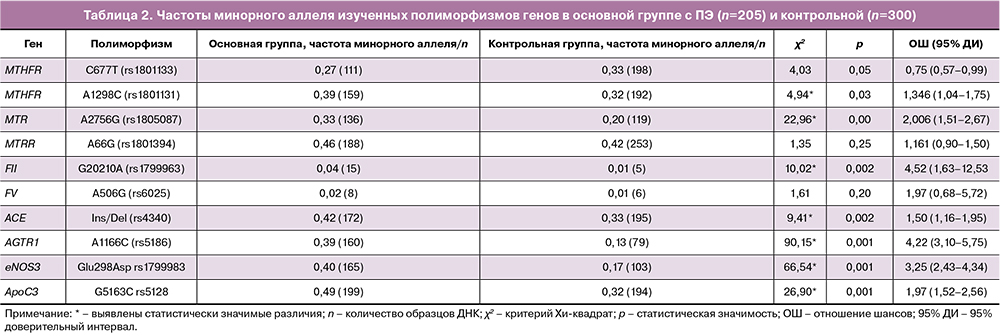
По данным GWAS и метаанализов, отобраны 10 значимых SNP полиморфизмов (р<10-4), предрасполагающих к развитию ПЭ и проведено их независимое репликативное генотипирование в казахской популяции [1–6, 10]. Результаты генотипирования с расчетом частот генотипов и минорных аллелей изученных полиморфизмов в контрольной и основной группах представлены в табл. 1, 2.
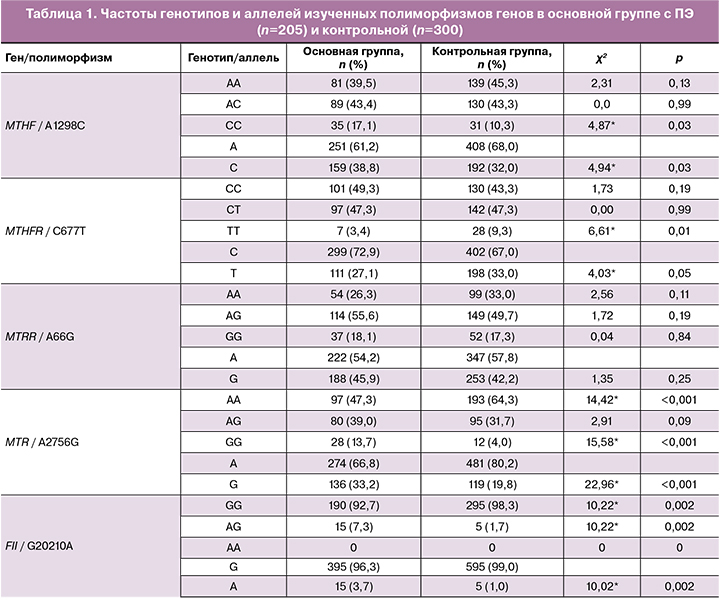
Как видно из табл. 1, выявлена статистическая значимость частоты носительства неблагоприятного гомозиготного генотипа СС гена MTHFR (А1298С) (χ2=4,87; р<0,03) и аллеля С (χ2=4,94; р<0,03), гомозиготного неблагоприятного генотипа GG (χ2=15,58; р<0,001) и аллеля G (χ2=22,96; р<0,001) гена MTR (A2756G) в основной группе с ПЭ по сравнению с контролем.
По генам свертывающей системы достоверные отличия выявлены для G20210А полиморфизма гена F2 по большей частоте встречаемости гетерозиготных генотипов AG (χ2=10,22; р<0,002) и неблагоприятного аллеля А (χ2=10,02; р<0,002) у женщин с развившейся ПЭ.
Материалы табл. 1 свидетельствуют о достоверных отличиях в сравниваемых группах по большей частоте носительства неблагоприятных генотипов по исследуемым полиморфизмам генов ангиотензин-рениновой системы. Частота носительства неблагоприятных генотипов DD гена АСЕ (I/Del), генотипов СС гена AGTR1 (A1166C), генотипов AA гена eNOS3 (Glu298Asp) и их неблагоприятных аллелей у женщин с ПЭ оказалась статистически значимой по сравнению (р<0,05) с аналогичными показателями в группе с неосложненным течением беременности.
Как показано в табл. 1, в группе с развившейся ПЭ частота носительства неблагоприятных СС генотипов и аллеля С (χ2=30,57; р<0,001; χ2=26,90; р<0,001 соответственно) полиморфизма (G5163C) гена ApoC3 статистически значима по сравнению с аналогичными частотами в контрольной группе.
Силу ассоциаций выражали в значениях отношения шансов (ОШ), рассчитанного по программе PLINK. Как видно из табл. 2, статистически значимое повышение риска развития ПЭ получены для носительства полиморфизмов A2756G гена MTR (OШ=2,0), G20210А гена свертывающей системы FII (OШ=4,5), генов альдостерон-ренин-ангиотензиновой системы AGTR1 (A1166C) и eNOS3 (Glu298Asp) (OШ=4,2 и 3,3 соответственно). Для носительства полиморфизмов (I/D) гена ACE и (G5163C) гена липидного обмена ApoC3 значения ОШ составили 1,5 и 2,0 (р<0,001), соответственно. Полученные результаты свидетельствуют о возможном генетическом вкладе носительства этих неблагоприятных аллелей в развитие ПЭ у беременных в казахской популяции, что подтверждается значениями ОШ.
Полученные результаты свидетельствуют о наличии взаимосвязи носительства патологических аллелей гена свертывающей системы крови (FII), альдостерон-ренин-ангиотензиновой системы (АСЕ, AGTR1), эндотелиальной дисфункции (eNOS3), липидного обмена (аполипопротеины) (ApoC3) с развитием ПЭ у беременных.
Носительство неблагоприятных генотипов является статистически достоверным генетическим фактором риска развития патологических процессов, приводящих к развитию тяжелого гестоза беременности в казахской популяции.
Обсуждение
ПЭ – осложнение беременности, в основе которого лежит генерализованная эндотелиальная дисфункция, ведущая к расстройству общего кровообращения во время беременности. Вариантом тяжелой ПЭ является HELLP-синдром (гемолиз, повышение уровня печеночных ферментов, тромбоцитопения), встречающийся приблизительно у 20% женщин с ПЭ, и характеризующийся дополнительным поражением печени и системы свертывания крови. Самой опасной стадией заболевания является эклампсия, сопровождающаяся развитием тяжелых тонико-клонических судорог и комы, а также поражением головного мозга, отеком головного мозга и развитием инсульта [2, 17–22].
Тяжелые осложнения, отсутствие эффективного лечения ПЭ требуют разработки эффективных прогностических маркеров риска развития ПЭ, основанных на носительстве предрасполагающих к ПЭ неблагоприятных генотипов.
Результаты репликативного генотипирования GWAS-значимых полиморфизмов генов фолатного обмена, ангиотензин-рениновой системы и липидного обмена определили статистически значимые ассоциации (р<0,002) с развитием ПЭ в казахской популяции по полиморфизмам генов: фолатного метаболизма – MTR (rs1805087), свертывающей системы – FII (rs1799963), альдостерон-ренин-ангиотензиновой системы – AGTR1 (rs5186), eNOS3 (rs1799983) и АСЕ (rs4340), липидного обмена – ApoC3 (rs5128).
Полученные результаты подтверждают тот факт, что в основе патогенеза ПЭ лежит патологическая инвазия трофобласта, связанная с острой дисфункцией эндотелия спиральных артерий, нарушениями систем гемостаза, ангиогенеза, ренин-ангиотензин-альдостероновой системы [1–3].
Заключение
Выявленные ассоциации носительства неблагоприятных генотипов с риском развития ПЭ позволят определить новые клинико-лабораторные критерии и предложить новые прогностические маркеры для оценки риска развития и ранней диагностики ПЭ и ее осложнений.



