Эндометриоз является одним из актуальных заболеваний в современной гинекологии и представляет собой мультифакторальное состояние, при котором происходит разрастание ткани, по морфологическим и функциональным свойствам подобной эндометрию, за пределами полости матки. Данное заболевание имеет некоторые характеристики злокачественного процесса: наличие локальных и отдаленных очагов, способность клеток к миграции, инвазии с последующим повреждением органов – мишеней [1, 2].
На сегодняшний день гистогенез эндометриоза яичников (ЭЯ) и эндометриоз-ассоциированных опухолей остаются предметом дискуссий. Риск возникновения злокачественных новообразований яичников при ЭЯ повышается в 2,5 раза [3]. В 12,1% наблюдений ЭЯ определяются фокусы метаплазии эпителия очагов эндометриоза, в 9,4% – гиперплазии, в 5,9% – атипии, а у 4,1% таких больных диагностируют рак яичников [4]. По данным других авторов, частота обнаружения фокусов атипии эпителия в очагах ЭЯ достигает 35–80% [5].
Рак яичников – гетерогенная в морфологическом и молекулярно-биологическом плане группа опухолей. Для серозных опухолей характерна мутация гена р53, для муцинозных – K-ras, для эндометриоидных – β-катенина и PTEN. Специфическим иммуногистохимическим маркером светлоклеточных опухолей яичников, который наиболее часто ассоциирован с ЭЯ, признан ядерный фактор гепатоцитов-1beta ( HNF-1β). Другие опухоли яичников и эндометрия HNF-1β не экспрессируют [6–8]. HNF-1β – белок суперсемейства транскрипционных факторов, связывающийся с ДНК в виде гомо- или гетеродимера и в норме участвующий в эмбриогенезе поджелудочной железы и нефрона. Мутации в гене, кодирующим этот транскрипционный фактор, обнаружены при поликистозе почек, некоторых видах сахарного диабета, а также ряде опухолей (яичников, эндометрия, предстательной железы, почек). HNF-1β играет важную роль в механизмах защиты клеток от окислительного стресса, подавляет апоптоз, взаимодействуя с ингибитором апоптоза Вcl-2 [6–8]. Показано, что гиперэкспрессия HNF-1β в светлоклеточных опухолях лежит в основе их резистентности к химиотерапии. Также, обсуждается роль HNF-1 β в механизме неопластической трансформации эпителия в очагах ЭЯ. Его экспрессия выявлена в эпителии 40% эндометриоидных кист яичников и чаще отмечается при атипии эпителия очагов эндометриоза [6–11].
Целью настоящего исследования явилось изучение морфологических и молекулярно-биологических признаков, указывающих на возможность неопластической трансформации эпителия очагов ЭЯ в целях снижения рецидивирования ЭЯ и сохранения фертильности у женщин репродуктивного возраста.
Материал и методы исследования
Для достижения поставленной цели, на основании архивного материала ГБУЗ ГКБ им. А.К. Ерамишанцева Департамента здравоохранения Москвы (ДЗМ) и ГБУЗ ГКБ им. братьев Бахрушиных ДЗМ за 2014–2016 гг., проанализированы истории болезней 147 пациенток репродуктивного периода с установленным диагнозом ЭЯ или рецидивирующего ЭЯ. Возраст обследуемых пациенток находился в диапазоне от 18 до 45 лет с преобладанием диапазона от 27 до 35 лет. Средний возраст пациенток составил 32,1 года.
По данным историй болезни была произведена оценка предъявляемых жалоб пациенток, разделенных на 3 основные группы (тазовая боль, бесплодие, нарушение менструального цикла). Производилась оценка гинекологического и соматического анамнеза пациенток с выявлением пациенток с ранее установленным диагнозом ЭЯ и проведенным оперативным лечением. Обрабатывались результаты лабораторных методов исследования (включая уровни онкомаркеров и АМГ), определялись основные закономерности в описании ультразвукового исследования органов малого таза до поступления на оперативное лечение в наши стационары.
После проведенной резекции яичников в связи с ЭЯ у обследуемой группы пациенток получено 147 гистологических препаратов, из которых для дальнейшего детального изучения было отобрано 78 фрагментов ткани яичников. Помимо этого, в исследование были включены 8 аденокарцином яичников (2 случая светлоклеточных, 2 случая высоко дифференцированных серозных, 2 случая эндометриоидных и 2 случая муцинозных). У пациенток с аденокарциномами ЭЯ в анамнезе и в операционном материале не отмечался.
В ходе проведения гистологического исследования и изучения отобранных наблюдений использовали стандартный метод фиксации в 10% нейтральном формалине, заливку в парафин, проведение гистологических срезов парафиновых блоков толщиной 3 мкм на роторном микротоме НМ355S (Thermo Scientific, Германия), расправленные на предметных стеклах с последующей окраской гематоксилином и эозином. Их изучение позволило подтвердить и уточнить патогистологический диагноз, выявить очаги эндометриоза в ткани яичников, помимо эндометриоидной кисты, а также отобрать парафиновые блоки для проведения иммуногистохимического исследования. ЭЯ был подтвержден на основании общепринятых морфологических критериев: наличие эпителиальной выстилки кисты и/или железистых структур из клеток эндометриоидного типа (с учетом реактивных, регенераторных, дистрофических, метапластических изменений и атипии), наличие эндометриоидной стромы и макрофагов с гемосидерином в инфильтрате и/или просвете кисты [12–14].
Иммуногистохимическим методом исследовали 35 наблюдений с ЭЯ (изучены с четырьмя моно- и поликлональными антителами) и 8 наблюдений с аденокарциномами яичников (изучены только с поликлональными антителами к HNF-1β). В качестве первичных, использовали антитела к ядерному белку Ki-67 (моноклональное антитело, клон MIB-1, DAKO, Норвегия, в разведении 1:150), ингибитору апоптоза Всl-2 (моноклональное антитело, клон 124, Cell Marque, США, в разведении 1:250), онкопротеину р53 (моноклональное антитело, клон DO7, Cell Marque, США, в готовом к использованию разведении), HNF-1β (поликлональное антитело, GeneTex, США, в разведении 1:200).
Постановку реакций осуществляли одномоментно для всего материала с целью получения сопоставимых данных, в соответствии с методикой S.R. Shi и соавт. и согласно протоколам, прилагаемым фирмами-изготовителями к моно- и поликлональным антителам [15, 16]. Для визуализации реакций применяли готовую тест-систему с универсальными вторичными антителами, мечеными хромогеном (3,3’-диаминобензидином) – Histophine (Nichirei Corp., Япония). Для оценки результатов иммуногистохимических реакций использовали метод Histochemical score (H-score) [17] с учетом количества и интенсивности окрашенных ядер (Ki-67, p53, HNF-1β) и цитоплазмы (Bcl-2) клеток: до 80 – низкая, 80–140 – умеренная, 141–300 – выраженная экспрессия. Подсчет проводили для 100 эпителиальных клеток в 3 случайным образом отобранных полях зрения при увеличении микроскопа х400. Результаты обрабатывали статистически с использованием программного обеспечения MS Office Excel и Statistica for Windows 10.0, представляли в виде среднего значения ± стандартное квадратическое отклонение (М±σ) и применяли метод непараметрического анализа по Манну–Уитни. Величина критического уровня значимости принималась равной 0,05.
Результаты исследования
В 73,5% случаев обследуемые пациентки при поступлении предъявляли жалобы, из которых наиболее частой являлось бесплодие (43,54% случаев) и тазовая боль (36,73% случаев); реже встречались нарушения менструального цикла (14,97% случаев).
В 10,20% случаев в анамнезе имело место ранее проведенное оперативное лечение ЭЯ, а у 1,4% пациенток отмечено и повторное оперативное лечение в связи с рецидивом ЭЯ. Время от первого оперативного лечения в связи с ЭЯ до рецидива ЭЯ составило: 0,25 года (3 месяца) у 1 человека , 1 год – у 3 человек, 2 года – у 3 человек, 3 года – у 1 человека, 4 года – у 4 человек, 5 лет – у 1 человека, 6 лет – у 1 человека, 8 лет – у 1 человека. В 1,4% случаев временной интервал от первичного рецидива с оперативным лечением до повторного рецидива, который также повлек за собой оперативное лечение до момента поступления в ГБУЗ ГКБ им. А.К. Ерамишанцева ДЗМ и ГБУЗ ГКБ им. братьев Бахрушиных ДЗМ составил 4 месяца и 72 месяца, соответственно. В дальнейшем только в 17,65% случаев была назначена медикаментозная гормональная терапия.
Отягощенный гинекологический и соматический анамнезы у обследуемых пациенток наблюдались в 48,3 и 51,7% случаев, соответственно. Наиболее частыми заболеваниями являлась эктопия шейки матки (44,44%), хронический сальпингоофорит (26,39%), миома матки (22,22%), аденомиоз (22,22%), а также заболевания желудочно-кишечного тракта (71,05%), сердечно-сосудистой системы (21,05%) и органов дыхания (11,84%).
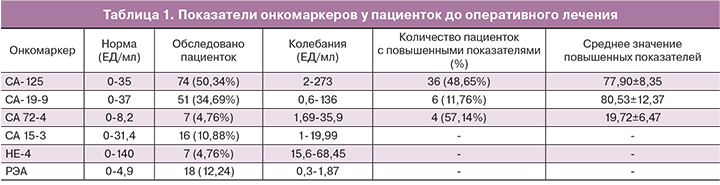
Все исследуемые пациентки перед поступлением на оперативное лечение в ГБУЗ ГКБ им. братьев Бахрушиных ДЗМ и ГБУЗ ГКБ им. А.К. Ерамишанцева ДЗМ были полностью лабораторно и инструментально обследованы на уровне женских консультаций. Оценка уровней онкомаркеров, таких как СА-19-9, СА-125, СА-72-4, НЕ4, РЭА до поступления, приведена в табл. 1.
Уровень АМГ был обследован в 2,04% случаев и все показатели до оперативного лечения находились в пределах референсных значений.
При проведении ультразвукового исследования до оперативного лечения ЭЯ в основном был описан как однокамерное одностороннее образование с размерами от 3 до 6 см (85,03% случаев) с анэхогенной структурой с мелкодисперсным содержимым (59,18% случаев). Стенки капсулы во всех случаях описывали, как четкие и ровные и только в 6,80% случаев определялось их уплотнение. Описание кровотока образования яичника было только в 6,80% случаев и во всех описанных протоколах образование являлось аваскулярным. Спаечный процесс в малом тазу описан лишь в 6,80% случаев, а наличие ретроцервикального эндометриоза – в 1,36% случаев. Таким образом, по классификации для эндометриоидных кист яичников (Л.В. Адамян, 1992, 1998), большинство из вышеизложенных описаний соответствовало II–III стадии заболевания [18].
В 82,99% случаев проведена лапароскопическая односторонняя резекция яичника в пределах пораженных тканей, в 12,24% случаев – двухсторонняя резекция. В 68,71% случаев проведена коагуляция очагов эндометриоза различной локализации, резекция ретроцервикального эндометриоза – в 1,36% случаях, адгезиолизис – в 60,54% случаев.
В дальнейшем все пациентки проходили наблюдение в условиях стационаров в целях контроля за эффективностью оперативного лечения и назначения или коррекции необходимой терапии после получения результатов гистологического исследования для снижения риска возможного рецидивирования эндометриоза для сохранения фертильности пациенток репродуктивного периода. Проводился контроль уровней онкомаркеров (СА-125, СА-19-9, СА-72-4, СА-15-3) и АМГ – все показатели находились в пределах референсных значений, совместно с ультразвуковым исследованием органов малого таза через 6 месяцев и через 1 год после оперативного лечения. По данным ультразвукового исследования наблюдалось незначительное уменьшение объема ранее резецированного яичника, однако, отчетливо визуализировался фолликулярный аппарат в достаточном количестве. В 6,8% случаев было зафиксировано развитие спаечного процесса в области оперированных придатков.
Важно отметить, что на фоне нашего наблюдения и назначенного лечения (агонист гонадотропин рилизинг гормона (аГнРГ) – 43,5%, комбинированные оральные контрацептивы (КОК) – 36,4%, комбинация аГнРГ и КОК – 20,1%) ни у одной пациентки не отмечено случаев рецидива ЭЯ, что предполагает адекватно проведенный объем оперативного лечения и правильно разработанную индивидуальную медикаментозную терапию эндометриоза. В 22,72% случаев у женщин с бесплодием в анамнезе в течение 1 года наблюдения наступила спонтанная прогрессирующая беременность.
По результатам гистологического исследования, из 78 изученных наблюдений ЭЯ в 43 случаях (55,1%) были выявлены от одного до 4 очагов эндометриоза в пределах резецированного фрагмента яичника с эндометриоидной кистой (представленные эпителиальным и стромальным компонентами) как в стенках кисты, так и на разном удалении от нее.
Из 78 изученных наблюдений в эпителии стенок эндометриоидных кист и/или других очагов эндометриоза были обнаружены микрофокусы или более крупные участки с синцитиальными папиллярными регенераторными (гиперпластическими) изменениями (31 наблюдение, 39,7%), метаплазией с появлением клеток типа «сапожного гвоздя с большой шляпкой» (12 наблюдений, 15,4%), очаговой гиперплазией (папиллярной, железисто-солидной, с участками плоскоклеточной метаплазии и атипии эпителия) – 3 наблюдения (3,9%). В 32 наблюдениях (41,0%) была выявлена атипия эпителия, где в 27 случаях (34,6%) атипия была расценена как «регенераторная/дистрофическая» [12–14], вследствие выраженной дистрофии эпителиоцитов в сочетании с накоплением межэпителиальных лейкоцитов и воспалительной инфильтрацией прилежащей стромы очага эндометриоза. В 5 случаях (6,4%) эти изменения отсутствовали и была диагностирована истинная, «неопластическая» атипия. В 1 наблюдении (1,3%) в стенке эндометриоидной кисты был обнаружен небольшой фокус муцинозной пограничной опухоли.
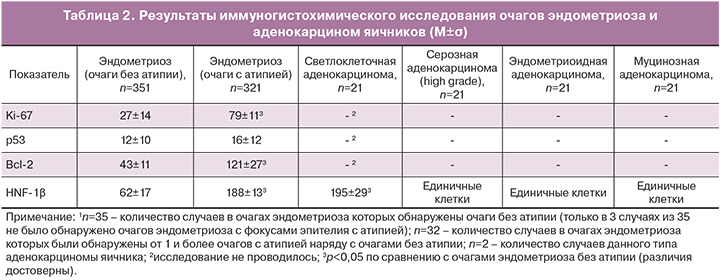
В 35 наблюдениях ЭЯ и в 8 – аденокарцином яичников было проведено иммуногистохимическое исследование, результаты которого представлены в табл. 2.
Таким образом, отмечена большая вариабельность экспрессии в эпителии очагов ЭЯ показателя пролиферативной активности Ki-67. Его уровень колебался от низкого до относительно высокого, преимущественно в фокусах с регенераторной/дистрофической и истинной атипией эпителия, в которых была более выражена экспрессия и других изученных антигенов. Экспрессия онкомаркера р53 была низкой, но и она также имела тенденцию к росту в очагах с регенераторной/дистрофической и истинной атипией эпителия (но статистически недостоверную). Уровень экспрессии ингибитора апоптоза Bcl-2 был различен, но, в основном, повышен в очагах с регенераторной/дистрофической и истинной атипией эпителия.
Важно отметить, что, в отличие от фокусов атипии, участки с синцитиальными папиллярными регенераторными (гиперпластическими) изменениями, с метаплазией с появлением клеток типа «сапожного гвоздя с большой шляпкой» и очаговой гиперплазией (папиллярной, железисто-солидной, с участками плоскоклеточной метаплазии) не отличались по экспрессии Ki-67, p53 и Bcl-2 от неизмененного эпителия эндометриоидного типа.
Экспрессия специфического фактора транскрипции светлоклеточных опухолей яичников и эндометрия HNF-1β была выявлена в ядрах эпителия большинства очагов эндометриоза (77,1%) из всех 35 изученных наблюдений. Она отмечалась, как в ядрах части эпителиоцитов эндометриоидных кист, так и эпителия других очагов эндометриоза (обнаруженных в стенках кист и на отдалении от них в ткани яичника), независимо от наличия метапластических или гиперпластических изменений эпителия. В 35 наблюдениях подсчет числа различных по морфологии очагов эндометриоза, показал, что в 16 случаях отсутствовали фокусы атипии и в 9 случаях из них (56,3%) определялась экспрессия HNF-1β. Ядра эпителия в очагах эндометриоза с фокусами атипии (регенераторной/дистрофической или истинной), выявленными в 19 случаях из 32 наблюдений, экспрессировали HNF-1β в 94,7% случаев (18 наблюдений). В муцинозной пограничной опухоли, выявленной в стенке эндометриоидной кисты в одном наблюдении, экспрессия HNF-1β отсутствовала. Каких-либо отличий (гистологических, молекулярно-биологических) очагов эндометриоза у больных с рецидивами ЭЯ отмечено не было.
Экспрессия HNF-1β, исследованная также в различных аденокарциномах яичника, была обнаружена только в светлоклеточных аденокарциномах. Эти опухоли отличались выраженной экспрессией этого маркера ядрами большинства опухолевых клеток. В других аденокарциномах ядра лишь единичных опухолевых клеток слабо или умеренно экспрессировали HNF-1β.
Обсуждение
Результаты данного исследования подтвердили высокую частоту развития как гистологических, так и молекулярно-биологических изменений в очагах ЭЯ, которые свидетельствуют о повышенном риске неопластической трансформации. Очаги ЭЯ с гистологическими признаками атипии эпителия, (регенераторно/дистрофическая в 34,6% наблюдений, и истинная в 6,4%) отличались повышенной экспрессией маркера пролиферации Ki-67, ингибитора апоптоза Bcl-2 и специфического фактора транскрипции светлоклеточных опухолей яичников HNF-1β, а также в очагах определялась тенденция к гиперэкспрессии онкомаркера р53. При этом не выявлено различий в повышенной экспрессии всех изученных антигенов в очагах регенераторной/дистрофической и истинной атипии. Возможно, это связано с высокой долей субъективности их гистологической дифференцировки. Общепринятые морфологические критерии их различия не существуют; отсутствие или наличие воспалительного инфильтрата (интраэпителиальных лейкоцитов, лимфоцитов) и дистрофические изменения эпителиоцитов не могут служить объективным критерием [12–14]. Также не выявлено особенностей очагов эндометриоза у больных с рецидивами ЭЯ.
Обнаруженные различия экспрессии Ki-67 и Bcl-2 в очагах с атипией эпителия и без нее позволяют объяснить причину того, что в одних исследованиях демонстрировалось повышение их экспрессии, а в других их гиперэкспрессия не подтверждалась. Кроме того, уровень данных маркеров в эндометрии и очагах эндометриоза подвержен изменениям в зависимости от фазы менструального цикла [19].
Исследование показало, что для эпителия очагов ЭЯ, независимо от наличия признаков его атипии, характерна гиперэкспрессия специфического фактора транскрипции светлоклеточных опухолей яичников и эндометрия HNF-1β, которая отмечена в 56,3% очагов без фокусов атипии и в 94,7% – с атипией. Это доказывает справедливость предположения о том, что гиперэкспрессия HNF-1β в эпителии очагов ЭЯ широко распространена и носит адаптационный характер [6–8]. Также подтверждается гистогенетическая связь ЭЯ именно со светлоклеточными опухолями яичников, для которых экспрессия HNF-1β является диагностическим маркером.
Заключение
Таким образом, перспективны дальнейшие молекулярно-биологические и генетические исследования ЭЯ, которые будут способствовать не только уточнению его взаимосвязи с опухолями яичников, но и решению проблемы происхождения самого эндометриоза. А благодаря этому появится возможность определять группы женщин репродуктивного периода, угрожаемых по предполагаемому развитию неопластического процесса и проводить тщательное наблюдение данной когорты пациенток с последующим необходимым объемом оперативного лечения.



