Рак шейки матки (РШМ) является четвертым по частоте выявления злокачественным новообразованием и третьей по распространенности причиной смерти от рака [1]. РШМ относится к опухолям визуальной локализации, что способствует обнаружению рака на ранних стадиях заболевания. В глобальном масштабе средний возраст при постановке диагноза РШМ составляет 53 года, варьируя от 44 лет (Вануату) до 68 лет (Сингапур). Средний возраст смерти от РШМ в мире составляет 59 лет, варьируя от 45 лет (Вануату) до 76 лет (Мартиника), также РШМ входит в тройку самых распространенных видов рака у женщин моложе 45 лет в 146 (79%) из 185 обследованных стран [2].
Существует значительное географическое неравенство в распространенности рака гинекологических органов у женщин: более 80% женщин, у которых был диагностирован РШМ, и 90% смертей от РШМ произошли в странах с низким уровнем дохода [3].
Доказано, что инфекция, связанная с вирусом папилломы человека (ВПЧ) высокого онкогенного риска, является ведущим этиологическим фактором развития инвазивного РШМ и предшествующих ему типов интраэпителиальной неоплазии шейки матки [4]. В последние десятилетия благодаря вакцинации против ВПЧ и скринингу на основе ВПЧ заболеваемость РШМ продолжает снижаться [2]. Большинство ВПЧ-инфекций устраняются иммунной системой, но у части женщин, чья иммунная система не справляется с ВПЧ, может развиться CIN высокой степени, а затем инвазивный РШМ [5].
Ежегодно в мире диагностируется более 40 млн новых случаев дисплазии шейки матки различной степени выраженности: плоскоклеточное интраэпителиальное поражение низкой или высокой степени. Поскольку дисплазия представляет собой динамический процесс, то может наблюдаться как регресс, так и прогресс данного заболевания.
Плоскоклеточное интраэпителиальное поражение низкой степени (Low Grade Squamous Intraepithelial Lesion, LSIL) регрессирует в 64,2% случаев [6].
При выявлении LSIL, в зависимости от возраста пациентки, чаще выбирается наблюдательная тактика (с периодом наблюдения от 18 до 24 месяцев) и динамической оценкой результатов цитологических мазков и результатов ВПЧ-теста каждые 12 месяцев ввиду высокой вероятности регресса [8].
Плоскоклеточное интраэпителиальное поражение высокой степени (High Grade Squamous Intraepithelial Lesion, HSIL) регрессирует только в 40% случаев [6].
Согласно оценкам, ежегодно во всем мире у 1–2% женщин развивается цервикальная интраэпителиальная неоплазия II–III степени (CIN II, CIN III), ее распространенность среди женщин, живущих с ВИЧ, составляет до 10% [7]. HSIL является истинным (облигатным) предраком шейки матки, если CIN II–III не лечить, она может перейти в РШМ.
Поэтому, в соответствии с клиническими рекомендациями «Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки» от 2024 г., при HSIL (CIN II, CIN III) рекомендуется проводить хирургическое лечение в виде петлевой эксцизии зоны трансформации или конизации шейки матки с последующим выскабливанием цервикального канала с целью исключения злокачественного процесса [8]. Основным побочным эффектом иссечения патологической зоны трансформации на шейке матки при HSIL являются преждевременные роды. Поэтому для женщин репродуктивного возраста актуально неинвазивное лечение [5].
Таким образом, лечение предраковых поражений является вторичной профилактикой РШМ [2]. В связи с этим представляется актуальным поиск схем для системной и местной фармакологической коррекции предраковых заболеваний шейки матки с помощью препаратов, таргетно воздействующих на патогенез CIN и на механизмы ее последующей опухолевой трансформации, эффективно блокирующих молекулярные механизмы патологической пролиферации и малигнизации ВПЧ-инфицированных клеток цервикального эпителия.
В последние годы особое внимание уделено использованию локального препарата на основе дииндолилметана, который в настоящее время имеет достаточно широкую доказательную базу по применению при данной нозологии.
Дииндолилиметан в форме вагинальных суппозиториев является оригинальным лекарственным препаратом, который был разработан в России ведущими экспертами в области молекулярной биологии и онкогинекологии. [9].
Механизмы фармакологического действия дииндолилметана изучены как в доклинических исследованиях (in vitro и in vivo), так и в клинических, и включают: стимуляцию апоптоза ВПЧ-инфицированных и трансформированных клеток, стимуляцию экспрессии рецепторов к γ-интерферону [18, 19]. Тем самым, в основе терапевтического эффекта дииндолилметана лежит его способность ускорять элиминацию пораженных ВПЧ и трансформированных клеток эпителия шейки матки и усиливать неспецифический иммунный ответ на инфекцию. Кроме того, дииндолилметан нормализует метаболизм эстрадиола в ВПЧ-инфицированных клетках, препятствуя образованию канцерогенного метаболита эстрогена (16α-гидроксиэстрона), стимулирующего экспрессию онкобелков ВПЧ [20]. Подавляя экспрессию онкобелка Е7 ВПЧ, дииндолилметан блокирует гормонозависимую патологическую пролиферацию ВПЧ-инфицированных клеток [9].
Отличительными преимуществами препарата являются: новый механизм действия, показание для лечения дисплазии шейки матки, эффективность в отношении регресса CIN, подтвержденная гистологическим методом исследования, локальное использование и отсутствие системного эффекта. Интравагинальный способ применения препарата позволяет увеличить концентрацию активного вещества в тканях шейки матки, инфицированных ВПЧ.
На сегодняшний день дииндолилметан в форме вагинальных суппозиториев является единственным лекарственным препаратом, непосредственно воздействующим на патогенез CIN. В целом, эффективность препарата, помимо обширной экспериментально-доказательной базы и данных об изучении свойств молекулы, была подтверждена в двух многоцентровых рандомизированных клинических исследованиях, а также в нескольких моноцентровых проспективных когортных исследованиях [9, 10, 19].
В то же время мы пришли к выводу, что требуются дополнительные данные об эффективности препарата в условиях реальной клинической практики.
Целью данного исследования стала оценка влияния локального применения препарата «Цервикон-ДИМ» на течение цервикальной интраэпителиальной неоплазии (LSIL/HSIL), ассоциированной с ВПЧ-инфекцией, в условиях рутинной врачебной практики.
Материалы и методы
Нами было проведено открытое наблюдательное исследование «ЦЕРЕРА» в условиях рутинной клинической практики. В проекте участвовало 10 российских клинических центров: ГБУЗ МО «Московский областной НИИ акушерства и гинекологии им. академика В.И. Краснопольского» (главный исследователь – Зароченцева Н.В.), ФГБУ «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства» (главный исследователь – Кедрова А.Г.), МРНЦ им. А.Ф. Цыба – филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» (главный исследователь – Мкртчян Л.С.), Читинская государственная медицинская академия (главный исследователь – Белокриницкая Т.Е.), ФГБУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины» (главный исследователь – Красильников С.Э., со-исследователь – Шумейкина А.О.), Институт медицины и психологии им. В. Зельмана НГУ (главный исследователь – Пасман Н.М.), ФГБНУ «Научный центр проблем здоровья семьи и репродукции человека» (главный исследователь – Сутурина Л.В.), Уральский государственный медицинский университет (главный исследователь – Исламиди Д.К.), Центр матери и ребенка г. Краснодара (главный исследователь – Попандопуло В.А.), ООО «Орловский центр кольпоскопии» (главный исследователь – Голубенко А.Е.).
Первичной задачей исследования стала оценка влияния препарата «Цервикон-ДИМ» на цитологические признаки LSIL/HSIL. Вторичными задачами стали оценка влияния терапии Цервикон-ДИМ на ВПЧ-инфекцию и оценка безопасности препарата «Цервикон-ДИМ» в условиях рутинной врачебной практики.
В исследование включали пациенток с цитологически подтвержденным диагнозом «слабовыраженная дисплазия шейки матки (CIN I/LSIL)», либо гистологически подтвержденным диагнозом умеренной дисплазии шейки матки после проведенного эксцизионного лечения (CIN II/HSIL). Обязательным критерием включения являлось наличие инфицирования ВПЧ (одним или более высокоонкогенным типом ВПЧ) по результатам качественного ПЦР-теста. Пациентки были включены в исследование после постановки диагноза и принятия врачом решения о назначении локальной терапии лекарственным препаратом «Цервикон-ДИМ» в форме вагинальных суппозиториев.
Критериями невключения в исследование были индивидуальная непереносимость любого из компонентов препарата «Цервикон-ДИМ», мочеполовые инфекции в фазе активного воспаления, за исключением ВПЧ, а также наличие противопоказаний к назначению препарата согласно инструкции по применению.
В исследование было включено 140 женщин в возрасте от 19 до 53 лет (средний возраст 32,7±8,5 лет). На первом визите пациентки были разделены на 2 группы в зависимости от типа поражения: пациентки с плоскоклеточным интраэпителиальным поражением низкой степени тяжести (CIN I/LSIL), подтвержденным результатами цитологического исследования (n=92), и пациентки с состоянием после эксцизии патологической зоны трансформации в связи с умеренной дисплазией шейки матки (CIN II/HSIL), подтвержденной результатами гистологического исследования (n=48). На первом визите после подтверждения диагноза по данным цитологического или гистологического исследования выполнялась расширенная кольпоскопия (РКС) с фото- и/или видеорегистрацией изображений и оценкой степени поражения шейки матки по Шведской шкале (Swede Score) в баллах [11], и определение наличия ДНК ВПЧ качественным методом (не менее 14 онкогенных вирусов) с обязательным типированием 16, 18 типов и 12 других типов ВПЧ высокого онкогенного риска.
Санация влагалища перед началом лечения препаратом с дииндолилметаном была проведена у 33% (46/140) пациенток.
Все пациентки получали локальную терапию препаратом «Цервикон-ДИМ» (действующее вещество дииндолилметан) в форме вагинальных суппозиториев, в дозе по 100 мг, производства ООО «Алцея» (Россия). Рекомендуемая схема применения: по одному суппозиторию 2 раза в сутки (суточная доза 200 мг). Продолжительность терапии в среднем составила 173±41,1 дня (от 1 до 186 дней). Хирургическое лечение до начала применения препарата «Цервикон-ДИМ» прошли 39% пациенток (54/140). После хирургического лечения препарат назначался через 8–30 дней после операции (медиана 17 дней). На втором визите суточная доза препарата «Цервикон-ДИМ» изменилась у 2% (3/134) пациенток, на третьем – у 1% (1/132) женщин. В указанных случаях лечащий врач принял решение о снижении суточной дозы с 200 мг до 100 мг.
На третьем визите выполняли контрольные обследования (РКC, цитологическое исследование, качественный ПЦР-тест на ВПЧ), в соответствии с рутинной клинической практикой учреждения. Наличие нежелательных реакций регистрировалось на втором и третьем визитах.
Первичной конечной точкой был цитологический исход лечения, который оценивался на основании результатов жидкостной онкоцитологии у пациентки на последнем визите (через 6 месяцев лечения от начала лечения).
Вторичной конечной точкой являлась оценка доли пациенток с элиминацией ВПЧ-инфекции к окончанию курса лечения препаратом «Цервикон-ДИМ». Дополнительной вторичной конечной точкой была оценка клинического исхода лечения, которая, по мнению лечащего врача, отражала динамику патологического процесса на основании полного комплексного обследования (с вариантами «полная регрессия», «частичная регрессия», «без изменений»).
Исследование было одобрено в рамках межвузовского этического комитета и локальных этических комитетов исследовательских центров. Все пациентки подписали информированное согласие на участие в исследовании. Исследование проведено в соответствии с Хельсинкской декларацией Всемирной Медицинской Ассоциации [12] и основными положениями Руководства по надлежащей клинической практике Международной конференции по гармонизации в части защиты прав участников исследования и обращения с данными (ICH GCP E6 R2) [13].
Результаты
Всего в исследование было включено 140 пациенток. Средний возраст участниц исследования составил 32,7±8,5 года (от 19 до 53 лет). Возраст 7 пациенток был старше 50 лет, из них трое были включены в группу CIN II/HSIL после проведения эксцизии, а четверо отнесены к группе CIN I/LSIL. Таким образом, в наблюдаемые нами когорты были включены пациентки разных возрастов.
На второй визит (через 3 месяца) 134 пациентки явились на осмотр к лечащему врачу. 6 пациенток завершили участие по следующим причинам: 2 женщины самостоятельно прекратили применение препарата «Цервикон-ДИМ» из-за его непереносимости, 3 – были потеряны для наблюдения, у 1 пациентки наступило улучшение и по решению лечащего врача дальнейшее лечение препаратом «Цервикон-ДИМ» было прекращено. На третий визит (через 6 месяцев от начала лечения) явились 132 пациентки. 2 пациентки не завершили участие в исследовании по следующим причинам: 1 – самостоятельно прекратила прием препарата по причине его непереносимости, другая была потеряна для наблюдения (рис. 1).
Учитывая наблюдательный характер исследования, не у всех пациенток из групп CIN I/LSIL и CIN II/HSIL были доступны данные по повторному цитологическому исследованию. В группе CIN I/LSIL было 47 таких пациенток, а в группе женщин с CIN II/HSIL – 12. В связи с этим в каждой из этих групп было выделено еще по 2 подгруппы в зависимости от наличия (Ц-плюс) или отсутствия (Ц-минус) результатов цитологического исследования на третьем визите.
Эффективность по первичной конечной точке (регрессия дисплазии по результатам цитологического исследования) оценивалась по группам женщин «Ц-плюс», в которых были доступны данные на окончание исследования.
Цитологическое исследование (тест по Папаниколау, ПАП-тест или жидкостная цитология) с поверхности шейки матки на третьем визите было проведено у 45,5% (60/132) пациенток: 48 пациенток из группы CIN I/LSIL-(Ц-плюс) и 12 пациенток из группы CIN II/HSIL-(Ц-плюс).
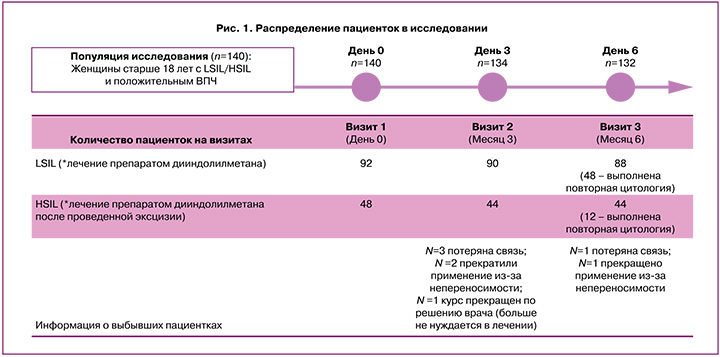
Через 6 месяцев лечения у 81% (39/48) женщин из группы CIN I/LSIL-(Ц-плюс) и у 100% (12/12) женщин в группе CIN II/HSIL-(Ц-плюс) отсутствовали интраэпителиальные поражения шейки матки (результат NILM), у 19% (9/48) пациенток из группы CIN I/LSIL-(Ц-плюс) цитологическая картина осталась без изменений (сохранялись признаки LSIL). Таким образом, полный регресс наступил у 81% женщин из группы LSIL-(Ц-плюс) и у всех женщин в группе HSIL-(Ц-плюс). В исследовании не отмечено прогрессирования процесса цервикальной интраэпителиальной неоплазии. (рис. 2).
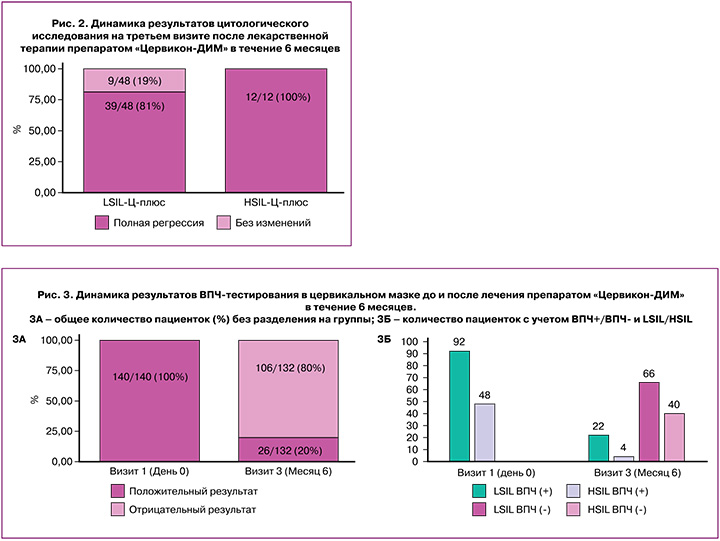
В отличие от цитологического исследования, ВПЧ-тестирование выполнялось у всех пациенток, явившихся на последний визит через 6 месяцев от начала исследования. ДНК ВПЧ исходно была выявлена у 100% участниц исследования (140/140), а на третьем визите положительный результат зарегистрирован только у 20% завершивших исследование пациенток (26/132) (рис. 3А). При этом элиминация ВПЧ-инфекции наблюдалась как у пациенток с LSIL, так и с HSIL: через 6 месяцев наблюдения отрицательный тест на ВПЧ был получен у 75% (66/88) женщин с CIN I/LSIL и у 91% (40/44) женщин с CIN II/HSIL (рис. 3Б).
По данным РКС, исходно на первом визите наличие кольпоскопических признаков CIN было установлено у 94% (132/140) женщин. На третьем визите кольпоскопические признаки поражения шейки матки сохранялись только в 55% (73/132) случаев. При расчете оценки по Шведской шкале на первом визите доля женщин с незначительными поражениями составила 50% (66/132), с пограничными результатами – 42% (56/132), значительными поражениями – 8% (10/132). На третьем визите по Шведской шкале оценивалось только 95 пациенток: незначительные поражения составили 92% (87/95), пограничные результаты – 8% (8/95), значительные поражения – 0%.
В 6% (8/140) случаев прием препарата «Цервикон-ДИМ» был прекращен преждевременно (ранее 6 месяцев): по причине полной регрессии LSIL (1 пациентка), непереносимости препарата (3 пациентки) или по причинам потери связи с пациенткой (4 пациентки).
Нежелательные явления, связанные, по мнению врача, с приемом препарата возникли у 4% (5/134) пациенток в первые 3 месяца терапии и у 2% (2/132) пациенток в период с 3-го по 6-й месяц терапии. Самым частым нежелательным явлением был зуд вульвы (n=5), который эффективно купировался локальным применением хлоргексидина (n=4) или прометазина (n=1). У 1 пациентки на втором визите выявлен неуточненный дерматит, по поводу чего было назначено лечение мазью с бетаметазоном и неомицином. На третьем визите у той же пациентки наблюдались признаки аллергического дерматита, для местного лечения была назначена комбинация гентамицин+бетаметазон+клотримазол, с положительным эффектом.
Обсуждение
Онкогинекологические заболевания являются причиной многочисленных смертей во всем мире и ложатся тяжелым экономическим бременем на женщин и их семьи [14]. РШМ продолжает оставаться серьезной проблемой общественного здравоохранения, затрагивающей женщин среднего возраста, особенно в странах с ограниченными ресурсами. Но широкое распространение вакцинации против ВПЧ и скрининга на ВПЧ, включая самостоятельный забор образцов, может сделать РШМ контролируемым заболеванием в ближайшие десятилетия [2]. Интересно, что пиковый возраст заболеваемости РШМ ниже в странах с высоким уровнем дохода. Это может быть вызвано различными факторами, такими как рост числа случаев заражения ВПЧ, более высокая доля женщин, проходящих скрининг, более ранний половой дебют и большое количество половых партнеров в прошлом [15]. Крайне важно внедрять комплексные стратегии профилактики, направленные на борьбу с растущей тенденцией среди молодых людей, и сокращать региональные различия [16]. Лекарственный препарат «Цервикон-ДИМ» был зарегистрирован в 2018 г. по результатам двойного слепого, рандомизированного, плацебо-контролируемого многоцентрового клинического исследования III фазы [9]. Его результаты продемонстрировали высокую эффективность препарата в лечении CIN I–II (LSIL/HSIL), что явилось основанием для регистрации в качестве лекарственного препарата [17].
Целью данного исследования была оценка состояния пациенток с CIN I–II (LSIL/HSIL), ассоциированной с ВПЧ-инфекцией, на фоне длительного лечения препаратом «Цервикон-ДИМ» в условиях рутинной клинической практики.
Результаты наблюдательного исследования «ЦЕРЕРА» подтвердили данные предыдущих исследований и продемонстрировали влияние длительного курса лечения препаратом «Цервикон-ДИМ» на улучшение результатов цитологического исследования и данных РКС, и элиминацию ВПЧ-инфекции.
Наблюдательный характер исследования не предполагал обязательного проведения повторного цитологического исследования после завершения курса терапии Цервиконом-ДИМ, хотя, согласно актуальным клиническим рекомендациям, цитологическое исследование необходимо проводить через 3 и 6 месяцев при наблюдении после эксцизионного лечения CIN II/HSIL [8].
Анализ результатов цитологического исследования на третьем визите показал, что в рутинной клинической практике не всем пациенткам выполняется повторное цитологическое исследование. К сожалению, ввиду ограничений дизайна исследования, данные о контрольном цитологическом исследовании через 6 месяцев терапии Цервиконом-ДИМ были доступны только у 54,5% (48/88) пациенток с LSIL и 27% (12/45) пациенток с HSIL. Авторы считают данное обстоятельство ограничением исследования, однако полученные цитологические результаты, по нашему мнению, позволяют сделать вывод об эффективности применения данного препарата. В течение 6 месяцев наблюдения ни у одной пациентки по данным цитологического и клинического исследований не было зафиксировано прогресса CIN (перехода в более тяжелую стадию).
По результатам исследования «ЦЕРЕРА» регресс заболевания в группе LSIL составил 81% (у 39/48 пациенток из группы LSIL), что демонстрирует более эффективный цитологический результат, чем обычно наблюдаемый при отсутствии активного лечения – 52–61% [9, 23, 24]. Одновременно с этим, в группе женщин с HSIL после проведенной эксцизии и лечения дииндолилметаном в форме вагинальных суппозиториев в течение 6 месяцев у всех 12 пациенток, по которым были доступны данные повторного цитологического исследования, определялось NILM (negative for intraepithelial lesion or malignancy – отсутствие интраэпителиального поражения или злокачественного новообразования).
Авторы отмечают, что закончили полное исследование с контрольной онкоцитологией не более половины участниц в каждой из групп (48/92 и 12/48, соответственно).
Полный либо частичный регресс признаков CIN по данным цитологического исследования, элиминация ВПЧ по данным ПЦР и улучшение данных РКС продемонстрировало положительную динамику в группах LSIL и HSIL. Сопоставление цитологической и клинической оценки показало необходимость комплексной диагностики. Не во всех случаях результаты цитологического обследования совпадают с результатами РКС.
В нашем исследовании наблюдался достаточно высокий процент элиминации инфекции ВПЧ через 6 месяцев наблюдения – у 80% женщин (106/132), прошедших обследование на ВПЧ через 6 месяцев от начала лечения Цервиконом-ДИМ (75% женщин с LSIL и 91% женщин с CIN II/HSIL). Так как в нашем исследовании не было группы контроля, и существуют данные о самоэлиминации инфекции, мы сравнили полученные данные с результатами крупных исследований по этой теме. Так, по данным популяционного исследования с участием 44 102 женщин, самоэлиминация инфекции ВПЧ у женщин с дискариозом/легкой дисплазией наблюдалась в 29% случаев (95% ДИ 24–34) [6].
Данные результаты по влиянию на инфекцию ВПЧ соотносятся с предыдущими экспериментальными и доклиническими исследованиями дииндолилметана. Так, ранее было показано, что дииндолилметан нарушает несколько стадий пролиферации ВПЧ, которые влияют на возникновение и прогрессирование дисплазии шейки матки до РШМ. Carter T.H. et al., а также Yuan F. et al. продемонстрировали, что дииндолилметан специфически ингибирует пролиферацию вирусных онкобелков E6 и E7 в кератиноцитах человека и клетках линии CaSki [25, 26]. В более позднем доклиническом исследовании Sepkovic D.V. et al. (2009), используя модель трансгенной мыши K14-HPV16, показали, что дииндолилметан ингибирует развитие онкогенных поражений шейки матки, вызванных онкогенами E6/E7 [27]. Элиминация инфекции ВПЧ так же была отмечена в других наблюдательных исследованиях, опубликованных позднее, – 87,8–91,5%, что, очевидно, является основанием для рекомендации препарата [21, 28]
Результаты лечения пациенток, получавших длительную терапию Цервиконом-ДИМ, продемонстрировали высокий уровень безопасности. Через 6 месяцев терапии дииндолилметаном у пациенток не зарегистрировано серьезных нежелательных явлений. Полученные результаты подтвердили и данные других исследователей о том, что препарат «Цервикон-ДИМ» эффективен в клинической практике для лечения CIN (LSIL без эксцизии/HSIL после эксцизии) c оптимальной длительностью лечения 6 месяцев [9, 19].
Безусловно, наше исследование имеет ряд объективных ограничений. Во-первых, данное исследование носило неинтервенционный характер, и представленные результаты необходимо интерпретировать сугубо как данные, полученные в условиях реальной клинической практики. Во-вторых, в нашем исследовании не было группы контроля, что подразумевается подобным дизайном исследования. Наконец, в нашем исследовании ввиду организационных сложностей, повторные данные о контрольном цитологическом исследовании шейки матки были собраны у 48/92 пациенток LSIL и 12/48 пациенток группы HSIL. Ограничением исследования является и длительность наблюдения после лечения (6 месяцев) с точки зрения оценки прогрессирования заболевания.
По нашему мнению, данные ограничения нивелируются тем, что использовались объективные методы контроля (цитологический метод, расширенная кольпоскопия) для оценки динамики патологического процесса. Кроме того, ценность данного исследования заключается в проспективном и организованном сборе данных по единому протоколу.
3,3’-дииндолилметан – это гетероциклическое биологически активное вещество, содержащееся в овощах семейства крестоцветных, таких как брокколи, цветная и брюссельская капуста. В клинических и доклинических исследованиях фармакодинамики препарата были показаны антиоксидантная и противоопухолевая активность дииндолилметана [29]. В то же время, данные исследований фармакокинетики дииндолилметана подтвердили невысокий уровень абсорбции препарата при пероральном применении, что послужило причиной разработки местной вагинальной формы [30].
В настоящее время препарат дииндолилметана в форме вагинальных свечей (Цервикон-ДИМ) имеет показание «лечение дисплазии шейки матки» и является оригинальным препаратом российской компании ООО «Алцея».
На сегодня накоплено достаточно данных об эффективности и безопасности препарата дииндолилметана (по результатам рандомизированных клинических исследований и целого ряда наблюдательных исследований) [9, 19, 20–23, 28]. Механизмы действия дииндолилметана в составе Цервикона-ДИМ характеризуют его как лекарственное средство, обладающее онкопротекторным эффектом [9, 10, 19].
Результаты нашего исследования полностью соотносятся с уже полученными данными, при этом мы наблюдали эффекты препарата в реальной клинической практике у пациенток с наличием подтвержденной инфекции ВПЧ. Интересно, что в нашем исследовании наблюдался высокий процент эрадикации инфекции ВПЧ (80%), что может послужить отправной точкой для дальнейших исследований препарата.
Заключение
Результаты исследования «ЦЕРЕРА» показали терапевтические эффекты препарата дииндолилметана в форме вагинальных суппозиториев в условиях реальной клинической практики при легкой и умеренной дисплазии шейки матки. Лечение препаратом дииндолилметана в свечах ассоциировано с высоким уровнем регрессии LSIL и эрадикации генитальной инфекции ВПЧ.



