В последние годы системе сосудисто-эндотелиальных факторов роста уделяется большое внимание, поскольку от ее функционирования в значительной степени зависит жизнеобеспечение системы «мать-плацента-плод», в сосудистой системе которой, а именно в участке имплантации, запускается важнейший биологический процесс, получивший название «ангиогенез» [1]. Именно с ангиогенезом связано нормальное развитие сосудистой сети и формирование плаценты. Отклонения в формировании сосудистой сети являются ведущим компонентом в патогенезе основных акушерских осложнений [2].
В современной научной литературе описано, что развитие беременности невозможно без четкого функционирования плацентарной сосудистой системы, формирование которой регулируется, наряду с другими внутриклеточными компонентами, факторами роста. Факторы роста представлены несколькими семействами пептидов и белков, которые вовлечены в паракринную, интракринную и аутокринную регуляцию клеточных реакций за счет связывания со специфическими рецепторами клеточной поверхности [3]. Рецепторы факторов роста расположены на поверхности наружной мембраны клеток. Взаимодействие факторов роста со специфичным рецептором вызывает изменение его конфигурации и активацию, что служит пусковым сигналом для реализации митогенного эффекта [1]. Адекватность деятельности системы сосудисто-эдотелиальных факторов роста в процессе беременности во многом влияет на процессы в маточно-плацентарно-плодовом комплексе. Очевидно, что, в свою очередь, гарантом успешного течения гестационного процесса, нормального внутриутробного развития плода и благоприятного исхода родов является адекватное функционирование маточно-плацентарной и плодово-плацентарной гемодинамики. Адаптация маточного кровотока к возрастающим потребностям плода осуществляется за счет вазодилатации и развития новых сосудов [1].
Нарушение экспрессии ангиогенных факторов: сосудисто-эндотелиального фактора роста-А (СЭФР-А), эпидермального фактора роста (ЭФР), фактора роста плаценты (ФРП), эндотелина-1 (ЭТ-1), а также важного регуляторного цитокина – фактора некроза опухоли-α (ФНО-α) является универсальным патогенетическим механизмом развития основных осложнений беременности [1]. Следовательно, ангиогенез – комплексный процесс, который при акушерских осложнениях, в том числе при плацентарной недостаточности (ПН) и задержке роста плода (ЗРП), сопровождается значительными нарушениями.
Важное значение для развития и физиологического течения беременности имеет еще одна группа полипептидных медиаторов – цитокины, среди которых выделяют про- и противовоспалительные, регуляторы клеточного и гуморального иммунитета. Цитокины активно участвуют в формировании иммунного ответа матери, и осуществляют связь между основными системами организма (нервной, иммунной, эндокринной) [4].
Однако при рассмотрении функциональных процессов в системе «мать-плацента-плод» и, в частности, совокупности сосудисто-эндотелиальных факторов и цитокинов, не учитывается важный аспект: подсистема «плод», являющаяся носителем генетически детерминированного признака – пола плода, роль которого в формировании особенностей течения беременности представляет большой научный интерес [5].
Цель исследования: изучение особенностей системы ангиогенных факторов и цитокинов в динамике физиологической и осложненной беременности во II и III триместрах в зависимости от пола плода.
Материал и методы исследования
Обследованы 390 женщин с физиологическим течением беременности, составившие 1-ю клиническую группу, из них 203 женщины – с плодами мужского пола, 187 – с плодами женского пола, и 345 женщин с ПН и ЗРП, включенные во 2-ю клиническую группу (176 женщин – с плодами мужского пола и 169 – с плодами женского пола), наблюдавшиеся в поликлиническом отделении ФГБУ Ростовский НИИ акушерства и педиатрии по системе «Акушерский мониторинг».
Исследование параметров биометрии и пола плода, а также маточной и плодовой гемодинамики осуществляли при помощи двумерного ультразвукового и допплерометрического исследования (УЗ-прибор «Toshiba (Eccocee) SSA-340» (Япония), 3,5 МГц, с цветным допплеровским картированием (регистрационное удостоверение ФС № 2005/1686). Определение уровня СЭФР-А, ЭФР, ФРП, ЭТ-1, ФНО-α, ИЛ-1, ИЛ-6, ИЛ-10, ИЛ-12 осуществляли при помощи иммуноферментного анализа с помощью прибора «TECAN» фотометр sunrise (производитель Tecan Austria GmbH Австрия) во II и III триместрах беременности. Критериями включения в клинические группы были: возраст беременных 20–35 лет, срок гестации 14–37 недель, нарушения в маточно-плацентарном комплексе (МПК) и/или фетоплацентарном комплексе (ФПК) по данным допплерометрии I–II степени, асимметричная и симметричная форма ЗРП, неудовлетворительные показатели биофизического профиля плода (несоответствие степени зрелости плаценты гестационному сроку, изменения характера сердечной деятельности, дыхательных движений, двигательной активности плода, тонуса плода). Критериями исключения были: возраст пациенток менее 20 и старше 35 лет, срок гестации – I триместр беременности, эндокринная патология, многоплодная беременность, тяжелая экстрагенитальная патология, а также аномалии развития внутренних половых органов, доброкачественные опухоли женской репродуктивной системы. По соматическому состоянию, возрасту наступления менархе и паритету родов группы были сопоставимы. Информированное согласие было получено у всех пациенток. Исследование было одобрено Локальным этическим комитетом института.
На этапе прегравидарной подготовки пациенткам проведен скрининг на инфекции, передаваемые половым путем, в связи, с чем в выборке отсутствовали женщины с урогенитальной инфекцией.
Статистическую обработку полученных результатов осуществляли при помощи программ статистической обработки информации из пакетов Statistica (Statsoft, версия 6.0), сертификат № 76456-OEM-0012344-54060. Объемы выборок пациенток удовлетворяют требованию статистической мощности исследований на уровне 80–85% [6]. Статистическое обоснование различий между группами пациенток проводилось с использованием U-критерия Манна–Уитни при максимально допустимом уровне вероятности ошибки первого рода р<0,05. Для классификации изучаемых факторов на основе их вероятности попадания в отдельный класс по степени значимости в зависимости от характера течения беременности и пола плода использовали метод «Деревья решений» [6]. Данные приведены в формате: медиана (25-й процентиль – 75-й процентиль).
Результаты исследования
В I клинической группе при анализе полученных данных в зависимости от градации «пол плода» было выявлено, что уровень СЭФР-А по мере прогрессирования беременности увеличивался у матерей как с плодами мужского, так и женского пола. Абсолютный уровень данного фактора во II триместре был достоверно выше у матерей девочек (р=0,00428) (табл. 1), что, по-видимому, связано с процессами стабилизации механизмов оксигенации в МПК в условиях крайне низкого содержания кислорода в этом сроке [1].
Что касается показателей СЭФР-А в III триместре беременности, то, как указывалось выше, обнаружен особенно значимый его рост относительно II триместра (в 1,7 раза) в случае женского пола плода. Эти данные представляют особый интерес, так как позволяют подтвердить разработанное А.В. Орловым (2006) [1] положение о «периоде прогрессирующей физиологической гипоксемии» в развитии внутриутробного плода. Такая высокая степень продукции СЭФР-А в III триместре физиологической беременности обусловлена, по-видимому, нарастанием гипоксемии, следствием которой в этом случае является генерация гипоксия-индуцируемого фактора HIF, контролирующего в процессе эмбриогенеза васкуляризацию [2].
Кроме того, согласно данным литературы СЭФР контролирует активность эндотелинпревращающего фермента, который контролирует синтез самого мощного вазоконстриктора – ЭТ-1.
Что касается показателей СЭФР-А в III триместре беременности, то, как указывалось выше, обнаружен особенно значимый его рост относительно II триместра (в 1,7 раза) в случае женского пола плода.
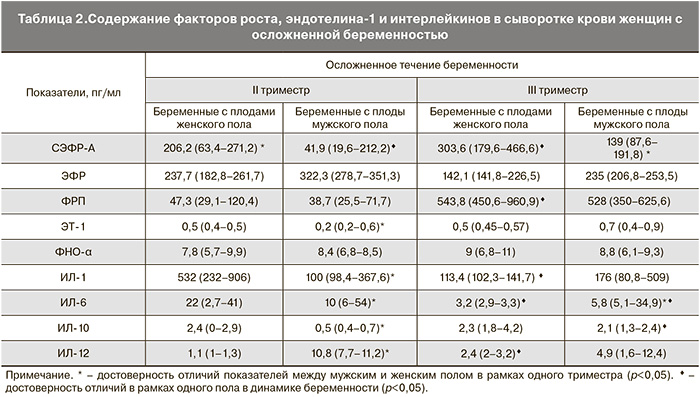
Одним из индикаторов риска патологических состояний беременности также является эндотелиальная дисфункция. Повреждение и последующая за ним дисфункция эндотелия приводят к нарушению эндотелий-зависимых механизмов регуляции сосудистого тонуса и сосудистой проницаемости, что лежит в основе развития многих акушерских осложнений [7]. В зависимости от градации «пол плода» установлено, что в сыворотке крови у матерей девочек в группе с физиологическим течением беременности во II и III триместрах содержание ЭТ-1 увеличивалось, тогда как в случае мужского пола – практически не изменялось. Если учесть важную роль ЭТ-1 в регуляции функции тонуса кровеносных сосудов [8], то становится очевидной более выраженная метаболическая целесообразность увеличения продукции этого полипептида при физиологическом течении беременности уже во II триместре и сохранения ее на данном уровне в III триместре преимущественно у беременных с плодами женского пола.
Сравнительное изучение содержания ЭФР в сыворотке крови женщин позволило выявить особенности его секреции в зависимости от пола плода. Результаты собственных исследований свидетельствуют, что при физиологической беременности уровень ЭФР во II и в III триместрах достоверно выше у матерей с плодами женского пола (р=0,00012). Напротив, у беременных с ПН и ЗРП регистрировалась более высокая концентрация ЭФР у матерей с плодами мужского пола (р=0,02131).
Известно, что в период имплантации и плацентации имеет место высокий уровень пролиферации и дифференциации клеток. Различные факторы роста включены в этот процесс, и контролируют его на разных этапах развития плаценты. В связи с этим формирование плаценты можно представить как серию скоординированных реакций, регулируемых локальными медиаторами. Среди последних существенная роль отводится ФРП, которому принадлежит приоритет в становлении и развитии плацентарного кровообращения, а также функционировании фетоплацентарного комплекса [1, 2]. В зависимости от пола выявлено, что как в случае мужского, так и женского пола по мере прогрессирования беременности в 1-й группе женщин отмечается прирост уровня ФРП в обеих подгруппах, однако уровень ФПР в зависимости от срока во II триместре – на 26,6%, а в III триместре – на 40,3% был выше у матерей девочек (табл. 1).
Значительное повышение содержания ФРП в процессе прогрессирования беременности, несомненно, обусловлено интенсивным ростом структур плаценты, которое должно быть скоординировано с развитием сосудистой системы, определяющим формирование капилляров ворсин на фоне инвазии трофобласта [9]. Регуляция данных процессов осуществляется при непосредственном взаимодействии ФРП с Flt-1 рецептором либо путем активации экспрессии СЭФР [8]. Это позволяет поддерживать СЭФР в высоко диффузном состоянии, увеличивая, таким образом, его ангиогенный эффект. Известно, что значительный рост продукции ФРП до 28 недель физиологически протекающей беременности отражает соответствующее увеличение объема плацентарного кровообращения. В нашем наблюдении отмечается резкое повышение содержания ФРП в сыворотке крови женщин 1-й группы более выраженное у матерей девочек в III триместре по сравнению со II (табл. 1).
Что касается ФНО-α при физиологически протекающей беременности (без учета пола плода), то его уровень в III триместре по сравнению со II триместром был выше в 1,2 раза. Такой характер продукции ФНО-α в процессе прогрессирования беременности, очевидно, обусловлен необходимостью обеспечения формирования соединительнотканного компонента хориона путем поддержания необходимой активности коллагеназы, в индукции которой участвует указанный фактор [1]. В то же время при анализе динамики данных показателей установлено, что повышение содержания этого фактора роста в общей выборке происходит за счет его величин у матерей мальчиков. Для матерей девочек, напротив, характерна тенденция к снижению уровня ФНО-α (табл. 1).
При сравнительном анализе содержания ИЛ-1, ИЛ-6, ИЛ-10, ИЛ-12 в сыворотке крови выявлено достоверное снижение в 2,5 раза по мере увеличения срока физиологической гестации у беременных с плодами женского пола (р=0,00261, р=0,00263, р=0,00264, р=0,00262), тогда как у матерей мальчиков изучаемые показатели (ИЛ-1,
ИЛ-10, ИЛ-12) увеличивались в 1,5 раза (р=0,02363, р=0,00264, р=0,00262) (табл. 1). Обнаружено, что уровень ИЛ-1, ИЛ-6, ИЛ-10 как во II, так и III триместрах беременности статистически значимо был выше у матерей с плодами женского пола (р=0,02432, р=0,00264, р=0,00214) (табл. 1), что свидетельствует о существовании различий в степени выраженности иммунного ответа, связанных с полом вынашиваемого плода.
На следующем этапе проводилось исследование уровня изучаемых полипептидов при осложненном течении беременности. Было обнаружено, что уровень СЭФР-А по мере приближения срока родов увеличивался у матерей как с плодами мужского, так и женского пола. Однако по сравнению с физиологическим течением беременности содержание этого фактора роста было достоверно выше у матерей девочек во II и III триместрах гестации (р=0,00423). Следует отметить, что уровень СЭФР-А у матерей с плодами женского пола при ПН и ЗРП во II триместре – в 5 раз, а в III триместре – в 2 раза выше, чем у беременных с плодами мужского пола (табл. 2).
При оценке представленных данных не остается сомнений, что нарушенная экспрессия СЭФР-А при осложненном течении беременности свидетельствует о выраженной гипоксемии в месте имплантации плодного яйца [4], преимущественно у матерей девочек.
У беременных с ПН и ЗРП в случае мужского и женского пола плода выявлено увеличение уровня ФРП по мере прогрессирования беременности (на 91 и 93% соответственно), однако уровень ФРП в зависимости от срока был выше во II триместре у матерей девочек (на 21%) (табл. 2).
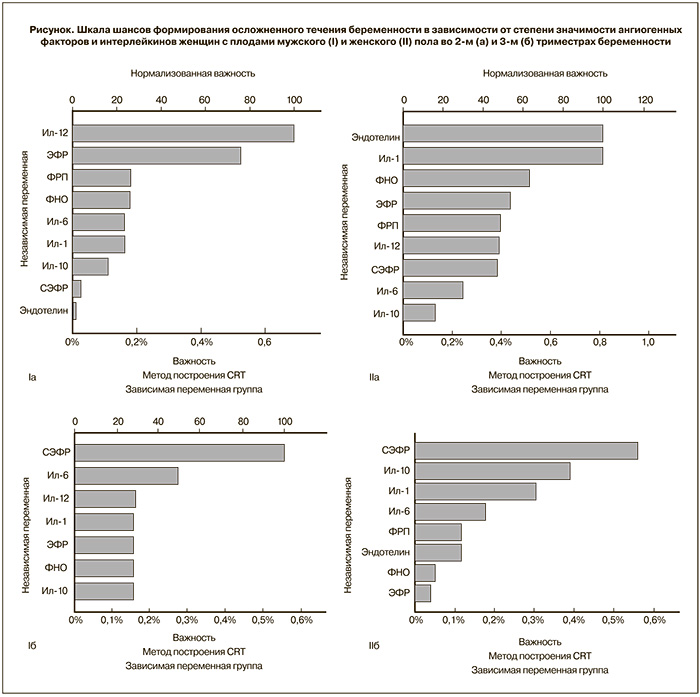
При анализе показателей ЭТ-1 выявлено, что его уровень был значимо выше во II триместре у матерей девочек (р=0,00012) (табл. 2) и практически не менялся в III триместре. Максимальный прирост уровня ЭТ-1 у матерей мальчиков отмечался в III триместре беременности (в 3,5 раза). Что касается ФНО-α при ПН и ЗРП, то во II и в III триместрах беременности выявлено незначительное повышение этого показателя у беременных как с плодами женского, так и мужского пола (на 10 и 4,5% соответственно).
При осложненной беременности, как и в случае ее физиологического течения, в сыворотке крови по мере приближения срока родов у беременных с плодами женского пола обнаружено достоверное снижение содержания ИЛ-1, ИЛ-6 более чем в 5 раз (р=0,004321 и р=0,003221) и повышение ИЛ-12 в 2 раза (р=0,00012). Тогда как у женщин с плодами мужского пола достоверно снижен уровень ИЛ-6 – в 1,7 раза (р=0,00134) и увеличен ИЛ-10 – в 4 раза (р=0,00422) (табл. 1 и 2). При сравнении абсолютных значений цитокинов у беременных с альтернативным полом плода было выявлено, что во II триместре содержание ИЛ-1, ИЛ-6, ИЛ-10 был значимо выше у матерей с плодами женского пола, тогда как в III триместре обнаружено более высокое содержание ИЛ-1, ИЛ-6 и ИЛ-12 у матерей с плодами мужского пола (табл. 2).
С целью оценки значимости изучаемых факторов для возникновения шанса развития плацентарной дисфункции был проведен анализ данных по методу «Деревья решений». Выявлено, что во II триместре беременности клинически значимой триадой факторов у матерей мальчиков были ИЛ-12, ЭФР, ФРП, тогда как для матерей девочек это были ЭТ-1, ИЛ-1, ФНО-α (рисунок). В III триместре ситуация несколько менялась: как для беременных с плодами мужского, так и женского пола самым значимым фактором в триаде оказался СЭФР-А, дополненный у матерей мальчиков ИЛ-6 и ИЛ-12, у матерей девочек – ИЛ-10 и ИЛ-1 (рисунок).
Ретроспективно на основании данных амбулаторных карт наблюдения и историй родов нами была проведена оценка особенностей течения беременности, родов и состояния новорожденных детей. Наиболее частым осложнением гестации в случае обоих вариантов пола плода была анемия беременных, однако у матерей девочек она регистрировалась чаще по сравнению с матерями мальчиков (46,6 и 40% соответственно). ЗРП чаще регистрировалась в течение беременности у матерей девочек (15,6%) по сравнению с альтернативным полом плода (13,6%).
Срочные роды достоверно чаще встречались у матерей девочек (93,7%) по сравнению с матерями мальчиков (84,8%), тогда как у матерей мальчиков значительно чаще регистрировались преждевременные роды (15,1%) по сравнению с матерями девочек (6,2% соответственно).
Наиболее частыми осложнениями в родах были: аномалия родовой деятельности, кровотечения, кесарево сечение, родовой травматизм матери. Оперативное родоразрешение в 2 раза чаще проводилось у матерей мальчиков. Кровотечение в последовом или раннем послеродовом периоде в 2,3 раза чаще встречалось также у матерей мальчиков. Аномалии родовой деятельности регистрировались у матерей мальчиков в 7,89% случаев и у матерей девочек – в 6,21%. Травматизм родовых путей чаще встречался также у матерей мальчиков, чем у матерей девочек (51,3 и 42,7% соответственно).
Заключение
Таким образом, полученные результаты свидетельствуют, что при физиологическом течении беременности в каждом триместре имеются определенные различия абсолютных уровней изученных полипептидов. У беременных с плодами женского пола на всех этапах как физиологической, так и осложненной беременности регистрируется более выраженная продукция сосудисто-эндотелиальных факторов и некоторых цитокинов, что свидетельствует об особенностях анатомо-функционального «запроса» со стороны маточно-плацентарно-плодового комплекса и различиях в формировании иммунного ответа у беременных при данном виде полового диморфизма. Важную роль в выявленной динамике изученных биоактивных полипептидов у беременных с плодами разного пола, по-видимому, играют эндокринные различия в организмах альтернативных плодов, поскольку экспрессия факторов роста и различных цитокинов находится под гормональным контролем системы «мать-плацента-плод».
Вероятность возникновения ПН согласно «шкале шансов» во II и III триместрах беременности повышается при определенном соотношении ангиогенных факторов роста и интерлейкинов, последовательность которых существенно отличается в группах с альтернативным полом плода.



