1) Department of Obstetrics and Gynecology, Faculty of General Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University), Ministry of Health of Russia, Moscow, Russia;
2) Academicians M.M. Shemyakin and Yu.A. Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences, Moscow, Russia
Objective. To study the level of expression of paraoxonases (PONs) in the cervical epithelium of healthy women and that of female patients with cervical dysplastic processes. To comparatively analyze the expression level of PON1, PON2, and PON3 between the groups. To identify the relationship of changes in the level of expression of PONs to the development of cervical dysplastic processes.
Subjects and methods. The investigation covered 47 patients who were divided into 3 groups: 1) 16 patients with CIN I-II; 2) 17 patients with CIN II-III; 3) 14 healthy women. The expression of paraoxonases was analyzed by real-time PCR using primers specific to these genes.
Results. The authors found a significant increase in the expression level of the PON3 gene in the cervical epithelium of women with cervical dysplastic processes compared to the control group. There were no significant differences in the level of PON2 expression between the two groups. PON1 gene expression was unidentified in all the samples.
Conclusion. During the investigation, the authors found a clear relationship between the higher expression of PON3 and the presence of CIN. The findings suggest that the enzyme PON3 may play a role in the development of dysplastic processes; therefore, determination of the level of PON3 expression may possess certain clinical potential in the diagnosis of precancerous cervical diseases. Thus, further researches in this area are required to develop new prognostic markers for the diagnosis of cervical dysplasia and diagnostic markers for the transition of CIN to cancer, which will be able to improve the quality of early diagnosis of precancerous diseases of the cervix and to optimize differentiated treatment policy.
paraoxonase 1
2
3
cervical dysplasia
oxidative stress
На сегодняшний день рак шейки матки (РШМ) является важнейшей мировой медицинской и социальной проблемой и занимает 2-е место среди всех злокачественных новообразований женской репродуктивной системы после рака молочной железы (РМЖ) [1, 2]. С каждым годом отмечаются рост заболеваемости и «омоложение» возраста пациенток с патологией шейки матки. По данным Международного агентства по изучению рака, стандартизированные показатели заболеваемости РШМ в 2012 г. составили 14,0 случаев на 100 000 женщин: из них в развитых странах – 9,9 ‱o, в развивающихся – 15,7‱o [3–5]. В России более 6,2 тысяч женщин ежегодно умирают от РШМ (4,6% среди всех злокачественных новообразований у женщин) [2]. Углубленное изучение патогенеза, поиск новых методов ранней диагностики и эффективных методов лечения патологии шейки матки представляется нам перспективным научным направлением, и, в конечном итоге, позволит улучшить данную неутешительную статистику.
Развитию диспластических процессов шейки матки способствуют многие внешние и внутренние факторы, наиболее значимыми из которых являются инфицированность вирусом папилломы человека (ВПЧ) [6], локальное воспаление [7] и окислительный стресс [8, 9]. Данная триада запускает триггерный механизм повреждения шеечного эпителия, что в конечном счете может привести к развитию РШМ. Окислительный стресс – это внутриклеточный дисбаланс между повышенным производством активных форм кислорода (АФК), разрушающих биологические молекулы, и сниженной активностью системы антиоксидантной защиты клетки [10]. АФК постоянно генерируются в аэробных клетках путем неполного восстановления молекулярного кислорода в молекулы воды во время митохондриального окислительного фосфорилирования, а также при воспалительных процессах, инфекциях, механических и химических повреждениях клеток, воздействии ультрафиолетового излучения и ионизирующего облучения [11, 12]. Эффект АФК на клетку напрямую зависит от их уровня: низкий уровень АФК поддерживает многие физиологические жизненно необходимые процессы, такие как клеточная пролиферация, дифференцировка и апоптоз, поддержание физико-химических свойств биологических мембран и регуляция активности протеинкиназ. Однако при высоком уровне АФК необратимо повреждают биологические макромолекулы, что приводит к гибели клеток [13].
Параоксоназы – это семейство ферментов, представленное PON1, PON2, и PON3, которые регулируют многие клеточные процессы за счет воздействия на рецепторы, активируемые пероксисомными пролифераторами PPAR [14]. Гены PON1 и PON3 присутствуют практически во всех клетках организма человека, а сами ферменты циркулируют в плазме в состоянии, связанном с липопротеинами высокой плотности (ЛПВП) [14, 15]. PON2 является внутриклеточным ферментом и не обнаруживается в плазме [14, 15]. По химическим свойствам параоксоназы относятся к классу гидролаз. Они нейтрализуют свободные радикалы кислорода, защищают липиды клеточных мембран от перекисного окисления, обладают противовоспалительными свойствами, а также регулируют процессы апоптоза [15]. Снижение активности параоксоназ сопровождается увеличением выраженности окислительного стресса и риска развития сосудистых, обменных нарушений, воспалительных заболеваний и опухолевого роста [16]. Изучив структуру и функции параоксоназ, мы выдвинули предположение, что данные ферменты могут влиять и на развитие диспластических процессов шейки матки. Несмотря на то что факторы риска развития РШМ достаточно хорошо изучены и в практику внедрены многие скрининговые программы, механизмы перехода дисплазии шейки матки в рак до сих пор остаются неизвестными. В связи с этим прогнозирование, ранняя диагностика и лечение остаются дискуссионными вопросами.
Цель исследования – изучить уровень экспрессии генов, кодирующих ферменты PON1, PON2 и PON3, в эпителии шейки матки здоровых женщин и при дисплазии шейки матки (цервикальная интраэпителиальная неоплазия (CIN) I–II и CIN II–III). Провести сравнительный анализ уровня экспрессии PON1, PON2 и PON3 между группами. Выявить взаимосвязь изменения уровня экспрессии параоксоназ с развитием диспластических процессов шейки матки.
Материалы и методы
В исследовании принимали участие 47 пациенток, которые были разделены на 3 группы: 1-я – пациентки с CIN I–II (n=16), 2-я – пациентки с CIN II–III (n=17), 3-я – здоровые женщины (n=14). Проведен анализ экспрессии генов, кодирующих PON1, PON2 и PON3, с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием праймеров, специфичных для данных генов.
Критерии включения в исследование: для 1-й и 2-й групп: пациентки в возрасте от 18 до 46 лет с установленными диагнозами CIN I–II и CIN II–III на основании цитологического и гистологического методов исследования; для группы контроля: женщины в возрасте от 18 до 46 лет с отсутствием патологии шейки матки при кольпоскопическом и цитологическом методах исследования.
Критерии исключения общие: женщины ювенильного, перименопаузального и постменопаузального периода (младше 18 лет и старше 46 лет); онкологические заболевания; острые воспалительные заболевания; тяжелая экстрагенитальная патология; аутоиммунные заболевания.
На первом этапе молекулярно-генетического исследования проводили биопсию шейки матки. При заборе в каждый образец добавляли 1 мл тризола с целью ингибирования работы РНКаз, затем гомогенизировали и быстро замораживали при температуре –80˚С. Выделение тотальной мРНК проводилось по протоколу Matz, 2002 г., синтез первой цепи кДНК – по протоколу фирмы «Евроген» для последующей амплификации генов. Уровень экспрессии PON1, PON2 и PON3 определяли методом ПЦР с обратной транскрипцией в реальном времени с помощью амплификатора LightCycler 96 Real-Time PCR System (Roche) с использованием праймеров, специфичных для PON1, PON2 и PON3 (таблица).
Условия проведения ПЦР следующие: 1 – предварительный нагрев 5 минут, 2 – 45 циклов (10 с – 95°, 30 с – 60°). Нормирование образцов кДНК проводилось по контрольному гену АСТВ, кодирующему актин. Затем проводили анализ экспрессии генов PON1, PON2 и PON3 в образцах.
Статистическая обработка результатов проведена с использованием компьютерной программы IBM SPSS Statistics 20. Описательные статистические данные представлены как абсолютные частотные значения. Значимость различий между выборками оценивали при помощи непараметрического статистического U-критерия Манна–Уитни. Описательная статистика количественных признаков представлена в виде среднего арифметического (М) и стандартной ошибки среднего (m) в формате М (m). Статистически значимыми считали различия при р<0,05.
 Результаты
Результаты
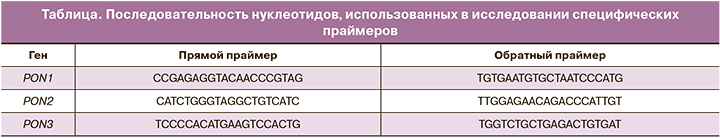
По результатам проведенного нами исследования установлено значимое повышение уровня экспрессии гена PON3 в эпителии шейки матки женщин с диспластическими процессами шейки матки относительно группы контроля (p<0,05, непараметрический критерий Манна–Уитни). Результаты графически отображены на рис. 1.
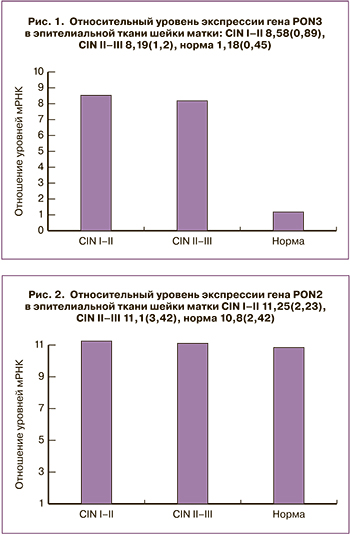
Стоит также отметить, что уровень экспрессии PON3 в 1-й и 2-й группах практически не отличался, следовательно, экспрессия PON3 не зависит от степени тяжести дисплазии. Не выявлено значимых отличий уровня экспрессии PON2 между всеми тремя группами (p>0,05, непараметрический критерий Манна–Уитни, рис. 2). Во всех образцах отсутствовала экспрессия гена PON1.
Заключение
В ходе исследования нами была выявлена четкая взаимосвязь между повышением уровня экспрессии PON3 и наличием CIN. Полученные результаты свидетельствуют о возможной роли фермента PON3 в развитии диспластических процессов; следовательно, определение уровня экспрессии PON3 может иметь определенный клинический потенциал в диагностике предраковых заболеваний шейки матки. Таким образом, требуется проведение дальнейших научных исследований в данном направлении с целью разработки новых прогностических маркеров диагностики дисплазии шейки матки, диагностических маркеров перехода CIN в рак, что позволит повысить качество ранней диагностики предраковых заболеваний шейки матки и оптимизировать дифференцированную лечебную тактику.
- Петрова Г.В. Рак шейки матки. Динамика основных статистических показателей. Иccледования и практика в медицине. 2016; 3 (Спецвыпуск: I Национальный конгресс «Онкология репродуктивных органов: от профилактики и раннего выявления к эффективному лечению» 19-21 мая 2016 года Москва): 134. [Petrova G.V. Cervical cancer. Dynamics of the main statistical indicators. Research and Practical Medicine Journal/Issledovaniya i praktika v meditsine. 2016; 3(Suppl.): 134. (in Russian)]. https://dx.doi.org/10.17709/2409-2231-2016-3-S.
- Давыдов М.И., Аксель Е.М., ред. Статистика злокачественных новообразований в России и странах СНГ в 2012 году. М.: Издательская группа РОНЦ; 2014. [Davydov M.I., Aksel’ E.M., eds. Statistika zlokachestvennykh novoobrazovanii v Rossii i stranakh SNG v 2012. Moscow: Izdatel’skaya gruppa RONTs; 2014. (in Russian)].
- Наврузова В.С. Анализ результатов хирургического лечения рака шейки матки пациенток фертильного возраста. Опухоли женcкой репродуктивной системы. 2015; 11(3): 87-96. [Navruzova V.S. Results of surgical treatment of cervical cancer patients of childbearing age. Tumors of Female Reproductive System/Opukholi zhenskoy reproduktivnoy sistemy. 2015; 11(3): 87-96. (in Russian)]. https://dx.doi.org/10.17650/1994-4098-2015-11-3-87-96.
- Bermudez A., Neerja B., Eric L. Cancer of the cervix uteri. Int. J. Gynaecol. Obstet. 2015. 131(Suppl. 2): S88-95. https://dx.doi.org/10.1016/j.ijgo.2015.06.004.
- Ferlay J., Soerjomataram I., Ervik M., Dikshit R., Eser S., Mathers C., eds. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012 v1.0 IARC CancerBase No. 11. 2012. Available at: http://globocan.iarc.fr
- Абакарова П.Р., Прилепская В.Н. ВПЧ-ассоциированные заболевания шейки матки. Возможности комплексной терапии. Гинекология. 2017; 19(5): 4-9. [Abakarova P.R., Prilepskaya V.N. HPV-associated diseases of the cervix. Complex therapy options. Ginecology/Ginekologiya. 2017; 19(5): 4-9. (in Russian)].
- Murata M. Inflammation and cancer. Environ. Health Prev. Med. 2018; 23(1): 50. https://dx.doi.org/10.1186/s12199-018-0740-1.
- Джалалова П.М., Томилова И.К., Алексахина Е.Л., Лапочкина Н.П. Роль локального оксидативного стресса в патогенезе интраэпителиальной дисплазии и рака шейки матки. Иccледования и практика в медицине. 2016; 3(Спецвыпуск: I Национальный конгресс «Онкология репродуктивных органов: от профилактики и раннего выявления к эффективному лечению» 19–21 мая 2016 года Москва): 68-9. [Dzhalalova P.M., Tomilova P.M., Aeksahina E.L., Lapochkina N.P. The role of local oxidative stress in the pathogenesis of intraepithelial dysplasia and cervical cancer. Research and Practical Medicine Journal/Issledovaniya i praktika v meditsine. 2016; 3(Suppl.): 68-9. (in Russian)]. https://dx.doi.org/10.17709/2409-2231-2016-3-S.
- Gupta R.K., Patel A.K., Shah N., Chaudhary A.K., Jha U.K., Yadav U.C. et al. Oxidative stress and antioxidants in disease and cancer: a review. Asian Pac. J. Cancer Prev. 2014; 15(11): 4405-9. https://dx.doi.org/10.7314/apjcp.2014.15.11.4405.
- Ebrahimi S., Soltani A., Hashemy S.I. Oxidative stress in cervical cancer pathogenesis and resistance to therapy. J. Cell. Biochem. 2018; Nov 13. https://dx.doi.org/10.1002/jcb.28007
- Ray P.D., Huang B.W., Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling. Cell. Signal. 2012; 24(5): 981-90. https://dx.doi.org/10.1016/j.cellsig.2012.01.008.
- Droge W. Free radicals in the physiological control of cell function. Physiol. Rev. 2002; 82(1): 47-95.
- Кормош Н.Г. Физиологическая роль активных форм кислорода (субклеточный уровень) – взгляд клинициста. Российский биотерапевтический журнал. 2011; 10(4): 29-35. [Kormosh N.G. Physiological role of a reactive oxygen species (subcellular level) – clinician viewpoint. Russian Journal of Biotherapy/Rossiiskii bioterapevticheskii zhurnal. 2011; 10(4): 29-35. (in Russian)].
- Боровкова Е.И., Антипова Н.В., Корнеенко Т.В., Шахпаронов М.И., Боровков И.М. Параоксоназа: универсальный фактор антиоксидантной защиты организма человека. Вестник Российской академии медицинских наук. 2017; 72(1): 5-10. [Borovkova E.I., Antipova N.V., Korneenko T.V., Shakhparonov M.I., Borovkov I.M.Paraoxonase: the universal factor of antioxidant defense in human body. Annals of the Russian academy of medical sciences/Vestnik Rossiiskoi akademii meditsinskikh nauk. 2017; 72(1): 5-10. (in Russian)].
- Ефимцева Э.А., Челпанова Т.И. Параоксоназа: молекулярно-генетические аспекты и клиническое значение. Успехи современной биологии. 2012; 132(3): 282-96. [Efimtseva E.A., Chelpanova T.I. Paraoxonase: molecular genetic aspects and clinical value. Biology Bulletin Reviews/Uspekhi sovremennoi biologii. 2012; 132(3): 282-96. (in Russian)].
- Furlong C.E., Marsillach J., Jarvik G.P., Costa L.G. Paraoxonases-1, -2 and -3: What are their functions? Chem. Biol. Interact. 2016; 259(Pt B): 51-62. https://dx.doi.org/10.1016/j.cbi.2016.05.036.
Received 19.11.2019
Accepted 29.11.2019
Sergey Levakov, MD, PhD, professor, head of the Department of Obstetrics and Gynecology, FSAEI HE I.M.Sechenov First MSMU MOH, Russia.
Address: Trubetskaya street 8/2, Moscow, 119991, Russian Federation.
Natalya Sheshukova, MD, PhD, professor of the Department of Obstetrics and Gynecology, FSAEI HE I.M.Sechenov First MSMU MOH, Russia.
Address: 119991, Russian Federation, Moscow, Trubetskaya street 8/2.
Elizaveta Obukhova, graduate student of the Department of Obstetrics and Gynecology, FSAEI HE I.M.Sechenov First MSMU MOH, Russia. Address: Trubetskaya street 8/2, Moscow, 119991, Russian Federation.
Nadezhda Antipova, Candidate of Biological Sciences, researcher of the Shemyakin-Ovchinnikov Institute of bioorganic chemistry of the Russian Academy of Sciences, associate professor of the Department of Pharmaceutical and Toxicological Chemistry of the Peoples’ Friendship University of Russia. Address: 117997, Moscow, GSP-7, ul. Miklukho-Maklaya, d. 16/10.
Marat Pavlyukov, Candidate of Biological Sciences, researcher of the Shemyakin-Ovchinnikov Institute of bioorganic chemistry of the Russian Academy of Sciences. Address: 117997, Russia, Moscow, ul. Miklukho-Maklaya, d. 16/10.
Mikhail Shakhparonov, Doctor of Chemical Sciences, Leading Researcher of the Shemyakin-Ovchinnikov Institute of bioorganic chemistry of the Russian Academy of Sciences.
Address: 117997, Moscow, GSP-7, ul. Miklukho-Maklaya, d. 16/10.
For citation: Levakov S.A., Sheshukova N.A., Obukhova E.A., Antipova N.V., Pavlyukov M.S., Shakhparonov M.I. The expression level of paraoxonases in cervical dysplastic processes.
Akusherstvo i Ginekologiya/ Obstetrics and gynecology. 2020;2:149-53. (In Russian).
https://dx.doi.org/10.18565/aig.2020.2.149-153

 Результаты
Результаты


