Понятие о тромботической микроангиопатии и тромботической тромбоцитопенической пурпуре
Тромботическая тромбоцитопеническая пурпура (ТТП) в настоящее время рассматривается как одна из наиболее тяжелых патологий, ассоциированных с микрососудистым тромбозом. Впервые была описана Eli Moschowitz в 1923 году. Он наблюдал 16-летнюю девушку с лихорадкой, анемией, петехиями, параличом и комой. При аутопсии были обнаружены гиалиновые тромбы в микрососудистом русле. В 1955 г. Gasser и соавт. описал 5 детей с острой почечной недостаточностью, сопровождавшейся гемолитической анемией и тромбоцитопенией, и ввел в клиническую практику термин гемолитико-уремический синдром (ГУС).
В настоящее время ТТП и ГУС рассматриваются как проявления тромботической микроангиопатии. Этот патологический процесс был впервые описан Symmers и соавт. в 1952 году. Тромботическая микроангиопатия морфологически проявляется утолщением стенок сосудов микроциркуляторного русла (преимущественно капилляров и артериол), отеком и слущиванием эндотелиальных клеток от базальной мембраны, образованием тромбоцитарных сгустков и частичной или полной обструкцией просвета пораженного сосуда, при этом периваскулярное воспаление не характерно, а тромбы состоят почти исключительно из тромбоцитов. Обструкция просвета сосудов приводит к развитию ишемии и инфарктов органов. Характерным признаком тромботической микроангиопатии является тромбоцитопения и гемолитическая анемия, что связано с потреблением и разрушением тромбоцитов и эритроцитов в микроциркуляторном русле [1, 2].
Клинические проявления тромботической микроангиопатии зависят от локализации повреждения микрососудов и, следовательно, от вовлечения в патологический процесс различных органов. Так, ТТП характеризуется пентадой симптомов: тромбоцитопения, микроангиопатическая анемия, лихорадка, поражение почек и неврологическая симптоматика. Неврологические проявления ТТП крайне разнообразны и варьируют от небольших нарушений поведения и затуманенности сознания до выраженных сенсорно-моторных нарушений, афазии, судорог и комы. Для ГУС также характерна тромбоцитопения и микроангиопатическая гемолитическая анемия, но с преимущественным поражением почек. Кроме того, при ТТП могут наблюдаться боли в животе, панкреатит, гематурия, нарушения сердечного ритма, нарушения зрения.
Патогенез тромботической микроангиопатии
Характерным признаком ТТП является дефицит плазменной протеазы, расщепляющей мультимеры vWF – ADAMTS 13 (a disintegrin and metalloprotease with trombospondin type 1 motifs – дизинтегрин и металлопротеаза с последовательностями тромбоспондина 1-го типа). При семейных формах ТТП (синдрома Апшоу–Шульмана) наблюдается наследственный дефект этого фермента, в то время как приобретенные формы ТТП характеризуются наличием антител-ингибиторов vWF-протеазы [3].
Фактор Виллебранда представляет собой высокомолекулярный мультимер, образующийся при полимеризации мономерных субъединиц с молекулярной массой 225 кДа в эндотелиальных клетках и мегакариоцитах, и накапливающийся в тельцах Weibel-Palade в эндотелиальных клетках и альфа-гранулах тромбоцитов [4].
Эти ультравысокомолекулярные мультимеры vWF (ULVWF) секретируются активированными эндотелиоцитами наподобие «лент». Мультимерные «ленты» ULVWF могут фиксироваться на поверхности мембран эндотелиальных клеток при помощи Р-селектина, который секретируется из телец Weibel-Palade одновременно с ULVWF. В результате в условиях относительного или абсолютного дефицита ADAMTS 13 микрососуды оказываются перекрытыми гигантскими ультравысокомолекулярными vWF, на которых оседает все возрастающее количество тромбоцитов, образуя блокирующие микрососудистое русло тромбоцитарные тромбы [5, 6].
При тяжелом генетически обусловленном дефиците ADAMTS 13 эпизоды ТТП могут начаться с раннего детства, однако у ряда больных заболевание долго может себя не проявлять вплоть до воздействия какого-либо сильного провоцирующего фактора. Например, триггером для развития первого эпизода ТТП у таких больных может стать беременность, различные инфекционные заболевания и септические состояния, сопровождающиеся массивным выбросом провоспалительных цитокинов, а также прием оральных контрацептивов, так как содержащиеся в них эстрогены стимулируют выброс ультравысокомолекулярных мультимеров vWF из эндотелиоцитов [6, 7].

У ряда больных с выраженным наследственным дефицитом ADAMTS 13 (активность ADAMTS 13 в плазме крови менее 5–10%) ТТП принимает хроническое рецидивирующее течение с рождения, а ведущим синдромом становиться прогрессирующая почечная недостаточность [8]. При редкой врожденной форме ТТП рецидивы могут возникать каждые 3–4 недели. Такую форму заболевания часто называют хронической рецидивирующей ТТП. У двух третей больных с относительно более распространенной приобретенной формой ТТП в случае успешной терапии повторные эпизоды не возникают, тогда как у трети больных развиваются рецидивы [9]. Когда именно разовьется рецидив, предсказать невозможно. Период ремиссии может длиться от нескольких дней до десятков лет, однако наиболее часто рецидив развивается в течение года после первого эпизода ТТП. Триггером к развитию рецидива могут служить беременность, хирургическое вмешательство, инфекция, вакцинация [10].
В настоящее время принята следующая классификация тромботических микроангиопатий (табл. 1).
Особенности тромботической микроангиопатии, ассоциированной с беременностью. Новый взгляд на патогенез тяжелых форм преэклампсии
Беременность по праву считает одним из важнейших триггерных факторов для развития ТТП. В 12–31% случаев ГУС/ТТП развивается во время беременности или в раннем послеродовом периоде [11, 12]. Заболеваемость ТТП во время беременности составляет 1 на 25–100 000 [11]. До внедрения в клиническую практику плазмафереза материнская смертность при ГУС/ТТП составляла 95%, а перинатальная – 80% [12]. Во время беременности наблюдается с одной стороны прогрессивное повышение уровней vWF, вероятно, под действием эстрогенов, а с другой стороны, снижение активность ADAMTS 13, что может быть обусловлено повышенным потреблением этого фермента, действие которого направлено на разрушение избыточных количеств ультравысокомолекулярных мультимеров vWF, экспрессируемых активированным эндотелиоцитами. Таким образом, беременность может стать провоцирующим фактором для развития ТТП при генетическом дефекте ADAMTS 13. Кроме того, ТТП во время беременности описана и у пациенток с антителами к ADAMTS 13. Был описан интереснейший клинический случай: у 23-летней женщины в течение 73 месяцев было четыре беременности, заканчивавшиеся самопроизвольными абортами в первом триместре, после чего у нее развивались эпизоды ТТП, регрессировавшие на фоне лечения кортикостероидами и плазмаферезом. После имплантации противозачаточного средства новых эпизодов ТТП не отмечалось [13]. В настоящее время критериями для постановки диагноза из 5 характерных признаков этого заболевания служат только тромбоцитопения и микроангиопатическая гемолитическая анемия. Клинически ТТП/ГУС в этом случае часто бывает трудно отличить от тяжелой формы преэклампсии, эклампсии и HELLP-синдрома, для которых также характерно развитие тромоцитопении и микроангиопатической гемолитической анемии. Ситуация осложняется еще и тем, что HELLP-синдром и экламптические судороги могут развиваться в отсутствие типичных признаков тяжелой преэклампсии [14, 15].
Так, по данным V. Katz и соавт. (2000), у 60% женщин эклампсия развилась на фоне нормального артериального давления и была первым проявлением преэклампсии [16].
Таким образом, развитие тромботической микроангиопатии, характерно и для HELLP-синдрома, ТТП, ГУС, а также является одним из проявлений катастрофического антифосфолипидного синдрома (КАФС). Это свидетельствует о едином механизме патогенеза этих заболеваний. Известно, что АФС ассоциируется с высокой частотой развития таких патологий беременности, как задержка роста плода, внутриутробная гибель плода, преждевременные роды, преэклампсия. Кроме того, рядом исследователей описаны случаи возникновения HELLP-синдрома у женщин с АФС, что лишний раз подтверждает роль патологии гемостаза как предрасполагающего фактора к возникновению HELLP-синдрома. Koenig и соавт. (2005) описали женщину с АФС, у которой беременность осложнилась развитием HELLP-синдрома, а после оперативного родоразрешения развилась клиническая картина КАФС с инфарктами печени, желудочно-кишечного тракта и костного мозга вследствие прогрессирующей микроангиопатии [17]. Следует также учитывать, что HELLP-синдром может быть первым проявлением АФС. Появились данные о роли антител к ADAMTS 13 в качестве причины тромбоцитопении у больных системной красной волчанкой, что может быть одним из критериев неблагоприятного прогноза заболевания у таких пациентов [18] O. Pourrat и соавт. (2013) описывают взаимосвязь между дефицитом ADAMTS 13 и развитием HELLP-синдрома [19]. Более того, появились интересные данные о том, что антитела к ADAMTS 13 могут формироваться в условиях АФС, что может являться важнейшим фактором развития тромботичсеких и акушерских осложнений [20]. Таким образом, антитела к ADAMTS 13 и дисфункция ADAMTS 13 может развиваться и при других аутоиммунных заболеваниях, помимо приобретенной ТПП, в частности, в условиях АФС.
Согласно нашей концепции, наследственный и/или приобретенный дефицит ADAMTS 13 наряду с генетический тромбофилией и АФС, включая катастрофическую его форму, должен рассматриваться как один из значимых патогенетических факторов возникновения критических состояний в акушерстве. Все женщины, перенесшие тяжелые формы преэклампсии, HELLP-синдром, преждевременную отслойку нормально расположенной плаценты, септический шок, геморрагический шок, должны быть обследованы на выявление активности ADAMTS 13 и наличия ее ингибиторов. В случае отягощенного анамнеза и выявления нарушений в системе ADAMTS 13 оценка уровней этого фермента и титров его ингибитора в течение беременности в динамике позволит оценить риски развития повторных тяжелых тромботических и акушерских осложнений и своевременно принять вопрос о дальнейшей тактике ведения пациентки и необходимости в досрочном родоразрешении.
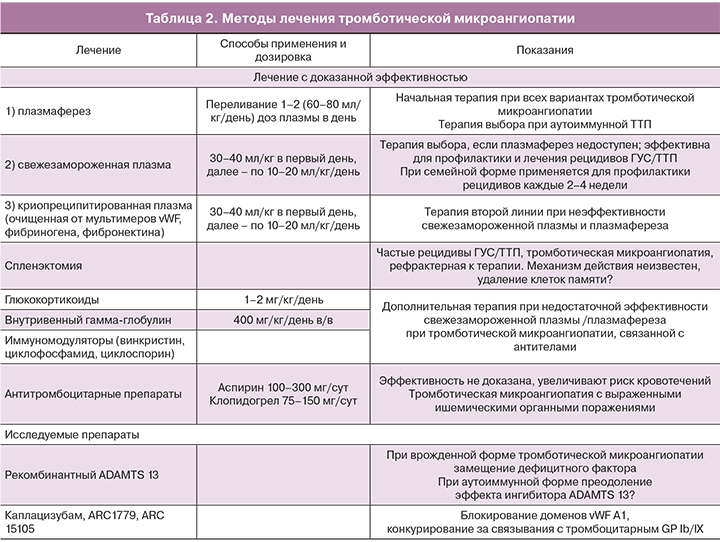
Принципы терапии ГУС/ТТП
Терапией выбора при ТТП/ГУС является применение свежезамороженной плазмы или плазмаферез. Применение обменного переливания плазмы позволяет снизить уровень смертности при ГУС/ТТП с 80 до 10%. Впервые эффективность обменного переливания плазмы была показана у пациента с ТТП Rubinshtein в 1959 году. Целью применения плазмафереза является возмещение уровня vWF-протеазы, удаление антител, блокирующих активность ADAMTS 13, провоспалительных цитокинов, компонентов комплемента из системного кровотока, а также возмещение дефицита естественных антикоагулянтов, что особенно важно при сочетании ТТП/ГУС с генетическими тромбофилиями и АФС. При наследственной форме, обусловленной гомозиготной или двумя гетерозиготными мутациями ADAMTS 13, эффективно применение свежезамороженной плазмы, а для профилактики рецидивов заболевания переливания плазмы необходимо применять раз в 2–3 недели [21]. У больных с приобретенной формой ТТП, у которых дефицит ADAMTS 13 в большинстве обусловлен не абсолютным отсутствием этого белка, а блокадой его активности вследствие циркуляции аутоантител, только переливания свежезамороженной плазмы может оказаться недостаточным, так как имеющиеся антитела будут блокировать и вновь поступающие в организм количества ADAMTS 13. Приобретенная ТТП является абсолютным показанием к проведению плазмафереза. Тем не менее, инфузия свежезамороженной плазмы у больных с приобретенной формой ТТП должна быть начата сразу же после появления подозрения ТТП при отсутствии возможности начать плазмаферез в экстренном порядке или до того, как будет уточнен диагноз [22].
На сегодня для лечения ГУС/ТТП, помимо терапии плазмой, применяется целый ряд методов и лекарственных препаратов, однако эффективность большинства их них остается недоказанной (табл. 2).
Недавно появившиеся новые данные о том, что тяжелые формы преэклампсии являются проявлением тромботической микроангиопатии, свидетельствуют, что плазмаферез и переливание свежезамороженной плазмы должны рассматриваться в качестве терапии выбора у таких больных. Применение глюкокортикоидов до и после родов способствует уменьшению тяжести HELLP-синдрома, потребности в гемотрансфузии и позволяет продлить беременность на 24–48 ч, что важно для профилактики респираторного дистресс-синдрома новорожденных [23]. Предполагается, что применение глюкокортикоидов может способствовать восстановлению функций эндотелия, блокаде аутоиммунных патогенетических механизмов, предотвращать внутрисосудистое разрушение эритроцитов и тромбоцитов и прогрессирование системного воспалительного ответа. В частности, рассматривая HELLP-синдром как вариант приобретенной тромботической микроангиопатии, эффективность глюкокортикоидов можно объяснить блокирующим эффектом в отношении антител к ADAMTS 13 и антифосфолипидных антител. Однако вслед за улучшением клинической картины, отмечаемым в течение 24–48 ч на фоне применения глюкокортикоидов, может возникнуть так называемый «ребаунд»-феномен, проявляющийся ухудшением состояния беременной. Таким образом, введение глюкокортикоидов не предотвращает полностью развитие патологического процесса, а лишь кратковременно улучшает клиническую картину, создавая условия для более успешного родоразрешения.
Важно отметить, что всем пациентам с ТТП, несмотря на выраженную тромбоцитопению, необходимо проведение тромбопрофилактики низкомолекулярным гепарином. Переливание тромбоцитов показано только у пациентов с жизнеугрожающими кровотечениями, так как это может спровоцировать прогрессирование тромботической микроангиопатии.
Заключение
Открытия последних лет, связанные с изучением молекулярных механизмов тромботический микроангиопатии, позволяют сделать вывод о том, что эта патология является гораздо более распространенной, чем было ранее принято считать. Важнейшим триггером к развитию как ТТП, так и других вариантов тромботической микроангиопатии является беременность. Причинами тому может быть физиологическое повышение уровней фактора фон Виллебранда, характерное для беременности, активное потребление и истощение запасов ADAMTS 13, что может усугублять ранее скрытый, умеренный генетически обусловленный дефицит этого фермента. Кроме того, последние данные указывают на взаимосвязь между циркуляцией антифосфолипидных антител и приобретенным дефицитом ADAMTS 13. Такие механизмы могут играть важную роль в патогенезе тяжелых плацентарных осложнений беременности, в том числе преэклампсии, HELLP-синдрома, преждевременной отслойки нормально расположенной плаценты, быть триггером в развития септического шока. В настоящее время критерии для установления диагноза тромботической микроангиопатии значительно расширены. Эту патологию следует исключать у всех пациентов, у которых выявляется тромбоцитопения в сочетании с гемолитической анемией. Своевременная диагностика тромботической микроангиопатии имеет колоссальное значение для выбора тактики лечения, в том числе может полностью изменить подход к терапии пациенток с тяжелыми формами преэклампсии и HELLP-синдромом.



