Эндометриоз – одна из наиболее острых проблем современной гинекологии после воспалительных процессов и миомы матки. Данных о частоте встречаемости узловой и диффузной форм аденомиоза, а также их сочетания в литературе сравнительно мало. По наблюдению ряда авторов диффузная форма встречается в 50–70% случаев среди всех больных аденомиозом, а узловая форма наблюдается у 3–8% больных [1, 2]. Многие авторы отождествляют узловую форму аденомиоза с аденомиомой [3].
Аденомиоз – одна из форм эндометриоидной болезни, для которой характерен прогрессивный инвазивный рост ткани эндометрия (желез и эндометриальной стромы) в толщу миометрия тела и перешейка матки, сопровождающийся гладкомышечной гиперплазией и гипертрофией. При этом установлены нарушения локального иммунитета [4]. Ряд зарубежных авторов считает разными заболеваниями узловую и диффузную формы аденомиоза [5].
Окончательный и точный диагноз аденомиоза устанавливается на основании гистологического заключения после удаления части матки или гистерэктомии, в связи с чем выявить распространенность заболевания в популяции представляется непростой задачей. Основными методами предоперационной диагностики аденомиоза являются ультразвуковое исследование (УЗИ) и магнитно-резонансная томография (МРТ), чувствительность которых достаточно высока и составляет 88–100% [6]. Несмотря на это, в целом выявляемость аденомиоза в дооперационном периоде составляет от 2,6 до 26,0% [7], что может быть связано с отсутствием систематического использования данных методов в предоперационном обследовании пациентов. В настоящее время для диагностики аденомиоза в основном используется эхография. Согласно проведенным исследованиям информативность УЗИ при выявлении узловой формы аденомиоза составляет 93,3% [8]. Также за последние годы в диагностике аденомиоза особую ценность приобрела МРТ [9]. Тем не менее, сравнительная оценка эффективности методов УЗИ и МРТ в диагностике узловой формы аденомиоза у пациенток репродуктивного возраста в плане предоперационной подготовки для определения границ узла аденомиоза с целью его последующей лапароскопической эксцизии, не проводилась.
На сегодняшний день многими авторами активно продолжают изучаться иммунологические и иммуногистохимические аспекты аденомиоза [10]. Основываясь на молекулярно-гистохимических данных, определены 2 типа очагов аденомиоза: активные и неактивные [2]. До конца не изученной остается роль маркера пролиферации Ki-67, антионкогена P-16 в патогенезе диффузной и узловой форм аденомиоза.
Таким образом, вопросы диагностики и иммуноморфологических особенностей аденомиоза требуют дальнейшего изучения.
Цель исследования: определить диагностические возможности УЗИ и МРТ при узловой и диффузной формах аденомиоза, а также изучить их пролиферативную активность.
Материал и методы исследования
На базе ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И.Кулакова Минздрава России нами было обследовано 150 женщин, прошедших лечение с диагнозом «аденомиоз». Все женщины были разделены на две группы: 1-ю группу больных составили 75 женщин с узловой формой аденомиоза (УАМ), 2-ю группу – 75 пациенток с диффузным аденомиозом (ДАМ). Возраст пациенток составил от 18 до 39 лет. Все больные были прооперированы. Диагноз диффузного и узлового аденомиоза верифицирован гистологически.
Для диагностики аденомиоза проводили УЗИ, МРТ, морфологическое и иммуногистохимическое исследование операционного материала.
УЗИ проводилось всем пациенткам трансвагинальным датчиком по стандартной методике на аппарате Toshiba Аplio XG модель SSA-790A с конвексным датчиком 5 МГц.
МРТ проводили на магнитно-резонансном томографе Magnetom Harmony фирмы Siemens (Германия), с напряженностью поля сверхпроводящего магнита 1Т, без контрастного усиления, при малом и среднем наполнении мочевого пузыря. Исследование заключалось в получении Т2-взвешенных изображений с помощью импульсной последовательности Turbo Spin-Echo (MAGETOM Symphony Application Guide Numaris 3,5 VA11E, 2001) c TR/TE=5000-7600/96-136 мсек в сагиттальной, аксиальной и коронарной проекциях.
Всем пациенткам было проведено оперативное лечение лапаротомическим или лапароскопическим доступом с предварительным взятием соскоба из полости матки. В 1-й группе производилось иссечение узлов аденомиоза с последующим послойным восстановлением стенки матки. Второй группе пациенток была произведена гистерэктомия без придатков. Объем и доступ оперативного лечения определялся индивидуально на основании данных анамнеза, общего и клинического обследования. В каждом случае бралось информированное согласие пациентки.
Морфологическое исследование узлов аденомиоза и аутопического эндометрия включало макроскопическое и микроскопическое исследования с окраской парафиновых срезов гематоксилином и эозином. Для иммуногистохимического анализа использовались моноклональные антитела к антигену Ki-67 фирмы DAKO в разведении 1:100, к антигену Р16INK моноклональные антитела фирмы DAKO в разведении 1:100 с предварительной термической демаскировкой антигенов в ретривере pH 6.0 и использованием стрептовидин-биотина и ДАБ. Результаты иммуногистохимической реакции оценивали в процентах: учитывалось количество окрашенных ядер на 100 клеток. Изучались следующие иммуногистохимические параметры: экспрессия Ki-67 и p16 в эпителии желез и в клетках стромы очагов аденомиоза и в аутопическом эндометрии. Результаты реакций оценивались по проценту окрашенных клеток одного типа. Ставились положительные и отрицательные контрольные реакции.
Статистический анализ полученных данных проводили с помощью стандартных методов математико-статистической обработки с использованием программного обеспечения MS Office Excel и Statistica 6.0 и непараметрической метода Манна–Уитни для малых выборок. Для всех критериев и тестов величина критического уровня значимости принималась равной 0,05, то есть различия признавались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
Возраст пациенток был от 18 до 39 лет (средний возраст 33,6±2,3 года) и достоверно по группам не отличался.
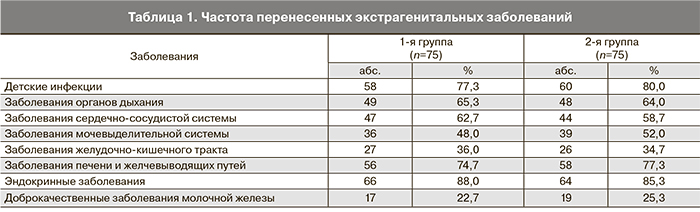
Отмечалась высокая частота инфекционных заболеваний у пациенток, прежде всего респираторных, что косвенно может свидетельствовать о снижении иммунитета. Детские инфекции ранее перенесли 58 (77,3%) пациенток 1-й группы и 60 пациенток (80%) 2-й группы. Данные о частоте перенесенных экстрагенитальных заболеваний отражены в табл. 1.
Как видно из табл. 1, у обследованных нами пациенток наблюдалась высокая частота экстрагенитальной патологии. Обращает на себя внимание высокая распространенность у пациенток с аденомиозом сердечно-сосудистых заболеваний. Кроме того, очень часто аденомиоз развивался на фоне эндокринной патологии. При этом, как видно из таблицы, частота заболеваний в 1-й и 2-й группах была одинаковой. Большинство авторов не относят эти состояния к факторам риска развития аденомиоза [11–13].
Согласно полученным данным, статистически значимых различий в группах УАМ и ДАМ ни по частоте, ни по структуре гинекологических заболеваний отмечено не было.
При анализе гинекологической заболеваемости пациенток с аденомиозом было отмечено, что у пациенток с УАМ и ДАМ с высокой частотой встречается гиперплазия эндометрия (у 51 женщины (68%) с УАМ и у 46 пациенток (61,4%) с ДАМ), воспалительные заболевания органов малого таза (у 59 женщин (78,7%) 1-й группы и у 61 женщины (81,3%) 2-й группы), а также эктопия шейки матки (у 61 (81,3%) и у 60 (80%) пациенток 1-й и 2-й групп соответственно). Полип цервикального канала встречался у 26 (34,7%) и у 31 (41,3%) пациентки, полип эндометрия – у 9 (12%) и 6 (8%) женщин в 1-й и 2-й группах соответственно.
При анализе перенесенных гинекологических операций отмечено, что пациенткам обеих групп наиболее часто выполнялись гистероскопия и раздельное диагностическое выскабливание полости матки и цервикального канала. Причем в анамнезе пациенток с ДАМ они имели место несколько чаще (у 65 (87%) по сравнению с 47 (62%) у пациенток с УАМ), однако разница не была статистически достоверной. Поводом для проведения раздельного диагностического выскабливания и гистероскопии чаще всего были маточные кровотечения, гиперплазия и полипы эндометрия. С одинаковой частотой в обеих группах женщинам была произведена миомэктомия (7 (9,3%) и 8 (10,7%) в 1-й и 2-й группах соответственно). Основными показаниями к миомэктомии были бесплодие и менометроррагии, приводящие к анемии. Лапароскопия по поводу доброкачественных новообразований яичников проводилась 21 (28%) и 17 (22,7%) пациенткам в 1-й и 2-й группах соответственно. Таким образом, значимых различий в частоте гинекологических и соматических заболеваний выявлено не было. На возможную этиологическую роль внутриматочных вмешательств в генезе аденомиоза указывают многие авторы [14].
По результатам УЗИ только у 52 (69,3%) пациенток в 1-й группе был установлен диагноз УАМ (рис. 1, рис. 2 см. на вклейке), в то время как у 12 (16%) больных узел аденомиоза был принят за миому матки.
В 11 (15%) случаях узловой процесс не был верифицирован при ультразвуковом исследовании.
У 9 (12%) женщин УАМ маскировался диффузными изменениями в миометрии, а у 2 (2,7%) миометрий был описан как структура без патологических изменений. Таким образом, у трети пациенток с УАМ диагноз не был подтвержден на дооперационном этапе. У 20 (26,7%) диагноз впоследствии был уточнен при МРТ, у 3 (4%) УАМ стал случайной находкой во время операции.
Величина аденомиозных узлов колебалась от 1,5 до 5,4 см (в среднем 3,15±1,2 см). В большинстве случаев узлы располагались межмышечно, однако у 5 пациенток (из 52 у которых диагноз был выставлен при УЗИ) их расположение было интерстициально-субсерозным, а у 7 женщин – субмукозным. Множественные аденомиотические узлы обнаружены в 1 наблюдении.
Переднезадний размер матки у этих больных в среднем был равен 5,6±1,1 см, а различие между толщиной передней и задней стенок в среднем составило 1,85±1,07 см. В 1-й группе по данным ультразвукового заключения узел аденомиоза имел ровные контуры у 60 пациенток (80%) и нечеткие – у 54 пациенток (72%). У 44 пациенток (58,7%) с УАМ обнаруживали повышение эхогенности возле переднего контура образования и понижение – возле дальнего. У 25 женщин (33,3%) в патологическом очаге выявляли близко расположенные друг к другу полосы, перпендикулярные плоскости сканирования средней и низкой эхогенности.
Во 2-й группе пациенток информативность УЗИ была значительно выше. Диагноз ДАМ удалось четко диагностировать при эхографии у 68 пациенток (90,7%).
Толщина матки у этой группы женщин, по данным эхографии, колебалась от 3,6 до 7,6 см, составляя в среднем 5,7±90,59 см (при норме 3,7±0,36), а различие между толщиной передней и задней стенки составляло 0,3±0,21 см (р<0,05 по сравнению с узловой формой).
Таким образом, УЗИ при ДАМ является более информативным, чем при УАМ, и позволяет правильно верифицировать патологическое состояние более чем в 90% случаев. Чувствительность ультразвукового сканирования в диагностике УАМ по нашим данным составила 69,3%, что превышает показатели, приведенные в литературе [15, 16].
МРТ проведена у 41 из 150 обследованных женщин (26 в 1-й группе и 15 во 2-й группе), каждой их которых предварительно было проведено трансвагинальное УЗИ. Основными показаниями к направлению на МРТ были: сложности в постановке диагноза после проведения полного комплекса традиционных исследований, включая данные УЗИ; невозможность оценить распространенность процесса и заинтересованность соседних органов; существенные расхождения клинической картины заболевания и данных УЗИ.

МРТ проводили во II фазе менструального цикла, при не полностью опорожненном мочевом пузыре и очищенной толстой кишке. В 1-й группе МРТ позволила точно установить диагноз, локализацию и распространенность процесса у 24 пациенток (92,3%), во 2-й группе – у всех 15 (рис. 3 см. на вклейке). Все диагнозы были верифицированы патогистологически после хирургического лечения.
В 1-й группе у 26 пациенток в ходе МРТ было показано, что узлы аденомиоза выглядят как зоны низкой интенсивности сигнала, слабо отделенные от прилегающего миометрия. МР-сигнал базального слоя эндометриоидной ткани на Т2-ВИ понижен, но в подавляющем большинстве случаев он все же более интенсивный и неоднородный, чем у миоматозных узлов, которые имеют более четкие ровные контуры и плотную гомогенную структуру. Основное отличие данной картины от миомы матки состояло в четком отграничении узлов миомы от прилежащего миометрия, однако в двух случаях в ходе МРТ был выставлен диагноз миома матки, а в ходе гистологического исследования эта патология была исключена.
В группе пациенток с ДАМ (n=15) при МРТ в большинстве случаев было выявлено увеличение матки и неоднородность структуры миометрия. В 14 (93%) случаях матка была увеличена в переднезаднем размере, приобретала округлую форму. В 1 (6,7%) случае существенного увеличения матки зафиксировано не было. Контуры матки у 13 (86,6%) пациенток были четкими, а полость определялась по средней линии, то есть толщина передней и задней стенок была одинаковой. В 2 (13,3%) случаях зафиксирована бугристость матки, что было следствием сочетания процесса с наружным генитальным эндометриозом. Структура миометрия во всех случаях была неоднородной и имела большое количество нечетко очерченных, гипоинтесивных мелких участков неправильной формы.
На Т2-взвешенных изображениях ДАМ во всех случаях характеризовался наличием гетерогенного утолщения зоны «соединения» между эндо- и миометрием, то есть зоны сигнала низкой интенсивности перемежались зонами высокой интенсивности. Толщина эндометрия была неравномерно увеличена более чем на 5 мм за счет базального слоя эндометрия и формирования небольших трубчатых структур, идущих от эндометрия в миометрий. МР-сигнал этих структур близок к МР-сигналу эндометрия (на Т2-ВИ он менее интенсивен, чем сигнал миометрия). В области базального слоя эндометрия у 13 (86,7%) пациенток определяли мелкие включения, чаще всего кистозного характера, но иногда и с геморрагическим компонентом.
Таким образом, использование предлагаемых МРТ-признаков позволяет с высокой достоверностью выявить аденомиоз и определить его форму.
При диффузной форме информативность МРТ была абсолютной, все диагнозы были подтверждены гистологически после оперативного вмешательства. Безусловно, высокая стоимость МРТ и организационные сложности, связанные с ее проведением, не позволяют рекомендовать этот метод в качестве скрининга при подозрении на аденомиоз. Однако при наличии сложностей в постановке диагноза после проведения полного комплекса исследований, включая УЗИ, а также при подозрении на вовлечение в патологический процесс соседних органов, необходимости уточнения топографии органов малого таза для определения тактики ведения пациенток и в случае существенных расхождений клинической картины заболевания и данных УЗИ, МРТ должна быть финальным решающим методом неинвазивной диагностики. Наши данные схожи с данными зарубежных авторов [17].
При гистологическом исследовании операционного материала было выявлено, что УАМ представлен очагами эндометриоза, окруженными гиперплазированной, гипертрофированной мышечной тканью, в то время как к этим очагам прилежит неизмененная мышечная ткань. Узел аденомиоза не имеет четкой капсулы. При гистологическом исследовании очаги аденомиоза определены как активные, неактивные, у ряда больных имелось сочетание как активных, так и неактивных очагов, то есть по степени активности имелись комбинированные формы. Активность очагов определялась по состоянию эпителиального компонента и цитогенности стромы (рис. 4, 5 см. на вклейке).
ДАМ характеризовался следующими изменениями в структуре миометрия: ткань неоднородная, с участками белесоватого цвета со спиралевидными плотными волокнами, перемежающимися пучками гладкомышечной ткани. Зоны аденомиоза представляли собой неоднородные уплотнения без капсулы и четких границ в виде инфильтратов и мелких кист. В толще миометрия выявляли небольшие полости с геморрагическим содержимым.
Иммуногистохимическое исследование гистологического материала было проведено 26 пациенткам 1-й группы и 22 пациенткам 2-й группы. В пробах изучали экспрессию p16 и маркера клеточной пролиферации – Ki-67.
По результатам иммуногистохимического исследования p16 экспрессировался в небольшом проценте клеток эпителия, стромы и прилежащего миометрия в обеих группах (табл. 2).
Ki-67 экспрессировался в ядрах клеток эпителия, стромы и гладко-мышечных клетках прилежащего миометрия. Отмечена его умеренная экспрессия в обеих группах (табл. 3).
По результатам исследования, уровень экспрессии антионкогена р16 был абсолютно одинаковым у пациенток 1-й и 2-й групп, также не различались и показатели экспрессии маркера пролиферации клеток KI-67. Таким образом, это позволяет предположить, что диффузная и узловая формы аденомиоза имеют одинаковую пролиферативную активность.
Заключение
Таким образом, пациенткам, планирующим сохранить репродуктивную функцию, с подозрением на наличие узловой формы аденомиоза в сочетании с другими патологическими процессами, МРТ целесообразно проводить после УЗИ, для уточнения локализации узла, четкого определения его границ. Главным преимуществом МРТ перед УЗИ, кроме четкой дифференциации различных тканей и сред, отсутствия ограничений при выборе области исследования и меньшей зависимости от субъективных факторов, является наглядность результатов этого метода, что существенно облегчает его восприятие гинекологами и очень важно при планировании оперативного вмешательства. Учитывая отсутствие изменений экспрессии маркера пролиферации Ki-67 и антионкогена Р-16, можно предположить, что диффузная и узловая формы аденомиоза имеют одинаковую пролиферативную активность. Необходимо дальнейшее изучение иммуногистохимических особенностей узловой и диффузной форм аденомиоза с целью определения оптимальной тактики лечения пациенток с этими формами заболевания.



