Арман Труссо (Armand Trousseau, 1801–1867) был первым, кто распознал связь между раком и тромботическими осложнениями [1]. Наряду с множеством открытых им симптомов в клинической гемостазиологии, его имя связывают с «феноменом Труссо» – тромбофлебитами («phlegmasia alba dolens») в связи со злокачественными новообразованиями. Он отмечал, что при раке кровь находится в особом состоянии, предрасполагающем к самопроизвольной коагуляции даже в отсутствии признаков воспаления. В его работе повторяющиеся тромботические эпизоды описаны как первые симптомы скрыто протекающего и не выявленного роста злокачественной опухоли, значительно опережающие клинические проявления новообразования, причем течение тромбофлебита в этих случаях имеет ряд особенностей – процесс склонен к мигрированию, протекает со слабо выраженной воспалительной реакцией, часты эмболии [2–5]. По иронии судьбы, обнаружив у себя тромбофлебит левой ноги в 1867 году, он предопределил прогноз своего заболевания.
Паранеопластический синдром – клинико-лабораторное проявление злокачественной опухоли, обусловленное не ее локальным или метастатическим ростом, а неспецифическими реакциями со стороны различных органов и систем или эктопической продукцией опухолью биологически активных веществ.
Выросший в последние 20 лет интерес онкогинекологов к взаимосвязи между тромбозом и раком имеет два направления:
- взаимосвязь тромботических осложнений с процессом лечения злокачественных новообразований женских половых органов и молочных желез, в особенности с часто применяющейся гормональной терапией, наряду с хирургическим лечением и химиотерапией, а также при применении антиангиогенных препаратов, специфической особенностью которых является сосудистая токсичность и стимуляция тем самым тромбообразования [6];
- наблюдение за случаями идиопатического или неспровоцированного венозного тромбоэмболизма (ВТЭ), особенно сосудов нижних конечностей или венозного сплетения органов малого таза, как предвестниками клинического проявления скрытого онкологического процесса.
Взаимосвязь между тромбозом и раком женских половых органов и молочных желез подтверждается рядом клинических признаков:
- идиопатический (первичный) ВТЭ верхних и нижних конечностей зачастую служит ранним прогностическим фактором скрытого рака;
- в процессе развития злокачественных новообразований органов малого таза и молочных желез увеличен риск симптоматического и рецидивирующего ВТЭ.
Клинически ВТЭ и рак имеют два основных проявления: с одной стороны тромбоз может быть единственным клиническим симптомом скрыто протекающего рака, с другой – у пациентов с выявленным раком на всех стадиях заболевания может развиться тромбоз [3, 7, 8]. В клинической онкологии тромботические осложнения относятся к наиболее часто встречающимся паранеопластическим синдромам и проявляются артериальными и венозными тромбозами, мигрирующим тромбофлебитом, эмболией легочной артерии, небактериальным тромбоэндокардитом, тромботической микроангиопатией.
Синдром Труссо – клинические проявления и современные диагностические возможности
Многие заболевания могут усугублять течение опухолевого процесса и дополнительно стимулировать систему гемостаза, что может приводить к тромбоэмболическим состояниям или коагулопатии потребления. К основным заболеваниям, в значительной степени ухудшающим прогноз течения злокачественного процесса женских половых органов и молочных желез и повышающим риск развития тромбогеморрагических осложнений относят:
- Сердечно-сосудистые заболевания, что особенно актуально в перименопаузальном периоде и/или на фоне применения гормональной терапии: ишемическая болезнь сердца, гипертоническая болезнь, атеросклероз, варикозная болезнь вен нижних конечностей.
- Антифосфолипидный синдром (АФС) и генетические формы тромбофилии, манифестация которых зачастую приходится на период беременности, но в большинстве случаев остается нераспознанной, если не проявляется как ВТЭ.
- Патология сосудов: системные заболевания, поражающие преимущественно сосудистое русло – сахарный диабет (в том числе и гестационный).
- Системные заболевания соединительной ткани.
- Болезни печени и почек.
- Эндокринные заболевания.
Тромбозы обладают склонностью к затяжному течению, вероятно, из-за постоянного присутствия факторов риска тромбоза, которые по большей степени обусловлены наличием опухолевых масс. Характерно рецидивирующее течение тромбозов, в этом случае следует предположить наличие генетических форм тромбофилиии и АФС. В послеоперационном периоде следует опасаться тромбозов в связи с высокой частотой возникновения эмболии.
Часто тромбоз глубоких вен развивается в илеофеморальном сегменте, тогда как тромбозы глубоких вен голени реже, чем в половине случаев. Подобная закономерность связана с увеличением венозного давления в венах таза, снижением тонуса венозных стенок вследствие изменения гормонального фона, развитием стаза, зачастую компрессией опухолевыми массами в области малого таза. При новообразованиях молочной железы также характерно наличие тромбоза вен плечевого сплетения, что также связано с локальными изменениями гемодинамики вследствие регионарного воздействия опухоли.
Тромбоз вен илеофеморального сегмента проявляется болями внизу живота, перитонеальными симптомами, небольшим подъемом температуры и лейкоцитозом. Такая клиническая картина нередко является предметом диагностических ошибок. Наиболее часто дифференциальной диагноз приходится проводить с острым аппендицитом, почечной коликой, острым сальпингоофоритом, апоплексией яичника. Очень важна в данном случае настороженность врача в отношении возможности развития тромбоза [9, 10].
На основании литературных данных затруднительно сделать вывод, какие именно виды опухолей обладают наибольшим тромботическим потенциалом. Эта неопределенность, вероятно, вызвана несколькими факторами [11, 12]:
- В эпидемиологических исследованиях по заболеваемости ВТЭ у онкогинекологических больных практически невозможно отделить патофизиологические факторы, непосредственно связанные с действием опухоли от тех, которые связаны с сопутствующими заболеваниями или явились результатом лечения основного заболевания.
- Несмотря на то, что степень распространения опухоли является важным фактором, определяющим тромботический риск, во многих эпидемиологических исследованиях не делается различия между пациентами с локализованными, местно-распространенными или метастатическими формами. Например, пациенты с локализованным раком тела матки, имеют довольно низкий риск ВТЭ, в то время как метастатический рак, по существу, обладает существенно более высоким риском тромбоза и, вероятнее всего, коагулопатии в рамках диссеминированного внутрисосудистого свертывания (ДВС) [6, 13, 14].
- Результаты эпидемиологических исследований могут отличаться в связи с включением/исключением венозных и артериальных тромботических осложнений, обнаруженных клинических симптомов, методов визуализации тромбоэмболии или описания результатов аутопсии.
- Усовершенствование методов лечения злокачественных новообразований в некоторых случаях приводило к ятрогенным побочным тромботическим осложнениям, например при применении бевацизумаба или иммуномодуляторов, таких как талидомид или леналидомид, что было обнаружено относительно недавно.
- Также разнообразие гистологических и цитологических форм новообразований, имеющих еще и различия на генетическом и молекулярном уровне, обусловливает различные особенности патогенеза тромботических осложнений. Это в особенности характерно при изучении вопросов, связанных с раком яичников, гистологическая классификация которого очень разнообразна. Кроме того, на основании генетических и молекулярных анализов были выявлены дополнительные подтипы немелкоклеточного рака легких на основании наличия конкретных молекулярных мишеней, в том числе мутаций в гене рецептора эпидермального фактора роста (EGFR) и транслокации с участием гена киназы анапластической лимфомы (ALK). Эти уточненные данные могут быть важны для понимания патогенеза синдрома, особенно в свете показанных в эксперименте различных путях активации или инактивации мутаций в онкогенах (например, K-RAS, EGFR, PML/RAR-альфа, MET) и гены-супрессоры опухолей (например, p53, PTEN), что соответственно, непосредственно влияет на прокоагулянтную активность раковых клеток.
В цепочке патогенеза опухолевого роста выявлено значительное количество звеньев, более того, по мере роста опухоли, каскад развития тромбофилии приобретает лавинообразное течение, то есть тромботический процесс развивается по принципу обратной положительной связи, что в конечном итоге неизбежно приводит к развитию ДВС-синдрома и истощению факторов свертывания.
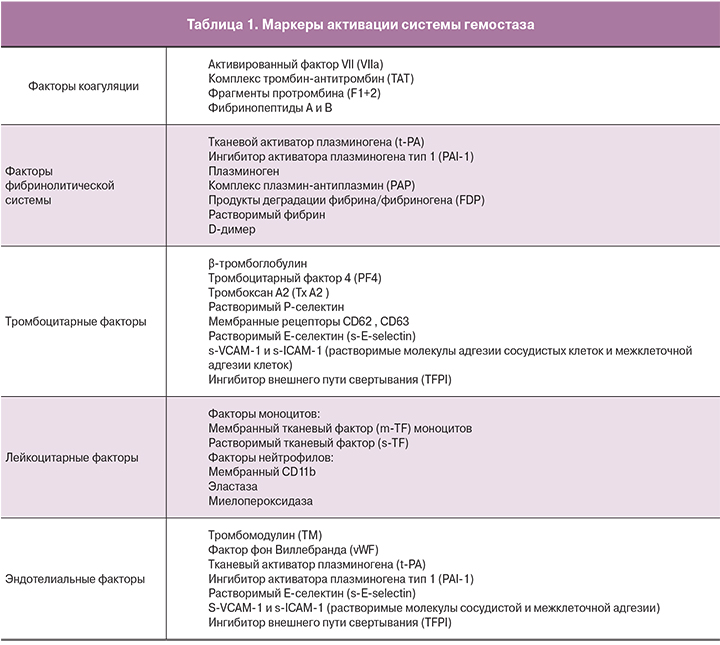
Для выявления тромботического потенциала наибольшее диагностическое значение имеют такие показатели состояния свертывающей системы как ТАТ, F1+2, РАР, FDP, D-димер, PF4, растворимые селектины (табл. 1)
При наличии злокачественного новообразования повышается риск развития тромбозов атипичной локализации: вен головного мозга, тромбоз яичниковых вен (особенно при раке тела матки и яичников), тромбоз печеночных вен (синдром Бадда–Киари), подключичных и яремных вен при раке молочных желез. Такие тромбозы являются очень серьезной патологией, которая часто остается не распознанной, и диагностируются только на аутопсии. Симптомы этих угрожающих состояний в большинстве своем неспецифичны.
Ключевую роль в патогенезе тромбозов редкой локализации играют наследственные тромбофилии в сочетании с основным заболеванием. Например, тромбозы редких локализаций развиваются у 25% пациентов с дефицитом антитромбина III.
При наличии наследственных тромбофилий риск тромбоза мезентериальных вен у пациентов с новообразованиями органов малого таза повышается в 100 раз. Так, в общей популяции тромбоз данной локализации является крайне редкой патологией (0,01% по данным аутопсий у пациентов хирургического стационара), тогда как у пациентов с дефицитом антитромбина III мезентериальный тромбоз развивается в 10% случаев, при дефиците протеина С – в 6%, а при дефиците протеина S – в 4% случаев.

Наследственные и приобретенные тромбофилии играют важную роль и патогенезе тромбоза вен сетчатки. АФС выявляется до 50% случаев у пациентов с тромбозом данной локализации. При наличии мутации FV Leiden риск тромбоза сетчатки повышается в 6 раз, а при наличии мутации протромбина G20210A – в 8 раз [15].
Открытие и детальное изучение тромбофилитических состояний, а также все более широкое применение компъютерной и магнитно-резонансной томографии позволяет на сегодняшний день проводить своевременную диагностику тромботических осложнений редкой локализации.
Патогенез синдрома Труссо и триады Вирхова
На момент своих публикаций Арман Труссо лишь предположил наличие связи между опухолевым процессом и тромбозами, не имея никаких возможностей проследить патогенез такой связи.
Спустя 150 лет нам доступно почти полное понимание патогенеза синдрома Труссо, в основе которого лежит активация как коагуляционного, так и сосудисто-тромбоцитарного звеньев системы свертывания крови, что обеспечивается:
- нарушением структурной целостности и функциональной стабильности сосудистого эндотелия опухолевыми клетками и цитокинами;
- активацией тромбоцитов опухолевыми клетками, приводящей к их повышенной адгезии и агрегации;
- синтезом прокоагулянтов и ингибиторов фибринолиза опухолевыми клетками;
- прокоагулянтной активностью опухоль-ассоциированных макрофагов и активированных моноцитов периферической крови [16, 17].
В процессе опухолевой прогрессии маскировка злокачественно трансформированных клеток от эффекторов иммунной системы в числе прочего обеспечивается наличием барьера из фибрина. Фибриновые волокна всегда присутствуют в любой опухолевой ткани, что особенно характерно для зоны активной пролиферации малигнизированных клеток. В зоне опухоли мощный фибриновый барьер образуется за счет извращения процессов перманентной стимуляции фибриногенеза и сопутствующего фибринолиза. Со стороны опухолевых клеток инициирующее воздействие на компоненты системы гемостаза и процесс образования фибрина опосредуется присутствующими в зоне опухоли макрофагами, реакция которых на малигнизированные клетки выражается усилением продукции провоспалительных цитокинов – фактора некроза опухоли (TNFα), интерлейкинов (IL)-1, IL-6, IL-8 и других активных молекул. На поверхности клеток эндотелия и активированных макрофагов провоспалительные цитокины индуцируют экспрессию тканевого фактора свертывания крови [18, 19].
В очаге опухолевого роста защитная роль фибрина искажается, и трансформированные клетки используют фибриновую сетку как механический барьер от клеток иммунной системы. Фибрин также повышает устойчивость малигнизированных клеток к химиотерапии.
Еще одна функция фибрина – обеспечение возможностей роста опухолевой массы. Нити фибрина формируют тракт перемещения злокачественно трансформированных клеток в структуре ткани и одновременно выступают в качестве защитного барьера от цитотоксических клеток иммунной системы (табл. 2).
Фибрин является для раковых клеток и основным трофическим материалом. Раковые клетки потребляют фибрин в 10 раз более активно, чем другие белки. В структуре опухолевой ткани фибрин выполняет, кроме того, функцию внеклеточного матрикса. Нити фибрина оказывают стимулирующее действие на фибробласты, присутствие которых в опухоли необходимо для поддержания концентрации потребляемых раковыми клетками ростовых факторов и секреции компонентов, входящих в строму опухолевой ткани. Злокачественно трансформированные клетки используют фибрин в своих целях благодаря их способности определенным образом контролировать активность фибринолитической компоненты гемостаза – системы плазмин – тканевые ингибиторы – активаторы плазминогена [20, 21].
Патогенез синдрома Труссо включает в себя также все аспекты триады, описанной Вирховым: сосудистый стаз, повреждение сосудистой стенки, увеличение свертывающего потенциала крови (рис. 1). Венозный застой является типичным компонентом патогенеза, особенно у длительно иммобилизованных больных или больных с инфекционными осложнениями в процессе их лечения, а также при проведении хирургического лечения. Кровоток может быть нарушен частично или полностью из-за компрессии опухолевыми массами в области малого таза или непосредственной инвазии опухоли в стенку сосуда, а также стать результатом постановки венозного катетера [22, 23].
Кроме того, для злокачественных опухолей характерна инвазия в васкуляризированные ткани пораженного органа раковыми клетками и образование новых кровеносных сосудов, то есть опухолевый неоангиогенез. При этом прокоагулянтные свойства раковых клеток реализуются посредством утечки факторов свертывания из плазмы в интерстициальное пространство микросреды опухоли, секрецией цитокинов, хемокинов и специфических опухолевых муцинов, а также прямой инвазией раковых клеток в кровеносные или лимфатические сосуды.
Повреждение стенки сосуда может быть обусловлено и циркулирующими воспалительными цитокинами, которые экспрессирует опухолевая ткань, такими как TNF-α или IL-1β и прямого действия цитотоксических лекарственных средств в результате эндотелиального повреждения. Например, при применении цисплатина у больных раком яичников было показано, что происходит индукция апоптоза эндотелиальных клеток in vitro, в том числе за счет фрагментации мембраны, при этом микрочастицы обладают выраженной прокоагулянтной активностью, и увеличивает риск как венозных, так и артериальных тромбозов in vivo.

Состояние гиперкоагуляции при раке обусловлено комплексом взаимодействий опухолевых клеток и их продуктов с клетками организма. Опухолевые клетки могут напрямую активировать коагуляционный каскад, что ведет к тромбозам или проявлять прокоагулянтные свойства, или ингибировать антикоагулянтную систему эндотелия, тромбоцитов, моноцитов, макрофагов. Опухолевые массы вызывают по меньшей мере локальный стаз, обусловленный инвазией опухоли в кровеносные сосуды, механическим сдавлением массой опухоли [24–26].
Раковая клетка может инициировать коагуляцию и непосредственно через взаимодействие с тромбоцитами и/или системами коагуляции и фибринолиза, чтобы генерировать тромбин или косвенно, стимулируя мононуклеарные клетки, что ведет к синтезу различных прокоагулянтов. Запуск свертывания может рассматриваться как особый тип воспалительной реакции на стимулы типа повреждения стенки сосуда, или внутрисосудистой агрегации раковых клеток или поступление клеток опухоли в кровоток. Увеличение прокоагулянтной активности, присутствие всех компонентов системы коагуляции локально в области расположения опухоли и уменьшенная деятельность противосвертывающей системы ведет к гиперкоагуляции, как результату злокачественного развития.
Генерация тромбина и формирование фибрина постоянно обнаруживается у онкологических пациентов, эти процессы приводят к увеличению риска тромбоэмболических осложнений. Более важно, что формирование фибрина вовлечено в процессы роста опухоли и метастазирования. Активация свертывания крови при раке – сложный феномен, включающий множество компонентов системы коагуляции и многочисленные взаимодействия между опухолевыми клетками и клетками крови, включая тромбоциты, моноциты, эндотелиальные клетки.
В норме система гемостаза всегда находится в динамическом равновесии: при этом всегда ингибирующие влияния преобладают над активирующими, и лишь при повреждении высвобождаются из клеток крови и поврежденного эндотелия, а также экспонируются субдэндотелиальные активирующие факторы. Однако следует отметить, что при наличии исходного активирующего агента ответ развивается крайне быстро и с гораздо большей интенсивностью, резервы активирующей системы намного превосходят резервы репаративной. Это ведет к локальной гиперкоагуляции и гиперагрегации, что способствует образованию клеточного микротромба, а затем образования внутри и вокруг него фибринового матрикса. Все эти изменения направлены на как можно скорейшее ограничение очага поражения, а затем создание условий для скорейшего восстановления нормального состояния. При развитии патологического процесса равновесие смещается либо с сторону гипокоагуляции и преобладания фибринолиза, либо в сторону гиперкоагуляции и образование фибриновой сети. В этих условиях ДВС-синдром развивается при наличии системного повреждающего фактора, когда повреждение не только не локализовано, но и продолжительно по времени [21, 27].
Злокачественные новообразования, безусловно, являются одним из таких системных факторов. Агенты, высвобождаемые из раковых клеток, действуют не только в месте первичного очага злокачественного роста, но и в местах гематогенного проникновения раковых клеток через эндотелиальный барьер в составе микротромбоэмболов (рис. 2).
Заключение
Таким образом, спустя более 150 лет с того момента, как Арман Труссо описал свой синдром и предположил наличие связи между злокачественными новообразованиями и тромбозами, в настоящее время не вызывает сомнения наличие такой патофизиологической и клинической взаимосвязи. Последние имеют чрезвычайно сложный характер, у больных злокачественными новообразованиями имеется риск развития как геморрагических, так и тромботических осложнений. Но все же наиболее актуальной проблемой современной онкологии является профилактика тромбозов у больных раком. Кроме того, в ходе экспериментальных исследований доказано, что влияние на систему гемостаза может привести к изменениям степени и скорости роста опухоли и образования метастазов. Клиническим отображением данного факта является то, что применение антикоагулянтов (преимущественно низкомолекулярных гепаринов) у больных злокачественными новообразованиями ранних стадий позволит существенно улучшить результаты их лечения.
Как заявил Аджит Варки в своем обзоре, есть несколько определений и несколько механизмов синдрома Труссо, поскольку не существует какого-либо одного универсального пути, по которому развивается множество паранеопластических аномалий свертывания. Тем не менее, огромный прогресс был достигнут в разграничении некоторых клеточных и молекулярных механизмов, лежащих в основе злокачественного роста связанного с микро- и макрососудистым тромбозом, многие из которых уже имеют варианты патогенетического лечения [5].
В связи с этим стандартизация методов диагностики, глубокое понимание патогенеза тромботических осложнений, взаимосвязь процессов активации свертывающей системы и опухолевого роста и метастазирования является ключом к профилактике или, по крайней мере, ранней диагностике синдрома Труссо и скрытого онкологического процесса.



