Лечение оппортунистической инфекции является непростой задачей, что обусловлено отсутствием адекватной иммунной защиты у таких больных. Более того, пока отсутствуют терапевтические
средства, направленные на полную элиминацию вирусов или облигатных микроорганизмов, существующих в человеческом организме в форме симбиоза. При этом следует отметить, что в большинстве случаев организм иммунокомпетентного хозяина самостоятельно элиминирует вирусы папилломы человека (ВПЧ) или переводит в латентную стадию вирусы простого герпеса (ВПГ). Возможности целенаправленного взаимодействия иерархически организованных компонентов иммунной системы, которая у здоровых индивидов контролирует ситуацию при внедрении микроорганизмов, зависит от природы инфекционного агента и компетентности иммунной системы. Так, по мнению Р.М. Хаитова и Б.В. Пинегина [18], «главной мишенью иммуномодулирующих препаратов являются вторичные иммунодефициты, которые проявляются в виде часто рецидивирующих, трудно поддающихся лечению инфекционно-воспалительных заболеваний различных локализаций. В основе любого хронического инфекционно-воспалительного процесса лежат те или иные изменения в иммунной системе, которые и являются одной из причин существования этого процесса».
В связи с отсутствием методов элиминации ВПЧ традиционные методы (ТМ) лечения направлены
на устранение таких клинических признаков ВПЧ, как генитальные кондиломы, или деструкцию доброкачественных и предраковых новообразований, инициированных ВПЧ. Для этой цели применяют
крио, электро- и лазерную хирургию, а также обработку цитотоксическими химическими веществами, вызывающими цитолиз и некроз ткани. Эффективность ТМ лечения зависит от возможности полного устранения аногенитальных бородавок и инфицированных клеток и соответственно составляет около 60% [2, 30, 38]. «Золотым стандартом» в лечении клинической манифестации ВПЧ было бы применение лечебных вакцин [34], механизм действия которых основан на блокировании вирусных генов или протеинов, необходимых для инфицирования, персистенции и размножения вирионов ВПЧ в эпителиальных клетках, при этом активировалась бы клеточная иммунная реакция, которая элиминировала бы инфицированные клетки эпителия. Этот путь лечения ВПЧ обнадеживающий, но пока все еще идет разработка таких терапевтических вакцин. Использование этого механизма элиминации вирусов возможно на данном этапе с помощью иммуномодуляции.
Практический аспект проблемы связан с присутствием на отечественном лекарственном рынке множества иммуномодуляторов, порой сомнительного происхождения, с непонятными свойствами, а данные литературы, свидетельствующие об их эффективности и надежности, немногочисленны [12].
Несмотря на огромный информационный поток, практическим врачам трудно найти необходимый
источник литературы для формирования собственного мнения относительно эффективности того или
иного препарата. В русскоязычной медицинской литературе только начинается публикация информации по Кохрановскому стилю в виде систематических обзоров и метаанализов, а доступ к большинству этих источников ограничен. Исходя из этого, целью данного систематического обзора с элементами метаанализа явились обобщение и сравнительная оценка результатов применения инозина пранобекса (ИП) при ВПЧ-ассоциированных заболеваниях слизистых оболочек и кожи с точки зрения доказательной медицины.
Материал и методы иследованияŠ „ ‰
Систематический обзор выполнен на основе 19 источников. Из них 14 работ посвящены применению аналогов ИП (гроприносин и изопринозин) при различных вирусных и инфекционных заболеваниях слизистой оболочки и кожи, включая аногенитальные бородавки, при субклинической и клинической манифестации ВПЧ-инфекции на шейке матки в виде цервикальной интраэпителиальной неоплазии [1, 4‒7, 9, 13, 14, 16, 21, 23, 27, 31, 35]. Остальные 5 работ посвящены различным заболеваниям кожи и слизистых оболочек, таким как множественные бородавки кожи у детей [8]; инфекционно-воспалительная вульводиния [15]; хронический рецидивирующий атопический дерматит, осложненный вирусной инфекцией [17]; рецидивирующий папилломатоз гортани [24]; ВПЧ-позитивная пролиферативно-бородавчатая лейкоплакия слизистой полости рта [25].
Анализ свидетельствует, что при различных вирусных и инфекционных заболеваниях слизистой оболочки и кожи, в том числе ВПЧ-ассоциированной патологии, ИП назначали в основном по 3 г в день или из расчета 50 мг на 1 кг массы тела ежедневно в течение от 5 до 84 дней (12 нед). ИП применяли как самостоятельное лечение в монорежиме или как вспомогательную терапию (комбинированный режим) на фоне основного лечения с помощью традиционных методов деструкции ВПЧ-ассоциированной патологии (табл. 1).
Таблица 1. Суточная доза и режим применения ИП при различных вирусных и инфекционных заболеваниях слизистой оболочки и кожи.
Вначале проанализированы результаты лечения 5367 больных из 19 источников литературы.
При этом 5033 больным назначали ИП, из них 1625 пациенток принимали ИП в монорежиме,
а 3408 больных – в комбинированном. Плацебо-лечение назначалось 61 больному, а ТМ – 273 пациентам (табл. 2).
Таблица 2. Степень эффективности применения ИП при ВПЧ-ассоциированных патологических поражениях кожи и слизистых оболочек но сравнению с плацебо контролем и традиционными
методами лечения.
На втором этапе данные программы Астра были исключены из анализа и представлены только конечные результаты оставшихся работ, свидетельствующих о наличии или отсутствии лечебного эффекта. Больные, потерянные из-под наблюдения в ходе работы, были исключены из анализа.
При этом для плацебо-группы проанализировали результаты 3 работ (n=61), для ТМ – 9 (n=273), для
ИП в монорежиме – 11 (n=253) и для ИП в комбинированном режиме – 14 (n=459).
На третьем этапе проанализировали частоту и тяжесть побочных эффектов ИП.
Статистическая обработка выполнена с помощью однофакторного дисперсионного анализа
(One way ANOVA) и теста Тьюки (Tukey) для множественного сравнения средних величин. †‹
‰ ŒРезультаты исследования и обсуждение
Результаты первого этапа анализа индивидуальных источников свидетельствуют о повышении
эффективности лечения после применения ИП в большинстве проанализированных нами работ,
несмотря на разнообразие дизайна исследования и характера манифестации вирусных инфекций
(см. табл. 2).
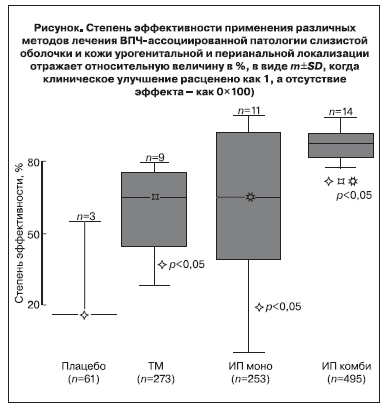
Согласно обобщенному анализу средних величин на втором этапе степень эффективности плацебоконтроля составляет 29,3% с нижними и верхними 95% доверительными интервалами (ДИ) от -27,0 до 85,6, а ТМ лечения – 59,9% (ДИ – 45,8–74,0) (см. рисунок).
Эффективность ИП в большинстве работах оценивалась в зависимости от режима его применения.
При этом в 64,9% случаев (ДИ – 43,5–86,4) отмечено клинико-лабораторное улучшение после применения ИП в монорежиме, что заметно контрастирует с высокими результатами комбинированного
применения ИП – 87,4% (ДИ -83,7–91,1). Степень отсутствия эффекта и рецидив заболевания отражает зеркальную противоположность показателей клинического улучшения с аналогичными вариациями между сравниваемыми группами. Данный показатель выражает отсутствие эффекта и/или
развитие рецидивов кондилом в «очищенных» участках, а не появление новых кондилом на соседних участках. Объединение таких параметров явилось результатом того, что в большинстве источников эти параметры отдельно не рассматривались, регистрировались как рецидив и только в нескольких источниках представлялись как отдельные параметры. При этом показатели эффективности/отсутствия эффекта плацебо-контроля существенно отличались от показателей как ТМ и применения ИП в монорежиме (p<0,05), так и комбинированного режима применения ИП (p<0,05). В свою очередь показатели эффективности/неуспеха ТМ лечения и применения ИП в монорежиме широко варьировали и оказались равнозначными (p>0,05). Наконец, показатель эффективности применения ИП в комбинированном режиме был существенно выше аналогичных результатов как ТМ (p<0,05), так и использования ИП в монорежиме (p<0,05).
Анализ результатов применения ИП на третьем этапе показал, что в 8 источниках побочные эффекты не были отмечены [8, 14, 17, 21, 24, 25, 31], в 5 работах вообще нет упоминаний об этом параметре [1, 4, 13,15, 16]. Наконец, в 7 источниках авторы детально описали побочные эффекты [5—7, 9, 23, 27, 35]. Данные свидетельствуют о появлении некоторых жалоб, касающихся раздражения органов желудочно-кишечного тракта, кожных симптомов в виде сыпи и сухости, недомогания, а также повышении концентрации трансаминаз печени и мочевой кислоты. В большинстве случаев эти симптомы были незначительными, проходили самостоятельно и лечение не отменялось.
Необходимость публикации работ, основанных на принципах доказательной медицины, а также
возможность проведения клинического испытания лекарственных средств в соответствии с международными стандартами для поиска оптимальных путей решения этой проблемы рассмотрены на специальной секции 10-го Всероссийского форума «Мать и дитя». В свете этих задач, стоящих перед российской медицинской наукой и практикой, публикация систематических обзоров и метаанализов приобретает особое значение.
Как известно, естественный и адаптивный иммунитет, осуществляемый с помощью клеток, является важным для элиминации ВПЧ из организма. При длительной персистенции кондилом под воздействием иммуносупрессивного эффекта ВПЧ-инфекции происходит подавление клеточного звена иммунной системы с дефицитом способности антигенпрезентирующих клеток и регуляторных Т-клеток, а также
уменьшение популяции клеток и макрофагального ряда. При этом регрессия кондилом ассоциировалась с выработкой В-клетками IgG-антител, поэтому считалось, что для успешной борьбы с ВПЧ необходимо стимулировать клеточное звено локальной иммунной системы. Исходя из того, что инозин усиливает митогенный ответ лимфоцитов, начали применять препараты, содержащие инозин в качестве активного ингредиента, чтобы стимулировать иммунную защиту на клеточном уровне.
В середине 80-х годов прошлого века в журнале «Ланцет» был опубликовал ряд статей, посвященных
применению препарата ИП при генитальных кондиломах и герпесе, что способствовало повышенному
интересу клиницистов и ученых к этому препарату, который еще в 1969 г. был запатентован в США.
Далее ИП был лицензирован во многих странах как метод лечения иммунодефицита, обусловленного недостаточностью клеточного звена иммунной системы. В 1982 г. препарат отмечен международной премией «Приз Галена», а к 1990 г. зарегистрирован более чем в 70 странах мира. По данным «Newport Pharmaceuticals», опубликованы результаты более 1750 клинических исследований. С момента использования препарата в клинической практике таблеточный эквивалент потребления ИП составил около 1,25 млрд таблеток, которые назначались более чем 20 млн пациентов в среднем по 3 г в день в течение 10 дней. При этом зарегистрировано всего 1500 случаев развития побочных эффектов, преимущественно в виде кратковременного транзиторного повышения концентрации мочевой кислоты, как в плазме, так и в моче. Тяжелые побочные эффекты или осложнения лечения, связанные с примене нием ИП, не зарегистрированы, что свидетельствует о безопасности данного препарата [32].
Выбор метода лечения при ВПЧ-ассоциированной патологии слизистых оболочек и кожи урогенитальной и перианальной локализации зависит от ряда факторов, включая морфологию, размеры, количество и локализацию кондилом, возраст больных и наличие беременности. В этом процессе немаловажную роль также играет собственный опыт врача и метод лечения, который он предпочитает. Основной целью терапии является элиминация кондилом, которые вызывают симптомы, сопряженные с физическим и психологическим дискомфортом. Тяжесть клинической манифестации ВПЧ-ассоциированной патологии слизистых оболочек и кожи урогенитальной и перианальной локали-
зации широко варьирует, что требует тщательного выбора и обоснования целесообразности использования того или иного метода в каждом конкретном случае.
Доказательства исключительного преимущества какого-либо определенного метода перед остальными отсутствуют. Лечебное средство нужно выбирать индивидуально, исходя из того принципа, что лечебное воздействие не должно сопровождаться осложнениями, вызывающими более тяжелые страдания по сравнению с основной болезнью. При этом следует также учитывать выбор пациенток, исходя из стоимости и комфортности того или иного метода лечения для конкретного больного. Однако в большинстве случаев врачи выбирают тактику лечения согласно рекомендациям различных экспертов, профессиональных сообществ и организаций. Следует отметить, все еще недостаточно работ, основанных на принципах доказательной медицины, свидетельствующих об эффективности какого-либо метода в отношении элиминации ВПЧ и регрессии ВПЧ-ассоциированных поражений, поэтому пациентки должны быть информированы об отсутствии в настоящее время патогенетически обоснованного метода лечения ВПЧ-инфекции [20, 26, 36, 37, 38].
Согласно данным литературы, практически на всех этапах развития ВПЧ- ассоциированной патологии
тактика лечения основана на выборе врача и пациентки. Для выбора тактики ведения необходимо
уточнить количество, размеры и точную локализацию кондилом. Лечение гигантских или множественных кондилом состоит из первичной хирургической эксцизии или удаления кондилом. При этом если консервативное лечение гигантской или множественной кондиломы оказалось успешным с элиминацией более 50% объема кондиломы, то считается предпочтительным продолжение консервативной терапии с этим же препаратом до окончания полного курса. Если уменьшение составляет менее 50% объема, то рекомендуется абляция или эксцизия кондилом. Считается, что химическая деструкция тканей является более эффективной во влажных, мягких и некератинизированных бородавках и кондиломах, а физическая деструкция – в кератинизированных
папилломах [26, 30, 37, 38].
Хирургическое лечение кондилом шейки матки рекомендуется проводить после предварительной
кольпоскопической оценки и исключения тяжелой формы дисплазии (цервикальная интраэпителиальная неоплазия – CIN III степени) и рака шейки матки in situ. Для деструкции кондилом влагалища и прямой кишки рекомендуют применять криохирургию или трихлоруксусную кислоту, уретральных кондилом – криотерапию или подофиллин. Однако подофиллин не рекомендуется при кондиломах, локализованных на внутренних поверхностях урогенитальной и перианальной области.
Ситуация, когда невозможно увидеть кондиломы невооруженным глазом, но манифестация ВПЧ-инфекции в виде мелких папиллом или цервикальной интраэпителиальной неоплазии может быть установлена с помощью ацетоуксусной пробы, кольпоскопии, биопсии и других инструментальных методов, считается субклинической формой, а только при положительных результатах лабораторных анализов (ДНК-тест методом ПЦР или метод гибридного захвата – Digene-тест) – латентной формой. По поводу тактики ведения таких больных имеется много различных противоположных мнений. Так,
по рекомендациям центров контроля болезней (CDC), даже не рекомендуется применять ацетоуксусную пробу, кольпоскопию и другие методы для скрининга субклинической формы ВПЧ в общей популяции или у больных с уже установленным диагнозом ВПЧ-инфекции [20]. Долгосрочный скрининг и мониторинг являются основой тактики ведения таких пациенток. При этом рекомендуется проведение разъяснительной беседы с такими больными о важности и необходимости скрининга путем периодического взятия цитологических мазков из цервикального канала шейки матки.
ВПЧ имеет специальные механизмы, подавляющие как клеточный, так и гуморальный иммунитет, в частности интерфероновое звено иммунной системы [10], поэтому обоснованием назначения вспомогательной иммуностимулирующей терапии можно считать данные об успешности лечения генитальных кондилом в зависимости от потенциальной способности клеточного звена иммунной системы элиминировать ВПЧ [19, 33, 36]. Существуют данные о синергизме комбинированного применения различных методов в повышении эффективности лечения при ВПЧ-ассоциированной патологии слизистых оболочек и кожи [22, 28, 29].
Результаты данного обзора в какой-то степени подтверждают эффективность комбинации хирургической деструкции генитальных кондилом с назначением ИП в качестве вспомогательной иммуномодулирующей терапии. При этом комбинирование иммунотерапии с хирургической деструкцией по принципу «сандвича» считается предпочтительным при рецидивирующем респираторном папилломатозе. ИП принимают непос-редственно до и после хирургического удаления
папиллом. Из этого следует, что для элиминации инфицированных и трансформированных ВПЧ клеток гуморальными и клеточными компонентами иммунной системы на фоне вспомогательной иммунотерапии необходим пусковой механизм, чем является хирургическая деструкция, которая, по-видимому, фокусирует разносторонние механизмы иммунного ответа в очаг ВПЧ-инфекции. Разнообразие дизайна источников не оказало существенного влияния на результаты данного
систематического анализа. Так, выводы, полученные в результате скрупулезного анализа обобщенных данных 18 работ, подтверждались аналогичными данными, полученными при реализации многоцентровой программы Астра.
Результаты применения ИП в качестве системной иммуномодулирующей монотерапии при ВПЧ-ассоциированной патологии слизистых оболочек и кожи были неоднозначными. При этом
данные одних авторов свидетельствуют об удовлетворительном лечебном эффекте монотерапии
ИП [9, 13, 14, 21, 27, 35], а других авторов – о низком результате [4, 31] или отсутствии эффекта [24]. Такая вариабельность лечебного эффекта ИП, по-видимому, связана с широким диапазоном режима его применения. Так, 1 курс лечения ИП длился от 5 дней до 12 нед. При этом краткосрочные, 5-дневные, курсы лечения повторяли от 3 до 6 раз.
Ранее нами были проанализированы результаты применения ИП при различных вирусных, инфекционных и неинфекционных заболеваниях, где изложены особенности применения ИП у такого
контингента больных, как «трудные или проблемные пациенты» [3, 11].
В последние годы отмечается активная публикация результатов применения ИП на фоне деструктивной терапии урогенитальных папиллом высокочастотным электрическим током. Так,
Ю.Н. Кузнецов и Н.В. Зильберберг [7] применяли ИП по 4 г в сутки в течение 10 дней и продемонстрировали повышение эффективности после комбинированного режима по сравнению с показателями контрольной группы. П.С.Русакевич и соавт. [16] назначали ИП при ВПЧ-инфекции
по 3 г в день в течение 5–7 дней в составе комплексной многоэтапной терапии. При обострении генитального герпеса ИП назначали по 3 г в день в течение 5 дней 2–3 курса с интервалом 2–4 нед в комбинации с противогерпетическими препаратами, а в период ремиссии – по 1 г в день на протяжении от 2 до 12 мес с обязательным удалением очага на шейке матки. Эффективность комбинированного лечения с применением ИП при ВПЧ-инфекции составила 83,8%, а при сочетании ВПЧ и генитального герпеса – 78,2%. W.P.Chan и соавт. [21] у 10 больных с остроконечными кондиломами с высокой концентрацией ВПЧ добились элиминации видимых кондилом со снижением содержания вирусов в среднем в течение 18 дней. Е.А. Левончук [8] на основании применения ИП в течение 5 дней 2–3 курса с интервалом 2–4 нед при множественных бородавках у детей считает, что вспомогательная иммунотерапия значительно снижает вероятность рецидива заболевания. Повышение эффективности терапии рецидивирующего респираторного папилломатоза при комбинированном режиме применения ИП и, наоборот, неэффективность ИП в режиме монотерапии были показаны J. Elo и соавт. [24]. Представляют интерес данные F. Femiano и соавт. [25] о высокой эффективности применения ИП при ВПЧ-позитивной пролиферативно-бородавчатой лейкоплакии –
84% по сравнению с 28% при традиционном хирургическом лечении. Аналогичное (77,5%) выраженное клиническое улучшение с дополнительным 10% клиническим улучшением продемонстрировано Ю.В. Сергеевым и соавт. [17] после применения ИП при хроническом рецидивирующем атопическом дерматите, осложненном пиодермической и вирусной инфекцией.
ИП –длительно используемый в медицинской практике иммуностимулятор, который считается эффективным при различных вирусных инфекциях. ИП, по своей природе являясь производным пуринов и жизненно важным компонентом клеточного ядра, не дает выраженного токсического эффекта даже при назначении в высоких дозах. Обычно природные аналоги ИП поступают в организм из разнообразных пищевых продуктов. Поэтому при правильном назначении ИП в качестве иммуностимулятора с учетом противопоказаний к его применению частота побочных эффектов минимальна. Об этом свидетельствуют данные многолетнего использования ИП в медицинской практике во всем мире.
Таким образом, обнадеживающие результаты комбинированного применения ИП, представленные в проанализированных нами источниках литературы, позволяют сделать вывод о целесообразности вспомогательной иммунотерапии ИП на фоне традиционных методов лечения ВПЧ-ассоциированной патологии слизистых оболочек и кожи. Тем не менее требуется дальнейшее изучение эффективности этого метода с точки зрения доказательной медицины.



