Согласно отчету Всемирного информационного центра по ВПЧ-инфекции от 17 июня 2019 г., ежегодно в мире диагностируется около 569 847 новых случаев рака шейки матки (РШМ), который занимает 3-е место среди ведущих причин женского рака и является вторым наиболее распространенным женским раком среди женщин в возрасте от 15 до 44 лет в мире (сведения на 2018 г.). Стандартизованный показатель заболеваемости РШМ в мире в 2018 г. составил 13,1, летальность – 6,9 на 100 000 женщин [1].
В России в 2018 г. РШМ занимал 3-е место в структуре раков женской репродуктивной системы и 6-е место среди всех злокачественных новообразований, составив 4,8% и уступая раку молочной железы (18,4%) и тела матки (7,0%) [2].
Проблемы снижения онкологической заболеваемости и летальности населения находятся в фокусе пристального внимания правительства России. В рамках национальной онкологической программы 2009–2014 гг. проводились мероприятия, направленные на преобразование первичной и специализированной, в том числе высокотехнологичной, медицинской помощи. Однако целевой показатель по снижению смертности от онкозаболеваний за этот период достигнут не был. В майском Указе Президента № 204 от 7 мая 2018 г. «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года» среди главных целевых индикаторов определено снижение смертности от новообразований, в том числе злокачественных, до 185,0 на 100 000 населения, что ниже уровня 2017 г. (200,6) почти на 8%.
По данным статистики, в России летальность больных в течение года с момента установления диагноза РШМ снижается медленными темпами: 2014 г. – 16,3%, 2015 г. – 15,2%, 2016 г. – 14,6%, 2017 г. – 14,3%, 2018 г. – 13,8%, что во многом обусловлено высокими показателями запущенности при диагностике. Так, несмотря на то что РШМ является опухолью визуальной локализации, у ⅓ пациенток заболевание стабильно выявляется на поздних стадиях (III–IV): 2017 г. – 32,4%; 2018 г. – 32,6% [2].
Естественная история канцерогенеза шейки матки доказательно связана с ВПЧ-инфекцией, а длительность развития опухоли составляет 8–10 лет, что легло в основу программ скрининга РШМ, цель которых – выявить патологические изменения на стадии предопухолевого процесса [3]. Благодаря планомерной работе скрининговых программ, в последние годы отмечается значительное снижение показателей заболеваемости РШМ во многих развитых странах мира. Общепризнанно, что эффективность профилактических мер по борьбе с РШМ достоверно повышает организованное (а не оппортунистическое) проведение цитологического скрининга и вовлечение в него не менее 80% женщин [4, 5]. В России в настоящее время нет общегосударственных программ скрининга РШМ, соответствующих современным возможностям медицины, а доля охвата населения профилактическими осмотрами стабильно невысокая (29,8%), что позволяет сделать вывод о неадекватности профилактики РШМ [6]. Рост заболеваемости и летальности от РШМ у молодых женщин создает реальную угрозу репродуктивному потенциалу популяции россиян за счет утраты детородной функции и вследствие прямых потерь жизней потенциальных матерей [4, 7].
Проблемы заболеваемости и раннего выявления РШМ приобретают особое значение в регионах с низкой плотностью населения в связи с большими расстояниями и трудной доступностью медицинской помощи. Дальневосточный федеральный округ (ДВФО) имеет самую большую в РФ площадь территории – 6 952 555 км² (40,6% площади всей страны) и наименьшую плотность населения – 1,18 чел./км² (в РФ – 8,57 чел/км² на 1 января 2019 г.).
Цель – оценить показатели распространенности, летальности и выявляемости РШМ в ДВФО и наметить задачи по внедрению современного скрининга РШМ как пути уменьшения смертности женского населения.
Материалы и методы
Использованы статистико-аналитические методы, включавшие ретроспективный анализ официальных статистических показателей по РШМ в РФ, 8 федеральных округах (Центральном, Южном, Северо-Западном, Дальневосточном, Сибирском, Приволжском, Северо-Кавказском, Уральском) и 11 субъектах ДВФО (Чукотский автономный округ; 2 республики: Бурятия и Саха (Якутия); 4 края: Забайкальский, Камчатский, Приморский, Хабаровский; 4 области: Амурская, Еврейская автономная, Магаданская, Сахалинская), по данным сводных и региональных отчетов. Средние величины рассчитаны по общепринятой методике статистики.
Результаты и обсуждение
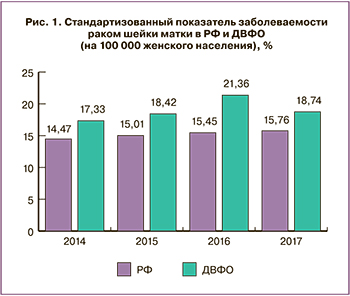 В ДВФО показатели заболеваемости РШМ за 2014–2017 гг. варьировали в пределах от 17,33 до 21,36 на 100 000 женского населения и существенно превышали показатели в РФ (14,47; 15,76) [8] (рис. 1).
В ДВФО показатели заболеваемости РШМ за 2014–2017 гг. варьировали в пределах от 17,33 до 21,36 на 100 000 женского населения и существенно превышали показатели в РФ (14,47; 15,76) [8] (рис. 1).
Показатели состоящих на учете и умерших больных от РШМ в Федеральных округах РФ в 2018 г. также имеют существенные различия (рис. 2). Наиболее высокий показатель контингента больных зарегистрирован в ДВФО – 152,3, наименьший – в Северо-Кавказском ФО – 80,8 при общероссийском показателе 123,7 на 100 000 женского населения. Доля умерших пациенток была наивысшей в Сибирском ФО – 3,9%, на втором ранговом месте находился ДВФО – 3,7%, минимальный показатель отмечен в Приволжском ФО – 3,0% (РФ – 3,3%).
При анализе аналогичных показателей в 11 субъектах ДВФО наибольшая величина распространенности РШМ в 2018 г. была в Забайкальском крае – 298,5 (это наивысший показатель в РФ), далее в порядке ранжирования следовали Магаданская область – 199,5, Камчатский край – 196,4, Республика Бурятия – 174,5, Сахалинская область – 144,0, Амурская область – 132,6, Приморский край – 124,8, Республика Саха (Якутия) – 105,6, Еврейская АО – 103,6, Хабаровский край – 98,6, Чукотский АО – 86,7 на 100 тыс женщин (рис. 3). Максимальный показатель летальности в ДВФО зарегистрирован в Чукотском АО – 6,5%, который также был наивысшим среди всех регионов РФ. На 2-м месте по доле умерших от РШМ была Еврейская АО – 5,1% (аналогичный показатель выявлен в г. Санкт-Петербурге), на 3-м – Амурская область – 4,6%, далее распределились: Республика Бурятия – 4,4%, Хабаровский край – 4,3%, Приморский край – 4,2%, Республика Саха (Якутия) – 3,4%, Сахалинская область – 3,3%, Забайкальский край – 2,9%, Магаданская область – 2,7%, Камчатский край – 1,9%. Отметим, что в Забайкальском крае доля летальных исходов в 2018 г. (2,9%) была ниже, чем в РФ (3,3%) и в ДВФО (3,7%), при наибольшей в стране и округе численности контингента состоящих на учете пациенток с РШМ (298,5 на 100 000). В Чукотском АО, напротив, доля умерших была самой большой (6,5%), а показатель находившихся на учете лиц – наименьшим: 86,7 vs 123,7 – в РФ; 152,3 – в ДВФО на 100 000 женщин.
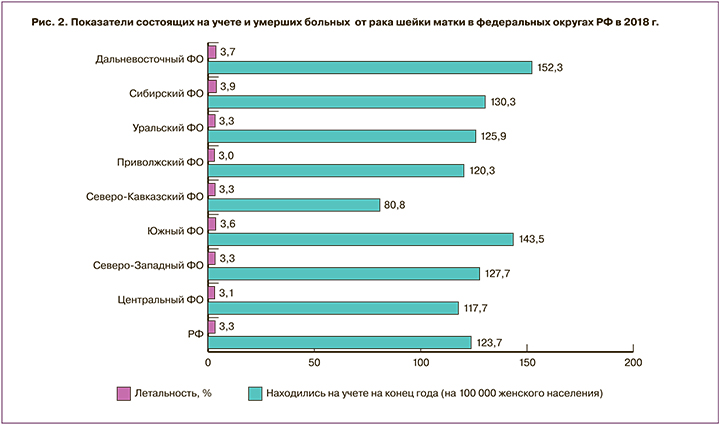
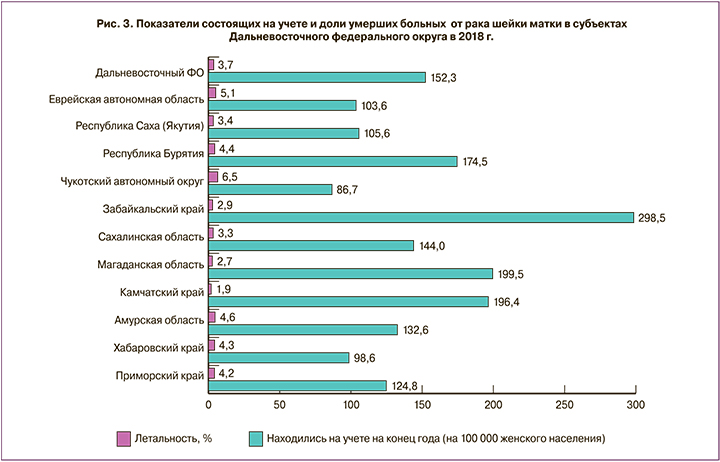
Высокие показатели распространенности и летальности РШМ, зарегистрированные в ДВФО и его субъектах, обосновывают актуальность проблемы более глубокого мониторинга злокачественных новообразований шейки матки с целью их раннего выявления и лечения.
По данным официальной статистики, в ДВФО в 2018 г. охват женского населения в возрасте 21–69 лет цервикальным скринингом составил 50,53% (ДИ 10,0–78,7%) (таблица), что недостаточно для эффективной работы программы профилактики РШМ (целевой показатель не менее 70%) [9]. Средний показатель активного выявления РШМ составил 48,58% (ДИ 33,51–66,7%), что, согласно рекомендациям Каприна А.Д. и соавт. (2019), следует рассматривать как низкий для новообразований визуальных локализаций [2]. Из числа пациенток с выявленным цервикальным раком лишь 45,29% (ДИ 0–67,0%) имели I стадию заболевания. Летальность больных в течение года с момента установления диагноза РШМ (из числа больных, впервые взятых на учет в предыдущем году) в ДВФО превысила показатель в РФ: 15,40% vs 13,80% соответственно [2]. На учете в онкологических учреждениях более 5 лет находились 61,02% (44,3–71,6%) жительниц ДВФО vs 65,9% в РФ [2].
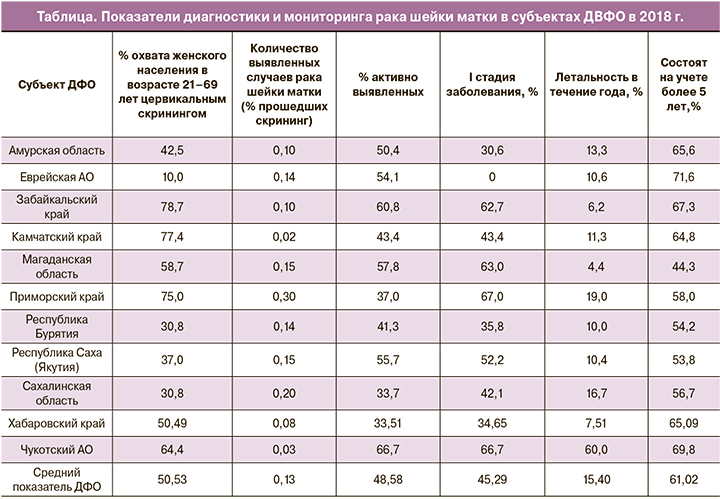
Приведенные сведения статистики о распространенности и исходах РШМ служат убедительным обоснованием необходимости принятия незамедлительных мер по внедрению программы организованного цервикального скрининга в ДВФО. Учитывая низкую плотность населения в регионе, большие расстояния, в качестве приоритетных задач следует решить следующие:
- создание базы данных женщин, подлежащих обследованию, прошедших его и с выявленной патологией;
- широкое информирование населения о необходимости участия в программах профилактики РШМ, включая социальную мобилизацию: СМИ, коммуникативные тренинги для медицинских и социальных работников, нефинансовые стимулы, вмешательства, основанные на напоминаниях/повторных вызовах;
- согласно Федеральным клиническим рекомендациям «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» 2017 г.:
- широта охвата организованным скринингом должна быть не менее 70%;
- начало цервикального скрининга – 21 год, окончание – 69 лет (при условии предыдущего адекватного скрининга и отсутствии в течение 20 лет CIN II);
- методы и кратность получения материала: 21–29 лет – цитология/жидкостная цитология не реже 1 раза в 3 года; 30–69 лет – цитология/жидкостная цитология + ВПЧ не реже 1 раза в 5 лет [9];
- для привлечения к участию в цервикальном скрининге большего числа женщин, особенно не желающих участвовать в программах скрининга из-за отдаленности от медицинской организации или отсутствия времени, предчувствия боли или неприятных ощущений от проведения осмотра, наличия негативного опыта встречи с работниками здравоохранения [10], допустимо использовать устройства для самостоятельного забора вагинального отделяемого для ВПЧ-теста, диагностическая ценность которых не уступает забору материала врачом [9–12];
- согласно Европейским рекомендациям по качественному выполнению цервикального скрининга, исследование образца на ВПЧ следует производить только в квалифицированных аккредитованных лабораториях, работающих в соответствии с международными стандартами. При этом лаборатория должна выполнять как минимум 10 000 ВПЧ-тестов ежегодно [13].
Заключение
В ДВФО имеет место наивысший показатель распространенности РШМ, что требует активного внедрения программы организованного цервикального скрининга, основанного на ко-тестировании цитологии/ВПЧ и доступного населению отдаленных территорий региона.



