Исследование проводится при государственной поддержке молодых российских ученых – Грант Президента Российской Федерации (МК-163.2011.7).
Гемореологические расстройства являются важным звеном патогенеза акушерской патологии. Во
многом это связано с активацией системы гемостаза при беременности, что создает преморбидный фон для тромбогеморрагических осложнений. В основе дезадаптации плацентарного кровообращения лежит развитие генерализованной микроангиопатии и тромбофилии вследствие сердечно-сосудистых, инфекционно-септических, иммунных, метаболических и генетических факторов [15, 29, 30].
Несмотря на многочисленные исследования сегодня остаются неизвестными значимость каждого из факторов риска и механизмы регуляции патогенеза преэклампсии, замедленного роста плода,
преждевременной отслойки плаценты, антенатальной гибели плода, преждевременных родов [10, 13, 19]. Традиционные критерии диагностики и оценки степени тяжести отражают полиорганность поражения и появляются при явной клинической картине на далеко зашедших стадиях. Каждый третий случай акушерских осложнений развивается на фоне минимально выраженных симптомов. Этот момент чрезвычайно важен для понимания того, что тяжелые исходы беременности не всегда являются логическим завершением прогрессирования заболевания и могут развиться при любой степени тяжести патологического процесса [2, 6, 8, 11, 17].
В связи с этим особого внимания заслуживают генетические тромбофилии – наследственные
формы недостаточности ингибиторов свертывания или аномалии коагуляционных протеинов, обусловливающие состояние претромбоза и предрасположенности к тромбозу, поскольку часто протекают без клинических проявлений и ассоциируются с плацентарными нарушениями и неблагоприятными исходами гестационного периода как для матери, так и для плода. [20, 21,23, 29, 31].
Цель исследования: изучение гемостазиологических взаимосвязей в патогенезе гестационных
осложнений, разработка методов более эффективной диагностики и оптимизации лечебно-профилактических мероприятий при поздних акушерских осложнениях. Одной из задач исследования явилась оценка генетических маркеров наследственной тромбофилии у практически здоровых беременных женщин без клинических проявлений тромбофилии.
Материал и методы исследования
В рамках когортного проспективного исследования проведено генотипирование 2177 беременных женщин, проживающих на территории Омска. Исследование проводили в муниципальном учреждении здравоохранения «Клинический родильный дом № 1» с функциями перинатального центра, являющегося базой кафедры акушерства и гинекологии последипломного образования Омской государственной медицинской академии.
Для проведения исследования был организован консультативно-диагностический прием для женщин с осложнениями беременности и патологией системы гемостаза. Участниц исследования отбирали путем последовательной популяционной выборки в период 2009–2011 гг. из числа амбулаторных и стационарных пациенток. Кандидатами на исследование были 2497 беременных женщин со сроком гестации до 12 нед. В исследование не включали беременных с экстрагенитальной патологией в стадии суб- и декомпенсации, новообразованиями, аномалией развития половых органов, привычным невынашиванием беременности, многоплодием и индуцированной беременностью. В процессе исследования были исключены пациентки с прерыванием беременности до 28 нед, истмико-цервикальной недостаточностью, предлежанием плаценты, инфекционными заболеваниями. В анализ не вошли данные женщин, у которых состояние плода/новорожденного
были обусловлены маркерами хромосомной патологии, пороками развития, врожденными вирусными или инфекционными заболеваниями, а также роды которых осложнились выпадением пуповины, хориоамнионитом, родовой травмой.
Результирующие осложнения гестации: преэклампсию, преждевременную отслойку нормально расположенной плаценты, преждевременные роды, перинатальную заболеваемость и смертность, обусловленные внутриутробной гипоксией и замедленным ростом плода, оценивали после 28 нед беременности.
Необходимое число участниц исследования было рассчитано на основе выборочной доли [5,
14]. С учетом частоты изучаемых показателей в Омской области за предшествующий пятилетний период [1, 3, 9], за наименьшую долю выборки принят средний показатель преждевременной отслойки плаценты (1,2%). Наименьший размер выборки, обеспечивающий необходимый предел
погрешности для минимальной доли, составил 2100 беременных женщин, при доверительном
уровне 95% погрешность доли выборки составила 0,3% (0,003) [12, 16, 18, 27]. Окончательный
размер выборки был увеличен на 15% с учетом случаев выбывания и составил 2400 исследуемых. Рассчитанная численность выборочной совокупности беременных женщин позволила
проводить анализ тяжелых акушерских осложнений, частота которых не превышала 1–3%.
Охват исследуемой популяции составил 15%.
В соответствии с критериями исследования, когорту составили 2356 практически здоровых беременных. Завершили исследование 2212 (93,9%) пациенток, принявших участие в исследовании (табл. 1). Проанализированы течение и исходы беременностей и родов, состояние
новорожденных в момент рождения и течение неонатального периода у 2177 (92,4%) женщин,
данные которых были доступны на конец исследования.
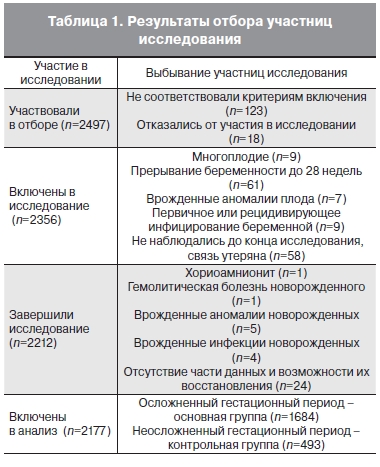
Из числа наблюдаемых пациенток были сформированы две группы: основная (А) и контрольная (В). Контрольную группу (n=493) составили женщины с физиологическим течением беременности, родов и периодом ранней адаптации новорожденного. В основную группу исследования (n=1684) вошли пациентки с осложнениями второй половины беременности легкой, средней и тяжелой степеней тяжести.
Наблюдение беременных женщин велось стандартно в соответствии с Приказами Минздравсоцразвития РФ: №50 от 10.02.2003 «О совершенствовании акушерско-гинекологической
помощи в амбулаторно-поликлинических учреждениях»; №808н от 02.10.2009 «Об утверждении
Порядка оказания акушерско-гинекологической помощи»; №409н от 01.06.2010 «Об утверждении
Порядка оказания неонатологической медицинской помощи».
Идентификацию наследственной тромбофилии проводили сотрудники научно-исследовательской лаборатории Омской государственной медицинской академии. Она включала тестирование методом полимеразной цепной реакции с проведением рестрикционного анализа амплифицированных фрагментов ДНК генов-кандидатов предрасположенности к развитию тромботических состояний: F5:1691 G>A (Arg506Gln) коагуляционного фактора V (LEIDEN); F2: 20210 G>A коагуляционного фактора II, протромбина; SERPINE1 (PAI-1): -675 5G>4G ингибитора активатора плазминогена, тип 1; MTHFR: 677 C>T(Ala222Val) гена метилтетрагидрофолатредуктазы.
Статистический анализ производили с помощью программ Excel, Statistica 6. Проверку нормальности распределения количественных параметров проводили с помощью критериев Колмогорова-Смирнова и Шапиро-Уилка. Распределения непрерывных количественных данных, являющихся приближенно нормальными, описали центральной тенденцией и дисперсией: среднее (M),
среднеквадратическое отклонение. Для описания распределений, не являющихся нормальными, применяли медиану (Ме) и интерквартильный размах в виде 25% и 75% процентилей: Ме
(25%; 75%). Проверку статистических гипотез о различиях для количественных и порядковых
переменных проводили с применением критерия Краскелла-Уоллиса, в случаях категориальных
переменных (абсолютных и относительных частот, долей) критерия хи-квадрат (χ2) с поправкой
Йетса, учитывая степени свободы (df). Для оценки относительного риска был проведен анализ
таблиц сопряженности: отношение шансов (ОШ) и двусторонние 95% доверительные интервалы
(ДИ). Достигнутый уровень значимости (p) приведен как р=0,000.., рассчитывался с учетом его
критического значения 5% (0,05).
Результаты исследования
С учетом числа критериев отбора и в соответствии с задачами исследования изучаемый контингент был представлен практически здоровыми беременными женщинами, сопоставимыми по основным общим, антропометрическим и клиническим параметрам (рис. см. на вклейке).
Средний возраст пациенток основной группы составил 26,6±5,9 года, контрольной –
24,8±5,0 лет. Как видно из рисунка, в основной группе в два раза больше пациенток в возрасте
30–34 года (ОШ=1,8; 95% ДИ 1,3–2,4; χ²=15; df=1; p=0,000) и 35–39 лет (ОШ=2,1; 95% ДИ
1,3–3,3; χ²=9; df=1; p=0,003), а число беременных 20–25 лет меньше (ОШ=0,6; 95% ДИ 0,5–0,7;
χ²=28; df=1; p=0,000).
Уменьшение продолжительности гестационного периода у женщин с акушерскими осложнениями (37,2±2,0 нед) по сравнению с контрольной группой (38,5±0,8 нед) обусловлено в первую очередь числом преждевременных родов. Среди пациенток основной группы значимо высоким был процент родов в 34–36 нед (ОШ=1,4; 95% ДИ 1,2–1,6; χ²=14; df=1; p=0,000) и меньше родоразрешений произошло при доношенном сроке беременности в 37–39 нед (ОШ=0,8; 95% ДИ 0,7–0,9; χ²=10; df=1; p=0,001).
Срок родов определял гестационный возраст новорожденных, давая косвенную оценку внутриутробным условиям антенатального периода. Так, средняя масса тела при рождении у детей контрольной группы составила 3492±283 г. В группе с осложнениями второй половины гестации масса тела родившихся детей была меньше – 3043±653 г за счет бóльшего числа рождений с массой тела 2000–3000 г (ОШ=1,39; ДИ 1,2–1,6; χ2=30; df=1; p=0,000) и меньшей доли новорожденных масой 3000–3500 г (ОШ=0,6; ДИ 0,6–0,7; χ2=35; df=1; p=0,000).
Все беременные состояли на диспансерном учете в 12 женских консультациях и впоследствии родоразрешались в шести родильных домах Омска.
Средние частоты исследуемых генотипов в когорте беременных женщин сопоставимы со значениями других исследованных популяций европейского происхождения, но имеют отличительные особенности в группах (табл. 2). В исследуемой популяции беременных женщин
высокий уровень полиморфизма, при котором частота редкого аллеля превышает 30%, характерен для генов РАI-1 (62%) и MTHFR (36%), низкая распространенность полиморфных локусов выявлена в генах F5 (2%) и F2 (3%).
Таблица 2. Аллельные варианты и распределение частот протромботических полиморфизмов у
женщин с акушерскими осложнениями и физиологическим течением гестационного периода.
У женщин с осложнениями гестации и при физиологическом течении беременности не
обнаружено значимых различий частот полиморфизмов плазменных факторов свертывающей системы крови, F5 (ОШ=1,9; ДИ 0,7–5,5; χ2=2,6; df=1; p=0,110) и F2 (ОШ=1,8; ДИ 0,7–4,6;
χ2=2; df=1; p=0,125).
В то же время в контрольной группе не было носителей Лейденской мутации и гомозиготы по
редкому аллелю гена протромбина, частота гетерозиготных генотипов гена F5 составила 1,4%, гена F2 – 2,0%, а в основной группе исследования – 2,7 и 3,4% соответственно.
Носительство редкого аллеля гена метилтетрагидрофолатредуктазы (MTGFR, C677T) в два
раза увеличивает риск развития неблагоприятных исходов гестационного периода (ОШ=2,1;
ДИ=1,7–2,6; χ2=41; df=1; p=0,000). Для данного гена обнаружены значимые различия по распределению полиморфных аллелей в исследуемых группах. Так, в контрольной группе частота
редкого аллеля MTHFR составила 24%, нулевых гомозигот – 7% и гетерозиготных носителей –
33%. При акушерских осложнениях мутантный аллель полиморфизма (MTGFR, C677T) встре-
чался у 40% беременных, генотипы, гомозиготные по редкому аллелю – у 36%, гетерозиготные
генотипы имели 49% женщин.
Среди беременных женщин с полиморфизмом ингибитора активатора плазминогена (PAI-1, -675
4G/5G) в основной группе исследования преобладали гетерозиготные носители, значимо повышая шансы развития гестационных осложнений (ОШ=1,7; ДИ 1,4–2,2; χ2=25; df=1; p=0,000). При этом заслуживает внимания тот факт, что гомозиготные генотипы гена PAI-1 не были связаны с
рассматриваемым риском: доля гетерозигот РАI-1 основной группы была 43% (в контрольной группе – 30%), количество гомозигот по 4G аллелю – 41% (в контрольной группе – 44%) и по 5G аллелю – 16% (в контрольной группе – 26%).
Обсуждение
Незначимые различия распределения полиморфизмов F5: 1691 G>A (Arg506Gln) и F2: 20210 G>A при различных исходах гестации отличают полученные нами результаты от известной тенденции нарастания частоты мутантных аллелей со степенью тяжести акушерских осложнений
[22, 24, 25, 28].
Хотелось бы подчеркнуть, что низкий диапазон полиморфизмов плазменных факторов, протестированных в данной работе, не может однозначно указывать на различия распространенности генетических факторов в европейской популяции, как и не должен абсолютизировать благоприятную тенденцию в исследуемой популяции. Прежде всего, мы не можем исключить вмешивающегося воздействия критериев отбора проводимого исследования, поэтому экстраполяция полученных результатов, согласно задачам исследования, возможна на фенотипически здоровый контингент беременных женщин без клинических проявлений тромбофилии.
В настоящее время трудно объяснить повышение в исследуемой выборке частоты сочетания двух патологических аллелей: MTHFR: 677 C>T (Ala222Val) и (PAI-1, -675 4G/5G). Полиморфизм MTHFR, достигающий в популяции 36%, приводит к повышению в крови концентрации гомоцистеина – серосодержащей аминокислоты, участвующей в обмене метионина. Высокий уровень гомоцистеина в плазме крови является известным атерогенным и тромбогенным фактором риска [4, 32]. Мажорная 4G-мутация в промоторной области гена PAI-1, доля которой у беременных женщин составляет 42%, сопровождается нарушением процесса транскрипции и повышением концентрации в крови ингибитора активатора плазминогена, что само по себе является фактором тромбогенного риска [26].
Однако очевидно, что лица с подобными генотипами обладают определенными адаптивными
преимуществами, характер проявления которых в настоящее время неизвестен. По-видимому,
значимыми являются определенные межгенные взаимодействия, для выяснения природы этих
связей в рамках исследования проводится анализ распределения сочетаний генотипов по каждой паре генов.
В целом полученные результаты указывают на то, что к вопросу о клинической интерпретации
генетических факторов риска необходим комплексный подход, включающий как анализ распределения полиморфных аллелей в различных клинических группах пациенток, так и предварительные данные популяционных исследований.



