Системная красная волчанка (СКВ) – заболевание из группы диффузных болезней соединительной ткани, поражающее преимущественно женщин репродуктивного возраста. Оно развивается на основе генетически обусловленного несовершенства иммунорегуляторных процессов, характеризуется потерей иммунной толерантности к собственным антигенам и персистентной продукцией патогенных аутоантител [1–3].
У женщин СКВ возникает чаще, чем у мужчин. Половые различия в частоте и тяжести аутоиммунных заболеваний объясняют влиянием женских половых гормонов на иммунную систему. Особенно важную роль при этом играют эстрогены и пролактин, оказывающие значительное модулирующее влияние на иммунный ответ [4]. При беременности высокий уровень прогестерона может снижать активность заболевания путем угнетения Th1- и Th17-цитокинов и индукции противовоспалительных цитокинов [5].
Поскольку СКВ возникает у женщин преимущественно репродуктивного возраста (у 90% женщин в возрасте 13–30 лет), актуальны вопросы, касающиеся развития этой патологии в период беременности, влияние беременности на активность и прогноз СКВ, а также влияния СКВ на течение гестационного процесса и родов, исходы беременности, на развитие плода и новорожденного [6, 7].
Частота обострений СКВ во время беременности варьирует от 46 до 70%. Важным моментом является степень активности заболевания к моменту зачатия. Женщины с активной СКВ в момент зачатия, с волчаночным нефритом или с антифосфолипидным синдромом (АФС) имеют наиболее высокий риск развития осложнений беременности [8]. Известно, что наименьшая частота обострения СКВ при гестации будет в том случае, если зачатие наступило на фоне длительной ремиссии (не менее 6 мес). Кроме того, чем выше степень активности СКВ к моменту зачатия, тем выше процент активации заболевания во время гестационного процесса [9].
Обострение СКВ во время беременности не всегда легко распознается, поэтому рекомендуется проводить мониторинг, включающий ежемесячные лабораторные тесты, ультразвуковое обследование и кардиотокографию плода у матерей с SS-A (Ro) или SS-B (La) антителами. Существует мнение, что при отсутствии признаков или симптомов активной СКВ специфической терапии при беременности не требуется. Обострение СКВ во время беременности обычно лечат гидроксихлорохином, низкодозовым преднизолоном, пульсовым внутривенным введением метилпреднизолона и азатиоприном. Применение высоких доз преднизолона и циклофосфамида ассоциируется со значительными осложнениями беременности и плохим акушерским исходом [10]. Нефрит в анамнезе или активация СКВ в течение 6 месяцев перед зачатием предсказывает плохой исход для плода. Беременность рекомендуется отложить до тех пор, пока не будет достигнута 6-месячная ремиссия [11].
В последнее время, в связи с улучшением клинических исходов, беременность у женщин с СКВ становится более обыденной. В большинстве случаев рождается живой ребенок, но беременность остается фактором высокого риска. Хотя эпидемиологические данные свидетельствуют об улучшении в прогнозе беременности у этих женщин, остается повышенным риск таких осложнений беременности, как невынашивание, мертворождение, преэклампсия и задержка внутриутробного роста плода [12]. Заболеваемость и смертность матери и плода увеличены по сравнению с общей популяцией. По-видимому, вклад в это вносят отклонения в иммунной адаптации к беременности. Предикторами плохого исхода служат активация у матери СКВ, вовлечение почек, наличие специфических аутоантител и повреждений органов. Терапевтические воздействия ограничиваются во время беременности, так как приходится взвешивать пользу для матери и риск для плода. Необходимо проводить профилактику невынашивания беременности и преждевременных родов, а также сердечную блокаду у плода [13].
 Присущие СКВ иммунопатологические механизмы, нарушения эстрогенового метаболизма, коагулопатии, тромбоцитопатии, различные висцериты приводят к высокой частоте развития у беременных спонтанных абортов, мертворождений, миокардитов, преэклампсии, почечной недостаточности. Высока частота преждевременных родов, аномалий родовой деятельности, кровотечений в родах и раннем послеродовом периоде. По данным I. Iozza и соавт., частота осложнений у беременных с СКВ составляет 50–60%, частота потерь беременностей увеличивается в 4,8 раза, а частота преждевременных родов – в 6,8 раза. Наиболее грозные осложнения встречаются в 10% случаев. Материнская смертность составляет 2–3% [14]. Кроме того, имеет место высокая частота осложнений раннего неонатального периода, таких как гипотрофия, неонатальная волчанка. Высока перинатальная смертность. Матери с СКВ имеют повышенный риск кесарева сечения, послеродовых кровотечений, гемотрансфузии. У них более часто рождаются недоношенные дети, дети с малым весом и с врожденной сердечной блокадой [12].
Присущие СКВ иммунопатологические механизмы, нарушения эстрогенового метаболизма, коагулопатии, тромбоцитопатии, различные висцериты приводят к высокой частоте развития у беременных спонтанных абортов, мертворождений, миокардитов, преэклампсии, почечной недостаточности. Высока частота преждевременных родов, аномалий родовой деятельности, кровотечений в родах и раннем послеродовом периоде. По данным I. Iozza и соавт., частота осложнений у беременных с СКВ составляет 50–60%, частота потерь беременностей увеличивается в 4,8 раза, а частота преждевременных родов – в 6,8 раза. Наиболее грозные осложнения встречаются в 10% случаев. Материнская смертность составляет 2–3% [14]. Кроме того, имеет место высокая частота осложнений раннего неонатального периода, таких как гипотрофия, неонатальная волчанка. Высока перинатальная смертность. Матери с СКВ имеют повышенный риск кесарева сечения, послеродовых кровотечений, гемотрансфузии. У них более часто рождаются недоношенные дети, дети с малым весом и с врожденной сердечной блокадой [12].
Имеющиеся в литературе данные недостаточно полно характеризуют состояние беременных с этим мультисистемным аутоиммунным заболеванием, особенности течения беременности и зависимости клинических проявлений заболевания и осложнений беременности от активности разных компонентов иммунной системы. До настоящего времени остаются дискутабельными многие вопросы, касающиеся оптимального ведения беременности у женщин, страдающих СКВ, в том числе лечения основного заболевания.
Цель настоящего исследования – клинико-иммунологическая характеристика беременных с СКВ, выявление особенностей течения беременности, родов и послеродового периода.
Материал и методы исследования
В проспективное исследование была включена 31 беременная женщина с СКВ, находившаяся под наблюдением в ФГБУ НЦАГиП им. В.И. Кулакова (в 2011–2013 гг.) в возрасте от 22 до 37 лет, родоразрешенная самопроизвольно или путем операции кесарева сечения, со сроком гестации 24 и более недель.
Критериями включения служили: СКВ I–III степени активности и беременность. Результаты иммунологического обследования сравнивались с показателями 14 женщин с физиологическим течением беременности.
Проводилось общеклиническое и иммунологическое обследование, изучение анамнестических данных женщин, особенностей течения основного заболевания, особенностей течения беременности, родов, послеродового периода у женщин и раннего неонатального периода у их новорожденных.
Для оценки иммунного статуса беременных проводили фенотипирование лимфоцитов периферической крови методом проточной цитометрии с использованием флюоресцентно меченных моноклональных антител фирмы Beckman Coulter (USA) к CD45, CD3, CD16, CD56, CD4, CD8, CD5, CD19, HLA-DR, CD25, CD127 маркерам. Определяли характерные для СКВ антиядерные аутоантитела (АНФ), антитела к нативной ДНК (нДНК), к экстрагируемым ядерным антигенам Sm, Ro/SS-A, La/SS-B непрямым иммунофлюоресцентным и иммуноферментным методами, а также содержание иммуноглобулинов М, А и G классов в сыворотке крови турбидиметрическим методом.
Статистическую обработку данных проводили по общепринятым методам вариационной статистики с использованием пакетов статистического анализа для Microsoft Office Excel 2007 и MedCalc для Windows 7. Данные представлены как среднее значение ± стандартное отклонение. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью t-критерия Стьюдента с различными дисперсиями для средних значений.
Результаты исследования и обсуждение
Все пациентки, включенные в исследование, были сопоставимы по возрасту: средний возраст женщин с СКВ составил 29,8±3,2 года.
Средняя длительность течения СКВ – 10,0±4,4 года, длительность ремиссии СКВ до наступления беременности – 1,5±1,1 года. Женщины исследуемой группы различались по степени активности СКВ: 23 (74%) женщины имели I степень, 6 (19%) – II степень, 2 (6%) – III степень активности заболевания. Таким образом, у большинства женщин на момент наступления беременности была I степень активности СКВ.
Оценка наследственности показала, что 9 (29%) женщин имели отягощенную наследственность по аутоиммунным заболеваниям, в том числе 3 из них (10%) – по заболеваниям соединительной ткани (ревматоидный артрит, склеродермия). У многих женщин выявлена отягощенная наследственность по сердечно-сосудистым (65%), онкологическим (32%) заболеваниям и варикозной болезни (23%).
Анализ экстрагенитальной патологии выявил высокую частоту неспецифических поражений органов желудочно-кишечного тракта, дыхательной, мочевыделительной систем, щитовидной железы (диффузный и узловой зоб), органа зрения.
В акушерском анамнезе отмечена высокая частота (23%) самопроизвольных выкидышей в данной группе женщин. Перинатальные потери имели место у 5 (16%) женщин с СКВ.
Нами проанализирована частота органных поражений, иммунологических и гематологических изменений при СКВ на протяжении периода наблюдения (табл. 1). Органные поражения имели место у 20 (65%) пациенток.

Важно отметить отсутствие изолированных органных поражений. Всегда отмечалось сочетание патологии тех или иных органов с иммунологическими или гематологическими изменениями. Наиболее часто имело место поражение суставов (29%), почек (26%), кожи (23%) и сосудов (19%). У 9 (29%) женщин имелось сочетание основного заболевания с АФС (16%), болезнью Шегрена (6,5%), склеродермией в рамках перекрестного синдрома (Overlap-синдрома) (6,5%).
Выраженные иммунологические и гематологические изменения у беременных с СКВ (выявление АНФ, антител к нДНК, Sm, SS-A (Ro) или SS-B (La), ревматоидного фактора, С-реактивного белка, снижение С3, С4 компонентов комплемента, анемия, тромбоцитопения, лейкопения, лимфопения) выявлены у 11 (35%) беременных. Превышающий нормативные показатели уровень аутоантител к нДНК во время беременности был определен у 17 (55%) беременных, АНФ – у 11 (35%), у 9 (29%) выявлен повышенный уровень анти-Sm, у 7 (22,6%) – Ro-антител, у 5 (16,1%) – La-антител, в большинстве случаев в различных сочетаниях.
При оценке иммунного статуса наблюдаемых нами беременных с СКВ были получены результаты, свидетельствующие об определенном изменении в субпопуляционном составе Т-лимфоцитов и снижении доли NK-клеток (табл. 2).
Как можно видеть, несмотря на то что исследование проводится на фоне лечения глюкокортикостероидами и цитостатиками, отмечается тенденция к увеличению относительного количества Т-лимфоцитов (CD3+), среди которых увеличивается доля активированных Т-лимфоцитов (CD3+HLА-DR+). Определяется статистически значимое снижение содержания CD16+56+-клеток (естественные цитотоксические клетки) и увеличение CD4+CD25high/CD127low/- лимфоцитов (Т-регуляторные лимфоциты) у женщин с СКВ по сравнению с контролем. Эти данные свидетельствуют о дисбалансе в соотношениях иммунокомпетентных клеток.
При определенной тенденции к увеличению относительного количества В2-лимфоцитов (CD19+CD5-) и В1-лимфоцитов (CD19+CD5+) в группе беременных с СКВ (8,58±2,74% и 1,21±0,86% соответственно) статистически значимого различия с контролем не выявлено (6,77±2,75% и 0,38±0,11%, p>0,05). В сыворотке периферической крови беременных с СКВ также наблюдалась тенденция к увеличению содержания иммуноглобулинов всех изотипов (А, G, М), однако по сравнению с содержанием у женщин с физиологическим течением беременности (IgА – 2,61±0,91 против 1,23±0,52; IgG – 12,50±3,55 против 10,53±2,01; IgМ – 2,01±0,65 против 1,94±0,84 соответственно) статистически значимо увеличен был только уровень иммуноглобулина класса А (р=0,0012).
Известно, что СКВ, являясь мультисистемным аутоиммунным заболеванием, характеризуется присутствием гиперактивных иммунных клеток, дисрегулированной активацией Т-лимфоцитов, поликлональной активацией В-лимфоцитов, продуцирующих аутореактивные антитела ко многим ядерным и цитоплазматическим антигенам, и образованием иммунных комплексов, вызывающих повреждение тканей и органов [2, 15]. Обнаруженные в нашем исследовании изменения в соотношениях иммунокомпетентных клеток не носят ярко выраженных признаков гиперактивации иммунной системы у обследованных нами беременных женщин, что может объясняться состоянием беременности и воздействием получаемых ими иммунодепрессантов – цитостатиков и глюкокортикостероидов.
Всем женщинам с СКВ, находившимся под нашим наблюдением, проводилась терапия основного заболевания на протяжении беременности. Причем большинство женщин – 24 (77%) находились на комбинированной двухкомпонентной терапии (глюкокортикостероиды+плаквенил), а 2 (6%) на трехкомпонентной – (глюкокортикостероиды+плаквенил+азатиоприн). Глюкокортикостероиды без применения цитостатиков получали 5 (16%).
Обострение СКВ в различные сроки беременности отмечалось у 13 (42%) женщин, что потребовало увеличения доз глюкокортикостероидов либо проведения пульс-терапии глюкокортикостероидами в различные сроки беременности. У 4 (13%) женщин обострение наблюдалось только в 1-м триместре беременности, у 4 (13%) – только во 2-м, у 2 (6%) – только в 3-м, у 2 (6%) пациенток обострение СКВ было дважды на протяжении беременности, у 1 (3%) – трижды.
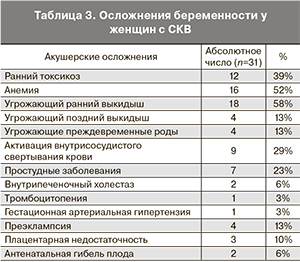
При анализе течения беременности у данной группы женщин обращала на себя внимание высокая частота развития осложнений беременности на различных сроках (табл. 3). Чаще всего это были сочетанные осложнения.
У женщин с СКВ отмечалась высокая частота анемии (52%), угрозы прерывания беременности (84%), особенно в 1-м триместре, активации внутрисосудистого свертывания крови (29%). Плацентарная недостаточность была у 10% женщин, у 6% из них произошла антенатальная гибель плода.
 Беременность закончилась своевременными родами у 21 (68%) женщины с СКВ. Наблюдалась высокая частота преждевременных родов – у 10 (32%) женщин в исследуемой группе. У 2 (6%) произошла антенатальная гибель плода в сроке беременности 24–25 недель в связи с первичной плацентарной недостаточностью. Роды через естественные родовые пути произошли у 16 (52%) женщин, в том числе у женщин с антенатальной гибелью плода. Путем операции кесарева сечения родоразрешено 15 (48%) женщин, в том числе у 3 (20%) женщин кесарево сечение было проведено в плановом порядке, у 12 (80%) – в экстренном. Показаниями для планового кесарева сечения явились в 2 случаях наличие рубца на матке после кесарева сечения, в 1 – полная AV-блокада у плода. Показаниями для экстренного кесарева сечения стали в 5 (42%) случаях слабость родовой деятельности, в 4 (33%) – острая гипоксия плода, в 3 (25%) – преждевременное излитие околоплодных вод и неготовность мягких родовых путей к родам.
Беременность закончилась своевременными родами у 21 (68%) женщины с СКВ. Наблюдалась высокая частота преждевременных родов – у 10 (32%) женщин в исследуемой группе. У 2 (6%) произошла антенатальная гибель плода в сроке беременности 24–25 недель в связи с первичной плацентарной недостаточностью. Роды через естественные родовые пути произошли у 16 (52%) женщин, в том числе у женщин с антенатальной гибелью плода. Путем операции кесарева сечения родоразрешено 15 (48%) женщин, в том числе у 3 (20%) женщин кесарево сечение было проведено в плановом порядке, у 12 (80%) – в экстренном. Показаниями для планового кесарева сечения явились в 2 случаях наличие рубца на матке после кесарева сечения, в 1 – полная AV-блокада у плода. Показаниями для экстренного кесарева сечения стали в 5 (42%) случаях слабость родовой деятельности, в 4 (33%) – острая гипоксия плода, в 3 (25%) – преждевременное излитие околоплодных вод и неготовность мягких родовых путей к родам.
Наши результаты согласуются с данными, представленными в литературе, из которых следует, что матери с СКВ имеют повышенный риск кесарева сечения, послеродовых кровотечений, гемотрансфузии. У них чаще рождаются недоношенные дети, дети с малым весом и с врожденной сердечной блокадой [12].
Осложнения в родах имели место у 19 (61%) женщин. На 1-м месте по частоте осложнений в родах встречалось преждевременное излитие околоплодных вод, которое произошло у 13 (68%) женщин. Слабость родовой деятельности встречалась в 5 (26%) случаях. Острая гипоксия плода осложнила течение родов у 1 (5%) пациентки. У 3 (16%) женщин беременность осложнилась развитием преэклампсии, что потребовало досрочного родоразрешения.
Осложнения послеродового периода встречались у 16 (52%) женщин. У всех женщин с осложненным течением послеродового периода имели место признаки активации внутрисосудистого свертывания крови по данным гемостазиограммы. Субинволюция матки имела место у 5 (31%) пациенток. Послеродовой эндометрит развился у 3 (19%) женщин. У 1 (6%) женщины в послеродовом периоде развилась гемолитическая анемия. Осложнения послеродового периода потребовали назначения дополнительного обследования, консервативного или хирургического лечения.
При оценке состояния новорожденных исследуемой группы были получены следующие результаты. Средний срок гестации на момент родоразрешения для доношенных детей составил 38±1,0 недели, для недоношенных – 34±2,6 недели. Средняя масса тела доношенных детей составила 3155±411 г, недоношенных – 2315±499 г. Средняя длина тела доношенных детей составила 50±1,5 см, недоношенных – 47±3,0 см. Средняя оценка состояния доношенных новорожденных по шкале Апгар на 1-й минуте составила 7,6±0,7 балла, на 5-й – 8,7±0,5 балла, недоношенных новорожденных: на 1-й минуте – 6,9±0,9 балла, на 5-й – 8±0,75 балла.
Высокой была частота осложнений раннего неонатального периода – у 41% новорожденных. Среди них встречались тромбоцитопения (17%), геморрагический синдром (8%), неонатальная желтуха (25%), инфекционные осложнения (42%), дыхательные нарушения (25%), AV-блокада (8%).
Таким образом, у половины детей, рожденных от женщин с СКВ, имели место осложнения раннего неонатального периода. Это потребовало перевода детей на второй этап выхаживания для дополнительного обследования и лечения. Выписка детей проводилась в среднем на 10-е сутки жизни (от 4 до 60 суток).
Заключение
Для большинства женщин с СКВ в исследуемой группе характерны средний репродуктивный возраст, длительное течение СКВ, продолжительная ремиссия до наступления беременности, высокая частота поражений органов мочевыделительной системы и сердечно-сосудистой системы, кожи и суставов, в сочетании с выраженными иммунологическими и гематологическими изменениями. Имеет место отягощенная наследственность по аутоиммунным, сердечно-сосудистым, онкологическим заболеваниям. В акушерском анамнезе отмечена высокая частота самопроизвольных выкидышей и наличие перинатальных потерь.
На фоне иммуносупрессивной терапии беременных наблюдаются дисрегуляторные нарушения в иммунной системе, увеличение доли активированных Т-лимфоцитов и Т-регуляторных клеток, снижение содержания NK-клеток. Определяется повышенный уровень иммуноглобулинов, особенно класса А, выявляются специфические антинуклеарные антитела.
У женщин с СКВ отмечается высокая частота осложнений беременности (анемия, угроза прерывания беременности, активация внутрисосудистого свертывания крови, плацентарная недостаточность, в двух случаях антенатальная гибель плода), родов (преждевременные роды, кесарево сечение) и послеродового периода (послеродовой эндометрит, субинволюция матки, признаки активации внутрисосудистого свертывания крови). Дети, рожденные женщинами с СКВ, отличаются более низкими массо-ростовыми показателями по сравнению с популяционными и высокой частотой осложнений раннего неонатального периода, поэтому нередко требуется помещение их в отделение реанимации и интенсивной терапии новорожденных и на второй этап выхаживания.
Однако правильный подбор и своевременная коррекция терапии основного заболевания у большинства беременных позволяют избежать обострений СКВ и добиться благоприятных исходов беременности. Решающее значение для успешной беременности имеет оказание лечебной помощи женщинам с СКВ, направленной на достижение необходимого периода ремиссии заболевания до зачатия, а также возможности последующей коррекции терапии во время беременности. Рекомендуется наблюдение этих пациенток в клинике третьего уровня с участием многопрофильной группы врачей (акушеров, ревматологов или терапевтов, нефрологов и педиатров).



