Проблема тромботических заболеваний является актуальной для врачей различных специальностей как взрослой, так и детской практики. В последние годы в связи с открытием ряда ранее неизвестных генетически обусловленных дефектов гемостаза, предрасполагающих к тромбозу (мутация фактора V Leiden, мутация протромбина G20210A, мутация метилентетрагидрофолатредуктазы C677Т, полиморфизм гена активатора плазминогена-1, полиморфизм тромбоцитарных рецепторов), стало возможным объяснение тромботических эпизодов, возникающих у детей, в т. ч. осложняющих различные манипуляции [1]. Особенностью генетически обусловленной тромбофилии является то, что она может долгое время никак себя не проявлять.
В течение последних лет тромбозы у детей диагностируют все чаще. Обычно они возникают при
воздействии двух и более протромботических факторов, как генетически обусловленных, так и остро
развившихся тромботических осложнений, при этом тромботические и геморрагические осложнения приводят к ранней инвалидизации и смертности пациентов [5, 7, 10].
По данным Канадского регистра тромбозов, 5,3% из 10 тыс. госпитализированных детей переносят
тромбозы, 95% из которых – вторичные, связанные с такими серьезными состояниями, как злокачественные новообразования, травмы, операции, врожденные заболевания сердца и системная
красная волчанка (СКВ) [6]. Данные о частоте тромбозов у детей первых 6 месяцев жизни немногочисленны: по мнению P. Monagle и соавт. [6], составляет 5 : 100 тыс. новорожденных, старше
6 месяцев – 1,9 : 100 тыс. детей в год. Соотношение частоты венозных и артериальных тромбозов
у детей составляет 2 : 1 [6]. Венозные тромбозы чаще развиваются у детей старше 3 месяцев и у подростков. Это, возможно, связано с генетически детермированными особенностями противосвертывающей системы крови у новорожденных: более низкой концентрацией белков (антитромбина III, кофактора II, гепарина и протеина С), а также сниженной фибринолитической активностью. Как правило, тромбоз развивается при дополнительных условиях (катетеризации вен, особенно длительной, асфиксии, септицемии, врожденных пороках сердца и сосудов, ревматических, инфекционных и онкологических заболеваниях, хирургических вмешательствах, травмах и др.) [2, 8, 9]. Выяснение этих факторов риска помогает эффективно предот вращать развитие заболеваний и их
осложнений у носителей вариантных генов.
В литературе есть лишь единичные описания артериальных и внутрисердечных тромбозов у новорожденных [3, 4]. В связи с этим представляет интерес два клинических наблюдения развития
внутрисердечных тромбов у новорожденных детей в нашей клинике.
“Первое наблюдение.
Девочка Б., родилась 26.11.2008 у женщины 26 лет с неотягощенным соматическим и гинекологическим анамнезом, от первой беременности, протекавшей с угрозой прерывания в течение всей беременности. В период беременности матери неоднократно проводились ультразвуковые исследования плода, при которых патологических изменений выявлено не было. Роды оперативные, в связи с преждевременным излитием околоплодных вод и отсутствием родовой деятельности. Родилась живая доношенная девочка весом 2675 г, ростом 47 см, с оценкой по шкале Апгар 8/9 баллов. Состояние ребенка при рождении было удовлетворительным, однако на 4-е сут жизни отмечено ухудшение состояния за счет развития дыхательных нарушений (брадипноэ, ослабленное дыхание), выраженных микроциркуляторных нарушений (периоральный цианоз, акроцианоз, «мраморный» рисунок кожных покровов), гемодинамических нарушений (брадикардия, приглушение сердечных тонов), а также угнетения функций ЦНС (гипорефлексия, гиподинамия, мышечная гипотония). Кроме того, отмечены симптомы желудочного кровотечения (содержимое желудка при срыгивании и кал имели темный цвет).
На 4-е сут жизни в момент ухудшения состояния были выявлены признаки нарушения циркуляции в бассейне правой бедренной артерии (усиленный сосудистый рисунок правой нижней конечности, прохладная на ощупь правая стопа, пальпаторно пульсация на бедренной артерии ослаблена). Следует отметить, что указанные нарушения не были связаны с манипуляциями на периферических сосудах (катетеризация периферических и центральных вен не проводилась).
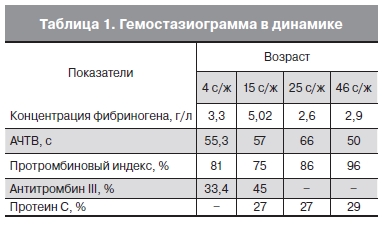
В клиническом анализе крови отмечено снижение количества тромбоцитов до 113×109/л. В коагулограмме выявлено активированное частичное тромбопластиновое время (АЧТВ) – 55,3 с при норме у взрослых, равной 20–40 с, активность антитромбина III – 37% (при норме у взрослых 75–125%), активность протеина С – 27% (при норме у взрослых 70–140%). При рентгенографии грудной клетки наблюдали усиление прикорневого бронхо-сосудистого рисунка справа (врожденная пневмония). При эхокардиографии в полости левого предсердия обнаружено объемное образование размером 8,9×7,6 мм, фиксированное к задней створке митрального клапана. Замыкательная функция митрального клапана не нарушена (рис. 1, см. на вклейке).
При ультразвуковом исследовании дифференциальный диагноз проведен с миксомой левого предсердия.
При генетическом исследовании у ребенка выявлен гетерозиготный полиморфизм генов метилентетрагидрофолатредуктазы (MTHFR: 677 C>T) и ингибитора активатора плазминогена I типа
(SERPINE1 (PAI-1). В связи с выявленными полиморфизмами генов тромбофилии у ребенка были обследованы его родители. Установлено, что мать ребенка является носителем гомозиготного полиморфизма генов метилентетрагидрофолатредуктазы и ингибитора активатора плазминогена I типа, а отец – носитель гетерозиготного полиморфизма тех же генов.
С учетом анамнеза, клинических и лабораторных данных больному был уставлен диагноз «наследственная гематогенная тромбофилия: дефицит активности протеина С, гетерозиготные полиморфизмы генов метилентетрагидрофолатредуктазы (MTHFR), ингибитора активатора плазминогена I типа (PAI-1). Осложнение: тромб левого предсердия, ДВС-синдром, желудочное кровотечение. Транзиторное нарушение циркуляции в бассейне правой бедренной артерии вследствие эмболии». Сопутствующая: «врожденная пневмония».
После выявления тромба в левом предсердии (при эхокардиографии) ребенку была назначена антитромботическая терапия гепарином. В течение одной недели гепарин (прямой антикоагулянт)
вводили внутривенно капельно в течение 24 ч в дозе 100 ЕД/кг, в последующие 16 дней гепарин
вводили в дозе 200 ЕД/кг под контролем АЧТВ. Достигнуто АЧТВ 50 с. С 14-х сут жизни начато
лечение антитромбином III по схеме: два последовательных дня через три в/в струйно первое введение в дозе 250 МЕ/кг, на следующий день – 150 МЕ/кг. С учетом длительности проведения
антикоагулянтной терапии по рекомендации гематолога с 29-х сут жизни ребенок был переведен на терапию низкомолекулярным гепарином (фрагмином) в дозе 100 ЕД/кг 2 раза в сут подкожно под
контролем антифактора Ха активности (терапевтические значения антифактора Ха активности –
0,5–1,0 Е/мл). Всего проведено 5 курсов лечения (10 инъекций) антитромбином III (антитромбин
III человеческий), из них 16 дней – на фоне подкожного введения низкомолекулярного гепарина
в терапевтических дозах. Была назначена также антибактериальная терапия в течение 21 дня (аугментин из расчета 30 мг/кг х 2 раза в сут внутривенно в течение 6 дней, ванкомицин из расчета
10 мг/кг 2 раза в сут внутривенно – 11 дней, нетромицин из расчета 6 мг/кг один раз в сут внутривенно – 18 дней), введены внутривенно препараты иммуноглобулинов № 2 (иммуноглобулин человеческий нормальный), четырехкратно проведена трансфузия свежезамороженной плазмы.
В результате лечения состояние ребенка постепенно улучшалось: желудочное кровотечение купировано в течение сут, в течение 2 сут исчезли симптомы нарушения микроциркуляции. С 18-х
сут жизни ребенок стал более активным, постепенно уменьшались симптомы угнетения функций ЦНС: повысился уровень церебральной и двигательной активности.
На протяжении всего периода пребывания ребенка в стационаре сохранялись низкая активность
АТ-III, протеина С, как представлено в табл. 1.
По данным ультразвукового исследования сердца, размеры тромба постепенно уменьшались и к
46-м сут жизни образование в полости левого предсердия перестало определяться.
Ребенок был выписан домой на 47-е сут жизни в удовлетворительном состоянии с рекомендациями по продолжению терапии фрагмином и наблюдению у гематолога. При наблюдении в катамнезе
в возрасте 1 года 6 месяцев состояние ребенка удовлетворительное, психомоторное развитие соответствует возрасту. Рецидива тромбозов не наблюдалось, в возрасте 6 месяцев закончен курс антитромботической и антикоагулянтной терапии.
Второе наблюдение
Мальчик Б. родился 06.01.2009. Ребенок у соматически здоровой 24-летней женщины. Беременность вторая, протекавшая на фоне угрозы прерывания во II триместре. В период беременности матери неоднократно проводились ультразвуковые исследования плода, при которых патологических изменений выявлено не было. Отслойка плаценты на 33-й нед беременности послужила показанием к преждевременному родоразрешению путем операции кесарева сечения. Недоношенный мальчик родился с массой тела 1874 г, длиной 43 см и оценкой по шкале Апгар 7/8 баллов.
Состояние ребенка после рождения было тяжелым за счет развития респираторного дистресссиндрома. У ребенка отмечены микроциркуляторные нарушения в виде «мраморности» кожных покровов, акроцианоза конечностей, цианоза носогубного треугольника, а также дыхательные нарушения (тахипноэ до 70 дыханий в мин, смешанная одышка, аускультативно – ослабленное дыхание). С рождения начата искусственная вентиляция легких, которая продолжалась четверо сут, затем респираторная поддержка методом СДППД (самостоятельное дыхание под постоянным положительным давлением) в течение трех сут. При рентгенологическом исследовании выявлена правосторонняя пневмония. В неврологическом статусе отмечено выраженное угнетение функций ЦНС. Со стороны сердечно-сосудистой системы патологии не выявлено. В клиническом анализе крови отмечали анемию, лейкоцитоз.
Ребенку провели антибактериальную терапию (аугментин из расчета 30 мг/кг 2 раза в сут внутривенно в течение 7 дней, нетромицин из расчета 6 мг/кг 1 раз в сут внутривенно – 11 дней, ванкоцин из расчета 10 мг/кг х 2 раза в сут внутривенно – 12 дней), иммунозаместительная терапия
(иммуноглобулин человеческий нормальный № 3). На фоне проводимой терапии состояние ребенка
несколько улучшилось: дыхательные нарушения исчезли к 12 сут жизни, уменьшились микроциркуляторные нарушения, в неврологическом статусе отмечена положительная динамика – увеличился уровень церебральной активности. В возрасте 1 мес плановое ультразвуковое исследование сердца показало, что в полости правого предсердия обнаружено эхо-позитивное образование диаметром 4,5 мм, связанное с клапаном овального окна и движущееся синхронно со структурами сердца (рис. 2, см. на вклейке). Дифференциальный диагноз проведен с миксомой правого предсердия.
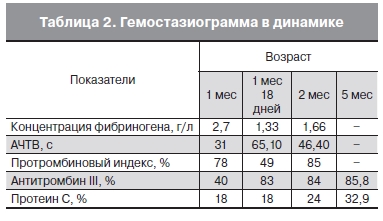
С учетом признаков тромбоза проведено молекулярно-генетическое обследование. У ребенка выявлен гомозиготный полиморфизм гена ингибитора активатора плазминогена I типа. При обследовании родителей ребенка было обнаружено, что мать и отец являются носителями гетерозиготной мутации гена PAI-I типа, а также у ребенка выявлены протромботические полиморфизмы системы гемостаза (табл. 2).
С учетом анамнеза, клинических и лабораторных данных ребенку установлен диагноз: «наследственная гематогенная тромбофилия: дефицит активности протеина С, гомозиготный полиморфизм гена ингибитора активатора плазминогена I типа (PAI-1)». Осложнение: тромб правого предсердия. Сопутствующие: неонатальная пневмония. Состояние после РДС.
Ребенку проведена антитромботическая терапия с 37-х сут жизни. Начат курс лечения АТ-III по схеме: 2 последовательных дня через 3 в дозе 300 МЕ/кг в/в струйно первое введение и 200 МЕ/кг на следующий день под контролем активности антитромбина. Одновременно с антитромбином больному ввели низкомолекулярный гепарин – фрагмин в дозе 250 МЕ/кг 2 раза в сут подкожно под контролем антифактора Xа активности (терапевтические значения – 0,5–1,0 Е/мл). На фоне терапии АT — III и низкомолекулярным гепарином тромб стал уменьшаться. На протяжении всего периода пребывания ребенка в отделении в гемостазе сохранялось снижение антитромбина III, протеина С. К концу 2-го мес жизни тромб в правом предсердии уменьшился до 0,2 см. Ребенок был выписан домой в возрасте 2 мес в удовлетворительном состоянии с рекомендациями по продолжению терапии фрагмином в дозе 100 ЕД/кг 2 раза в день подкожно и наблюдения у гематолога.
При осмотре в 3 мес состояние ребенка удовлетворительное, развитие соответствует возрастной
норме. По данным эхокардиографии тромб в правом предсердии не определялся (рис. 3, см. на вклейке).
Ребенку с 3- до 6-месячного возраста профилактически вводили низкомолекулярный гепарин. С учетом низкого содержания протеина С мальчик до года получал антитромботическую терапию препаратом
Вессел Дуэ Ф. Рецидива тромбозов не было.
Выводы
1. Проведенные наблюдения показали, что определение комплексов протромботических факторов и молекулярно-генетическое обследование рекомендуются каждому ребенку с тромботическими нарушениями.
2. У обоих детей при молекулярно-генетическом анализе выявлены множественные протромботические полиморфизмы.
3. Низкая активность естественных антикоагулянтов (антитромбина III и протеина С), как было показано в наших наблюдениях, может служить причиной геморрагических осложнений, а впоследствии ‒ тромботических осложнений.
4. Проведение длительной антикоагулянтной и анти тромботической терапии привело к хорошим результатам, несмотря на относительно позднее начало (2 нед и более с момента образования тромба), т. к. новорожденные дети и дети грудного возраста отвечают на сочетанную терапию быстрее, чем взрослые.
5. Длительная (в течение 6 месяцев) терапия низкомолекулярным гепарином не вызвала осложнений у детей 1 года жизни.



