Проблема репродуктивных потерь и невынашивания беременности находится в центре внимания современной науки о репродукции человека и является одной из наиболее актуальных в акушерстве и гинекологии [1–4].
Несмотря на достигнутые в последние годы успехи в профилактике и лечении данной патологии, частота самопроизвольных выкидышей по данным различных авторов остается стабильной и достаточно высокой и составляет 10–25% всех диагностированных беременностей [5, 6].
Привычное невынашивание беременности (ПНБ) имеет мультифакторный характер [7–9]. Прослеживается выраженная тенденция к смене доминирующих факторов. Ранее в генезе ПНБ преобладали генетические, анатомические и гормональные нарушения, гемостазиологические причины. В настоящее время акценты сместились в сторону инфекционных и иммунологических факторов [6, 7, 10].
Иммунологические причины ранних потерь беременности обусловлены несколькими нарушениями. Одним из таких иммунологических факторов является возрастающий уровень γ-интерферона в сыворотке, что может нарушать нормальный процесс плацентации, ограничивая инвазию трофобласта и оказывая на эмбрион прямое токсическое действие. Также отмечается высокий уровень провоспалительных цитокинов (IL-1, IL-6, IL-8, TNF-α и др.) в периферической крови, что может приводить к нарушению развития хориона и отторжению плодного яйца [3, 4, 8, 10].
Установлено, что одно из ведущих мест в генезе ПНБ помимо иммунологических факторов занимают бактериальные и вирусные инфекции, бессимптомная персистенция которых в организме женщины вызывает поражение эндометрия с развитием хронического эндометрита, ведущего к прерыванию беременности [3, 8]. Доказана этиологическая роль герпесвирусной инфекции, в частности, вируса простого герпеса 2-го типа (ВПГ-2) и цитомегаловируса (ЦМВ) в патологии и ПНБ [2, 11, 12]. В 61% случаев у пациенток с ПНБ обнаруживается вирусная инфекция, при этом доля герпесвирусной инфекции составляет до 75% [13].
На протяжении последних десятилетий был предложен большой арсенал медикаментозных средств и методов лечения ПНБ вирусного генеза. Но несмотря на многообразие существующих методик, процент заболеваемости герпесвирусной инфекцией (ВПГ-2 и ЦМВ) у женщин с ПНБ имеет тенденцию к увеличению, поэтому проблема в целом остается не разрешенной. Необходим поиск альтернативных методов лечения рассматриваемой патологии [14].
В настоящее время во всем мире в клинической практике интенсивно развивается новая медицинская технология – фотодинамическая терапия (ФДТ). Данный метод основан на использовании фотодинамического повреждения клеток в ходе фотохимических реакций. Один из частных методов ФДТ – фотосенсибилизированное лазерное облучение крови. Метод заключается во введении в организм раствора фотосенсибилизатора (биохимически инертного в темноте вещества), который под действием лазерного облучения приводит к образованию активных форм кислорода (АФК) (синглетный кислород, пероксиды и др.) [15]. При фотодинамической терапии АФК обладают цитотоксическим действием [15]. Механизмы, лежащие в основе ФДТ, являются предметом многочисленных исследований и до конца не изучены [14].
В механизме ФДТ можно выделить четыре этапа: введение в организм фотосенсибилизатора, последующую фотодинамическую реакцию, развивающуюся во время лазерного воздействия, фотодинамический процесс и отдаленные реакции, сопровождающиеся цитотоксическим эффектом [16].
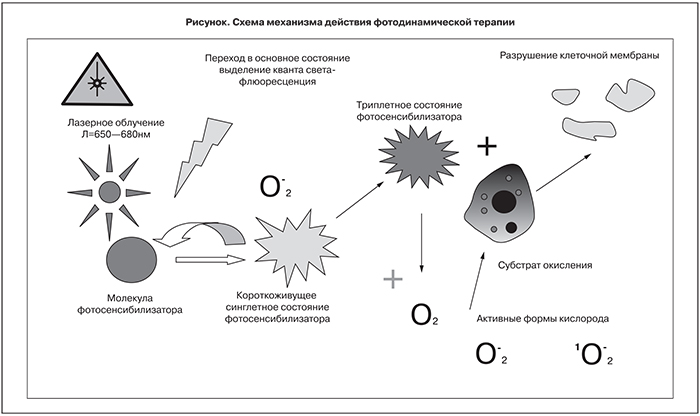
При поглощении кванта света после лазерного воздействия молекула фотосенсибилизатора (ФС) переходит из основного состояния в возбужденное синглетное состояние. Дезактивация возбужденного синглетного состояния может происходить различными путями: ФС может вернуться в основное состояние, либо перейти в долгоживущее возбужденное триплетное состояние. Далее существуют два пути развития событий. Первый путь включает фотохимические реакции, при которых возбужденная молекула ФС реагирует с субстратами окисления. Второй путь включает процессы, в которых первичным является взаимодействие возбужденной молекулы ФС с кислородом. В возбужденном триплетном состоянии молекула ФС может передать энергию на молекулярный кислород, растворенный в тканях. В результате такого переноса образуется синглетный молекулярный кислород, который является сильным окислителем, вступающим в реакцию с различными биологическими молекулами, окисляя их с образованием свободных радикалов и перекисей (рисунок).
В результате этих процессов активируется каскад фотодинамических повреждений мембран, приводящих в результате к гибели клеток [17]. После передачи энергии возбуждения молекулярному кислороду молекула ФС возвращается в стабильное состояние.
В дополнение к прямому повреждению мембран и других клеточных структур свободными радикалами происходит выработка цитокинов (IL-6, IL-2, ФНО-α, ГКСФ и др.). Они запускают процессы, ответственные за развитие цитотоксического эффекта. Иммунная система реагирует на ФДТ. Воспалительный процесс при ФДТ может послужить инициатором формирования эффективного иммунитета, в том числе и противовирусного [18].
Несмотря на известные факты о механизмах ФДТ, в настоящее время остается много вопросов, до конца не решенных. В понимании механизмов действия ФДТ важную роль играет ряд факторов: доза препарата фотосенсибилизатора, способ его введения, временной интервал между введением фотосенсибилизатора и лазерным облучением. Но несмотря на ряд открытых вопросов, ФДТ применяется рутинно в повседневной практике с высокой эффективностью в различных областях медицины [19].
Данная методика нашла широкое применение в лечении как онкологических, так и других заболеваний, для которых характерны гиперпролиферация тканей и/или неоваскуляризация, например, при хориоидальной неоваскуляризации, атеросклерозе аорты и крупных артерий, ревматоидном артрите, псориазе, доброкачественной гиперплазии предстательной железы, длительно не заживающих гнойных ранах и трофических язвах сосудистой этиологии, дисплазии эпителия шейки матки (CIN) и вульвы, остроконечных кондиломах и др. [14, 20–24]. Проводились работы по фотодинамической терапии опухолей и фотосенсибилизированному лазерному облучению крови у пациентов с диссеминированными опухолевыми процессами, оценке состояния иммунной системы на фоне лечения [15, 25–27].
М.Л. Гельфонд показал эффективность сенсибилизированной фотомодификации крови при распространенных злокачественных новообразованиях различной локализации (рак легких, рак желудка, рак толстой кишки). Был получен положительный клинический эффект (стойкая клиническая ремиссия) и полный регресс метастатических образований у пациентки с метастазами рака молочной железы в головной мозг, легкие, лимфатические узлы средостения [15]. Неоднократно была показана эффективность ФДТ и повышение процента случаев выздоровления.
Н.В. Кудинова представила механизм иммунной реакции в ответ на ФДТ опухолей. Показано, что ФДТ оказывает цитотоксическое действие на опухолевые клетки, вызывая их гибель путем некроза и апоптоза. Апоптозные и некрозные клетки экспрессируют белок теплового шока (HSP70). Опухолевый антиген захватывается незрелыми дендритными клетками фагоцитозом или в комплексе с HSP70, далее происходит созревание дендритных клеток. Зрелые дендритные клетки мигрируют в лимфатические узлы, где представляют антиген Т-лимфоцитам. Под действием цитокинов происходит дифференцировка цитотоксических Т-лимфоцитов, которые впоследствии уничтожают клетки опухоли. Под действием ФДТ происходит разрушение эндотелиальных клеток в ткани опухоли, что приводит к вазоконстрикции/дилатации, агрегации тромбоцитов, освобождению тромбоксана интерлейкинов (IL-1β, IL-6, IL-8, TNF-α) и инфильтрации опухоли нейтрофилами, моноцитами и другими клетками [25, 27, 28].
В настоящее время все более активно рассматривается возможность применения ФДТ не только в онкологии, но и в других областях медицины. Такие идеи появились после того, как в литературе были опубликованы сообщения о фотодинамической инактивации микроорганизмов [14]. Первой публикацией о возможности фотоинактивации возбудителей инфекционных заболеваний и одновременно первым достоверным сообщением о зарегистрированном фотодинамическом эффекте стало сообщение о влиянии солнечного света на микроорганизмы (простейшие) с использованием в качестве фотосенсибилизатора акридинового красителя для их фотодинамической инактивации и солнечного света в качестве источника энергии [29]. Данный факт послужил толчком к развитию антимикробной фотодинамической терапии. Z. Malik и соавт. в 1900 г. сообщили о бактерицидном действии ФДТ на грамотрицательные бактерии и дрожжевые грибы [30]. В экспериментах была показана эффективность метода антимикробной фотодинамической терапии, что в дальнейшем также было неоднократно подтверждено в клинических исследованиях в различных областях медицины [14, 31, 32].
Позднее эффективность ФДТ при вирусной инфекции экспериментально была показана многими учеными. Очередным шагом вперед было изучение метода ФДТ в терапии вирусной инфекции [33]. Предпосылкой к проведению научных работ в этом направлении стал факт фотодинамической инактивации вирусных частиц. Такая информация была опубликована в литературе еще в 1928 г. Но это предположение не получило научных обоснований по причине отсутствия на тот момент времени современного лабораторного оснащения для проведения экспериментальных работ.
В литературе упоминается о медленном развитии исследований по этой теме, так как часто публиковались данные о случаях побочных эффектов ФДТ, что также тормозило исследовательский процесс в этой области. Поэтому, несмотря на то что фотодинамический противовирусный эффект был показан в начале прошлого века, исследования по этому вопросу не предпринимались до 1970 г. [34].
Только после 70-х годов XX столетия появились реальные научные работы, так как пути решения данного вопроса стали возможными ввиду совершенствования как оптоволоконной техники и лазерных технологий, так и химического производства по разработке и создания новых фотосенсибилизаторов.
Помимо бактерицидного действия ФДТ изучалось действие на вирусы. Накоплен материал доклинических исследований: F. Kasermann и C. Kempf показали противовирусное действие на вирус лихорадки Денге, вирус японского энцефалита [35]; A.C. Moor и A.E. Wagenaars-van-Gompel – на вирус везикулярного стоматита [36]; H. Yin и соавт. сообщили об инактивации вируса иммунодефицита человека [37]. Убедительно доказан стерилизующий эффект ФДТ при обработке крови и ее компонентов, инфицированных ВИЧ и вирусом кошачьей лейкемии [38, 39].
Группа исследователей под руководством С.В. Фиалкиной продемонстрировали влияние лазерного облучения без использования ФС на репликацию клебсиеллезного бактериофага. Было выявлено, что облучение вирулентного фага приводило к 1000-кратному снижению количества вирионов в тест – культуре K. pneumoniae 296 [40].
С 2004 по 2006 г. в Институте лазерной физики РАН выполнялась работа, основной целью которой была разработка методик инактивации оболочечных вирусов при помощи нерастворимых в воде фотосенсибилизаторов на основе фуллеренов. Было показано, что соединения фуллеренов обладают мембранотропными эффектами в проявлении противовирусной активности и практически полностью подавляют репликацию оболочечных вирусов. Механизм противовирусного действия фуллеренов связан с их влиянием на оболочку вирусов. При исследовании действия этих соединений на оболочечные вирусы Dengue-2 (сем. Togaviridae, род Flavivirus) вируса лихорадки Денге, вируса японского энцефалита и двух безоболочечных вирусов: энтеровируса 71 и вируса коксаки В3 (сем. Picornaviridae, род Enterovirus), было обнаружено, что фуллерены эффективно ингибируют только оболочечных вирусы и не активны в отношении безоболочечных вирусов, что подтверждает вывод о связывании фуллеренов с липидной оболочкой вируса для его последующей инактивации [41].
Установлено, что фуллерены действуют на репродукцию вирусов, при этом не наблюдается ингибирования синтеза вирусных белков. При воздействии фуллеренов (на основе комплекса С60/ПВП) с помощью электронной микроскопии было выявлено много дефектных вирионов и повреждений в вирусных оболочках. Анализируя результаты, можно заключить, что главная мишень противовирусного действия – последняя стадия цикла репликации оболочечных вирусов [42].
В зарубежной литературе имеются данные о том, что фотосенсибилизатор на основе фуллеренов C60 в виде водорастворимого комплекса с поливинилпирролидоном (ПВП) в дозах от 250 до 1000 мкг/мл способен ингибировать репродукцию вирусов гриппа А/Виктория 35/72(Н3N2), не проявляя при этом цитотоксического и генотоксического эффектов. В высоких дозах эффективность комплекса на основе С60/ПВП была сравнима с действием ремантадина [43].
А.А. Мак и соавт. показали противовирусное фотодинамическое воздействие углеродного фотосенсибилизатора астралена на вирус гриппа A/PR/8/34 (H1N1). Отмечено изменение морфологии вирусных частиц, что проявлялось в появлении дефектов вирусной оболочки и разрушения поверхностных гликопротеидов. Дефектные вирионы были не способны к полноценной репликации [44].
J.N. Tao и соавт. проводили другие экспериментальные исследования по фотодинамической инактивации ВПГ на in vivo моделях герпесвирусной инфекции ВПГ-1 и ВПГ-2, полученных от морских свинок. В экспериментах при использовании фотосенсибилизатора 5-аминолевуленовой кислоты (5-АЛК) был получен противогерпетический эффект, сопоставимый с эффектом ацикловира [45].
З.Б. Квачевой и соавт. также проводились экспериментальные работы по фотодинамическому ингибированию герпесвирусной инфекции с использованием в качестве ФС порфиринов, индуцируемых 5-АЛК. Установлена повышенная способность клеток-мишеней накапливать индуцируемые 5-АЛК эндогенные порфирины, что обусловило избирательность их фотоповреждения. Получены вирусингибирующие эффекты ВПГ-1 [46]. Таким образом, было показано противогерпетическое действие порфиринов.
В настоящее время, учитывая актуальность проблемы роста заболеваемости вирусными инфекциями, в частности герпесвирусной инфекцией, ее доказанную связь с ПНБ, установлена возможность фотодинамической инактивации оболочечных вирусов [37, 47]. В литературе также имеются данные об экспериментальных и клинических испытаниях способности ФДТ инактивировать вирусы, такие как папилломавирус, вирус гепатита С и вирус иммунодефицита человека (ВИЧ) [20, 38, 48].
Факт о наличии противовирусного фотодинамического эффекта способствует углублению научных исследований в этом направлении и создает предпосылки для расширения клинического использования этой методики в различных отраслях медицины.
Изучение противогерпетического эффекта ФДТ представляет собой значительный интерес, в том числе и в качестве терапии герпесвирусной инфекции как важной проблеме для пациенток с ПНБ в анамнезе (учитывая высокий процент заболеваемости, как правило, пожизненное течение и отсутствие специфического лечения).
На основании анализа вышеперечисленных данных литературы и актуальности проблемы привычного невынашивания беременности, ассоциированной с герпесвирусной инфекцией, нами проводятся работы по фотодинамической терапии пациенток с герпесвирусной инфекцией и ПНБ в анамнезе. Изучение иммунологических реакций, развивающихся при проведении ФДТ, может активировать механизм противовирусной защиты организма.
Таким образом, обобщая приведенные литературные данные, необходимо дальнейшее изучение действия ФДТ на механизмы врожденного и адаптивного иммунитета. Возможно, решение этого вопроса будет достигнуто в ближайшее время.



