Привычное невынашивание беременности определяется, как две или более самопроизвольных потерь беременности до 20–22 недель гестации, и затрагивает приблизительно 5% всех пар [1]. Современные методы диагностики могут установить причины невынашивания приблизительно у половины этих пар [2–4]. В настоящее время неоднократные потери беременности в анамнезе часто сочетаются с невозможностью достичь самостоятельной беременности, то есть с бесплодием. Вследствие этого возникает необходимость в проведении вспомогательных репродуктивных технологий (ВРТ), однако тактика проведения ВРТ у данной категории пациенток окончательно не определена.
С целью профилактики возможных генетических причин потерь беременности у пациенток с привычным выкидышем было предложено перед переносом эмбриона проводить преимплантационный генетический скрининг (ПГС). Сторонники применения ПГС считают, что часто невынашивание беременности сопровождается повышенным риском анеуплоидии эмбрионов [5]. В большинстве работ признается, что использование ПГС снижает вероятность последующих потерь беременности [6]. Однако, на сегодняшний день основным методом при проведении циклов экстракорпорального оплодотворения (ЭКО) остается отбор эмбрионов только на основании их морфологической оценки, несмотря на субъективность этой визуальной методики и ее низкую специфичность и чувствительность [7]. Опубликовано большое количество работ, посвященных исследованию эффективности ПГС у пациенток групп высокого риска, но в настоящее время в медицинском сообществе ведется серьезная дискуссия по поводу применения этого метода в клинической практике [8–11]. Большинство исследователей сходятся во мнении, что необходимы дальнейшие исследования для создания достаточной доказательной базы, свидетельствующей об увеличении уровня живорождения при применении ПГС. Актуальность данной работы обусловлена необходимостью поиска способов повышения эффективности ВРТ у женщин с привычным невынашиванием беременности и бесплодием.
Целью исследования было изучение эффективности применения ПГС в исходах программ ВРТ у пациенток с привычным невынашиванием беременности и бесплодием.
Материал и методы исследования
В проспективное когортное исследование были включены 196 супружеских пар, обратившихся для лечения бесплодия с помощью ВРТ в период с 2015 по 2017 гг., с отсутствием противопоказаний к проведению ЭКО и подписанным информированным согласием на участие в исследовании. Критериями включения явились: нормальный кариотип обоих супругов, а также наличие привычного невынашивания беременности (2 и более потери беременности в анамнезе) [12]. Критериями исключения явилось использование донорских гамет или суррогатного материнства, а также развитие осложнений ЭКО в изучаемом цикле.
Пациенты были стратифицированы на две группы: группу 1 составили 96 пациенток, которым была проведена программа ЭКО с ПГС. Группу 2 составили 100 пациенток, которым была проведена программа ЭКО без ПГС.
Перед включением в протокол ЭКО все женщины были обследованы согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и показаниях к их применению» [13].
Стимуляция функции яичников проводилась с применением рекомбинантного фолликулостимулирующего гормона (рФСГ) или комбинированного препарата рФСГ и лютеинизирующего гормона (ЛГ) и назначением антагонистов гонадотропин рилизинг-гормона (ГнРГ). Триггер овуляции вводился при наличии лидирующих фолликулов диаметром 17 мм и более. В качестве триггера использовали препарат агониста ГнРГ в дозе 0,2 мг. Трансвагинальная пункция яичников осуществлялась через 36 часов после введения триггера овуляции. Оплодотворение ооцитов у всех пациенток осуществлялось методом интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ).
Морфологическую оценку эмбрионов проводили на 3-и и 5-е сутки после забора ооцитов согласно классификации Gardner и соавт. [14]. Пациенткам в группе 1 биопсию клеток трофэктодермы бластоцисты проводили на 5–6-й день культивирования эмбрионов in vitro. Хетчинг эмбриона, предшествующий биопсии, проводили на 4–5-й день культивирования эмбрионов с использованием лазерной пушки. Забор клеток с использованием микроманипулятора и подготовку клеток для сравнительной геномной гибридизации (англ. – comparative genomic hybridization, аCGH) проводили согласно принятым в рутинной практике методикам. Процедура ПГС методом аCGH проводилась с использованием оборудования фирмы Agilent (США). Полногеномную амплификацию ДНК исследуемых бластомеров проводили с помощью набора PicoPlex SingleCell WGA Kit (Rubicon Genomics, США). Качество и количество полученной в ходе амплификации ДНК контролировали с помощью 1,2% агарозного электрофореза. Мечение ампликонов проводили с помощью набора SurePrint G3 8х60K (Aglient, США), гибридизовали 16 часов, после чего проводили отмывку и сканирование на сканере биологических чипов SureScan Microarray Scanner. Интерпретацию полученных результатов проводили с помощью программного продукта Agilent CytoGenomics.
Все бластоцисты хорошего качества подвергались криоконсервации у пациенток в обеих группах, во всех случаях перенос эмбрионов осуществляли в «криоциклах».
Подготовка эндометрия для переноса криоконсервированных эмбрионов проводилась с использованием заместительной гормональной терапии (эстрадиола валерат в дозе 8 мг/сутки с 4–5-го дня менструального цикла, микронизированный прогестерон 400–600 мг/сутки с 15–16-го дня менструального цикла). Мониторинг эндометрия осуществлялся с использованием динамического ультразвукового исследования. Перенос эмбрионов осуществляли на 20–21-й день цикла, размораживание эмбрионов осуществляли согласно принятым в клинической практике протоколам.
При наличии подъема уровня сывороточного хорионического гонадотропина через 14 дней после переноса эмбрионов в полость матки регистрировали биохимическую беременность, а при ультразвуковой визуализации плодного яйца в полости матки через 21 день после переноса эмбрионов – клиническую беременность.
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, t-теста для сравнения средних величин. Мерой ассоциации для сравнения бинарных данных было отношение шансов (ОШ). Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. акад. В.И. Кулакова Минздрава России.
Результаты исследования
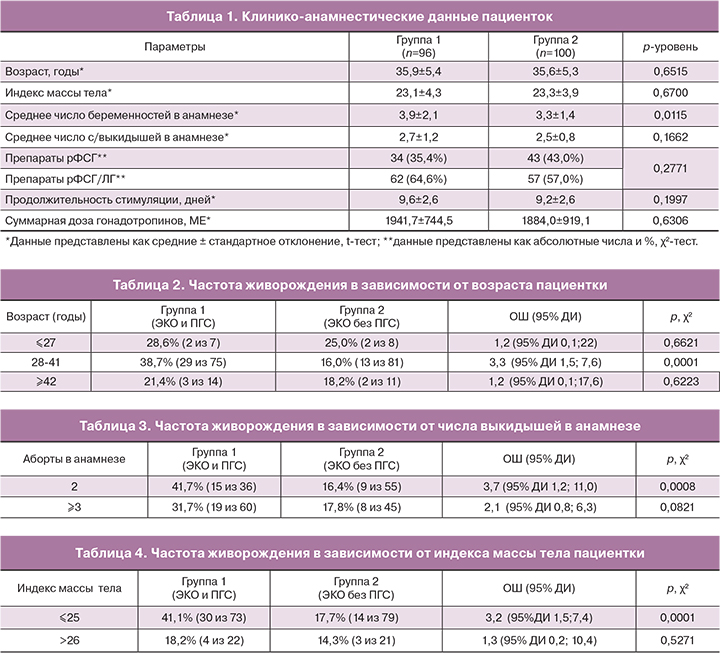
Средний возраст и средний индекс массы тела пациенток не различались в группах сравнения (р>0,05). Между группами не было различий по менструальной функции, гинекологической и соматической заболеваемости. Среднее число потерь беременности в анамнезе также не различалось между группами. При оценке особенностей стимуляции суперовуляции в группах сравнения не отмечено различий в суммарной дозе гонадотропинов, длительности стимуляции, а также типе препаратов для стимуляции (табл. 1).
В группе 1 было получено 718 зрелых ооцитов (в среднем 7,5±4,7 на 1 пациентку), в группе 2 получено 563 ооцита (в среднем (5,6±3,7 на 1 пациентку) (р=0,0023). Все ооциты были оплодотворены методом ИКСИ, частота оплодотворения не различалась между группами. Несмотря на то, что среднее число бластоцист было выше в группе 1 (4,2±3,0 на 1 пациентку по сравнению с 3,2±2,6 в группе 2, р=0,0165), среднее число бластоцист отличного качества не различалось в группах сравнения – 1,9±2,0 и 1,7±2,0 в группах 1 и 2 соответственно (р=0,4380).
Клиническая беременность наступила у 44 из 96 пациенток в группе 1 (45,8%) и у 29 из 100 пациенток в группе 2 (29,0%) (р=0,0148). Было диагностировано 10 потерь беременности в группе 1 и 12 потерь беременности в группе 2 (22,7% от числа беременностей и 41,4% соответственно, р=0,0765). Роды произошли у 34 пациенток (35,4%) в группе 1 и у 17 пациенток (17,0%) в группе 2 (р=0,0031). ОШ живорождения при проведении ПГС у пациенток с привычным выкидышем составило 2,7 (95% ДИ 1,3; 5,6).
На втором этапе исследования провели оценку эффективности ЭКО+ПГС в зависимости от клинических характеристик пациенток. На эффективность ЭКО+ПГС влияли возраст пациентки, индекс массы тела и количество прерываний беременности в анамнезе (количество абортов + количество самопроизвольных выкидышей). Было выявлено два пороговых возраста эффективности ЭКО+ПГС у пациенток с привычным невынашиванием, которые составили 28 лет и 41 год (табл. 2). Пороговое число прерываний беременности в анамнезе составило 2 (табл. 3). Порог индекса массы тела по влиянию на эффективность ПГС составил 25 кг/м2 (табл. 4). Следует отметить, что у женщин в подгруппе старше 42 лет 80% пациенток имели 3 и более прерывания беременности в анамнезе (по сравнению с 50,1 и 40,0% в других возрастных подгруппах, р=0,0130).
Обсуждение
В проведенном исследовании установлено существенное увеличение частоты клинической беременности при применении ПГС (45,8% против 29,0%). Данные, опубликованные W.B. Schoolcraft [15] также свидетельствуют о значительном повышении имплантации после проведения хромосомного анализа бластоцист у женщин из группы высокого риска. Аналогичные результаты в 2012 г. получил B. Hodes-Wertz и соавт. [16], исследовав влияние ПГС на частоту выкидышей у пациенток с привычным невынашиванием. В его исследовании частота имплантации составила 56,4%. Эти данные подтверждают роль анеуплоидии в этиологии привычного невынашивания беременности. По мнению К. Marquard и соавт. [17] хромосомный анализ мог бы объяснить 80% идиопатического привычного невынашивания беременности у женщин старше 35 лет.
Частота своевременных родов при применении ПГС в нашем исследовании также была выше (35,4 против 17,0%). Аналогичные результаты были получены в одном из недавних рандомизированных исследований [18], продемонстрировавших увеличение частоты живорождения у пациенток позднего репродуктивного возраста после применения ПГС. В другом ретроспективном исследовании у пациенток с привычным невынашиванием также было выявлено повышение рождаемости на 18,6% после применения ПГС [19]. Высокий уровень живорождения (92,1%) был продемонстрирован и в работе B. Hodes-Wertz [16]. В ретроспективном когортном исследовании G. Murugappan и соавт. [20] был проведен анализ результатов лечения женщин с рецидивирующими выкидышами, который дал обнадеживающие результаты. Частота наступления беременности у пациенток в группе ЭКО c ПГС составила 71 против 50% в группе с выжидательной тактикой ведения. Частота живорождения в первой группе также была существенно выше: 51 против 36%.
Нами было выявлено существенное снижение частоты невынашивания беременности при применении ПГС (22,7% против 41,4%), что согласуется с большинством исследований, оценивавших процент выкидышей после проведения этой процедуры [6]. В 2011 г. A.M. Musters и соавт. [21], проведя анализ опубликованных данных и суммировав полученные результаты, также установили, что риск привычного невынашивания при использовании ПГС значительно снижается (9 против 28%).
Результаты нашего исследования по оценке эффективности ПГС в зависимости от клинических характеристик пациенток дают повод для размышлений. Выявлено два пороговых возраста: у женщин моложе 28 лет и старше 42 лет эффективность ПГС снижается. Данное обстоятельство вполне логично для женщин младшего репродуктивного возраста. На высокий уровень живорождения в этой возрастной группе без использования ПГС указывают многие авторы [22]. Наши данные позволяют сделать предположение о предпочтительности выбора в этом случае рутинного ЭКО.
В нашем исследовании также не было выявлено статистически значимых преимуществ от применения ПГС у пациенток старше 42 лет. К аналогичному выводу пришла и группа J.M. Franasiak [23]. Дополнительной причиной снижения эффективности ПГС у пациенток позднего репродуктивного возраста может быть и наличие у них маточного фактора бесплодия [24], что подтверждается на дальнейших этапах нашего исследования.
Нами установлена взаимосвязь между количеством прерываний беременности в анамнезе и частотой живорождения. Под количеством прерываний беременности в анамнезе принимали суммарное число самопроизвольных потерь беременности и медицинских абортов. Пороговое число прерываний беременности в анамнезе составило 2. Эффективность ПГС в этом случае составила 41,7%. С увеличением количества прерываний беременности в анамнезе до 3 и более, эффективность проведения ПГС снижалась и составила 31,7%, что частично объясняется возрастом пациенток: 80% женщин старше 42 лет имели 3 и более прерывания беременности в анамнезе. Исходя из этих данных, представляется полезным при разработке рекомендаций по использованию ПГС у женщин с привычным невынашиванием беременности учитывать количество у них предшествующих прерываний беременности.
Еще одним неблагоприятным фактором, влияющим на частоту живорождений в нашем исследовании, стали избыточная масса тела и ожирение. Пороговое значение индекса массы тела по эффективности ПГС составило 25 кг/м2. Несмотря на многочисленные исследования, демонстрирующие высокий риск анеуплоидии эмбрионов, а, следовательно, преимущества от проведения ПГС у пациенток с избыточной массы тела [25], в нашем исследовании у пациенток с индексом массы тела >26 кг/м2 проведение ПГС оказалось неэффективным. Вероятно, в снижении эффективности ПГС у данной категории пациенток играют роль другие факторы, например, метаболические нарушения в ооцитах и эмбрионах [26, 27].
Заключение
Таким образом, результаты нашего исследования свидетельствуют, что ПГС благодаря отбору эуплоидных эмбрионов приводит к увеличению частоты наступления беременности и повышению частоты живорождения у женщин с привычным невынашиванием беременности и бесплодием. Этим женщинам будет полезным рекомендовать дополнительное генетическое консультирование с целью решения вопроса о возможности проведения преимплантационного анализа эмбрионов.



