Пролактин – полипептидный гормон системного действия, относящийся к семейству пролактиноподобных белков, глобально влияющий на маммогенез, лактогенез и галактопоэз [1, 2]. На протяжении длительного периода времени существование этого гормона допускалось гипотетически, ввиду выраженного структурного сходства и близости биологических свойств с соматотропным гормоном. В 1928 году пролактин был открыт как лактогенная субстанция, присутствующая в экстракте гипофиза коров. Благодаря высокоспецифичным радиоиммунологическим методам исследования только в 1971 году удалось не только выделить гормон пролактин, но и изучить биологические, физиологические эффекты и патофизиологические особенности его секреции.
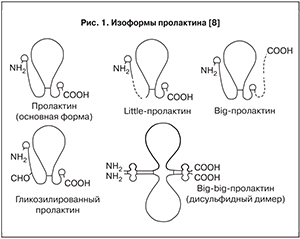 По химической структуре пролактин состоит из 199 последовательно соединенных аминокислот, объединенных тремя внутримолекулярными дисульфидными связями, и имеет молекулярную массу 23 килодальтон (кДа) [3]. Около 16% аминокислотных остатков гомологичны молекулярной структуре соматотропного гормона. На сегодняшний день известны следующие изоформы пролактина, циркулирующие в крови: мономерная (нативная) – молекулярная масса (ММ) – 22 кДа (85% общего содержания пролактина), с высокой биологической и рецепторосвязывающей активностью; «большой» (big prolactin) с ММ около 50 кДА и «большой-большой» (big-big prolactin, макропролактин) c ММ около 100 кДА, с димерной, тримерной или полимерной формой, обладающие высокой иммунореактивностью, умеренной биологической активностью и низким сродством к специфическим рецепторам; гликолизированная форма (изолированная) с ММ – около 25 кДа, с меньшей иммунореактивностью по сравнению с нативным пролактином и пролактинподобные пептиды с ММ 8 или 16 кДа, биологическая роль которых в настоящее время продолжает изучаться (рис. 1).
По химической структуре пролактин состоит из 199 последовательно соединенных аминокислот, объединенных тремя внутримолекулярными дисульфидными связями, и имеет молекулярную массу 23 килодальтон (кДа) [3]. Около 16% аминокислотных остатков гомологичны молекулярной структуре соматотропного гормона. На сегодняшний день известны следующие изоформы пролактина, циркулирующие в крови: мономерная (нативная) – молекулярная масса (ММ) – 22 кДа (85% общего содержания пролактина), с высокой биологической и рецепторосвязывающей активностью; «большой» (big prolactin) с ММ около 50 кДА и «большой-большой» (big-big prolactin, макропролактин) c ММ около 100 кДА, с димерной, тримерной или полимерной формой, обладающие высокой иммунореактивностью, умеренной биологической активностью и низким сродством к специфическим рецепторам; гликолизированная форма (изолированная) с ММ – около 25 кДа, с меньшей иммунореактивностью по сравнению с нативным пролактином и пролактинподобные пептиды с ММ 8 или 16 кДа, биологическая роль которых в настоящее время продолжает изучаться (рис. 1).
Секреция и синтез гормона осуществляются в лактотропных клетках (лактотрофы) передней доли гипофиза, составляющих около 20% всего клеточного состава аденогипофиза.
В отличие от других гормонов передней доли гипофиза, нейрорегуляция секреции пролактина находится под непосредственным (преимущественно тормозящим) гипоталамическим контролем и практически не регулируется по механизму длинной обратной связи. Ген, ответственный за синтез пролактина, расположен на 6-й хромосоме, являющейся локусом гена человеческого лейкоцитарного антигена. Через нейроэндокринные, аутокринные и паракринные механизмы гипоталамо- гипофизарная система оказывает свое влияние на секрецию пролактина. Основная роль фактора, способного снижать секрецию пролактина, принадлежит гипоталамическому нейротрансмиттеру дофамину [4]. Доказательства этого появились после открытия и изучения тубероинфундибулярной дофаминергической системы гипоталамуса, регулирующей секрецию пролактина. В настоящее время идентифицировано 5 типов дофаминовых рецепторов: D1–D5. В гипофизе преобладают преимущественно D2-рецепторы. Дофамин и его агонисты стимулируют D2-рецепторы, что приводит к подавлению активности ферментов аденилатциклазы, протеинкиназы А, снижению внутриклеточного кальция, угнетению метаболизма инозитолфосфата, что, в свою очередь, тормозит высвобождение пролактина из секреторных гранул и блокирует экспрессию гена пролактина. Это сопровождается уменьшением размеров лактотрофов и подавлением их пролиферации [5]. Доказана и способность гормона к саморегуляции посредством регулирования уровня дофамина в гипоталамусе (аутокринная регуляция по механизму короткой обратной связи). Синтезированный пролактин воздействует на рецепторы тубероинфундибулярной дофаминергической системы, что приводит к повышению продукции и высвобождению дофамина, который, в свою очередь, подавляет дальнейший синтез гормона. Помимо дофамина, пролактинингибирующее влияние в меньшей степени имеют соматостатин, γ-аминомасляная кислота, гастрин, гастрин-рилизинг гормон, гонадотропинсвязывающий белок.
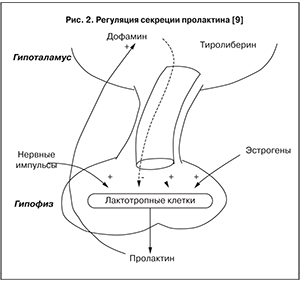
В свою очередь, стимулирующее влияние на секрецию пролактина оказывают тиреотропин-рилизинг-гормон, гонадотропин-рилизинг-гормон, меланостимулирующий гормон, окситоцин, некоторые нейротрансмиттеры и нейромодуляторы. Полагают, что к основным физиологическим стимуляторам секреции пролактина относятся эстрогены. Функциональное значение пролактинстимулирующих механизмов заключается в повышении секреторной активности лактотрофов даже на фоне дофаминергического торможения (рис. 2) [6].
Согласно имеющимся экспериментальным данным, существующий паракринный контроль секреции пролактина осуществляет α-субъединица гипофизарных гликопротеидов [7].
 Пролактин, как и многие другие гормоны, секретируется пульсирующим образом. Его содержание в сыворотке крови может повышаться не только на фоне патологических состояний, но и в связи с физиологическими процессами, происходящими в организме. Так, увеличение концентрации гормона происходит в течение сна, независимо от времени суток. После пробуждения содержание пролактина в плазме снижается и через 3–4 часа достигает наименьшего значения. Период полураспада пролактина в крови – 20–30 минут. Уровень пролактина в крови здоровых женщин репродуктивного возраста колеблется от 150–200 мМЕ/л до 650–700 мМЕ/л, причем в лютеиновую фазу содержание пролактина выше, чем в фолликулиновую [10].
Пролактин, как и многие другие гормоны, секретируется пульсирующим образом. Его содержание в сыворотке крови может повышаться не только на фоне патологических состояний, но и в связи с физиологическими процессами, происходящими в организме. Так, увеличение концентрации гормона происходит в течение сна, независимо от времени суток. После пробуждения содержание пролактина в плазме снижается и через 3–4 часа достигает наименьшего значения. Период полураспада пролактина в крови – 20–30 минут. Уровень пролактина в крови здоровых женщин репродуктивного возраста колеблется от 150–200 мМЕ/л до 650–700 мМЕ/л, причем в лютеиновую фазу содержание пролактина выше, чем в фолликулиновую [10].
Существует целый ряд физиологических факторов, провоцирующих повышенную секрецию пролактина, среди которых наибольшее влияние имеет беременность, так как во время беременности повышается содержание эстрогенов, стимулирующих выработку пролактина путем прямого действия на рецепторы лактотропных клеток [11].
Кроме того, лактация, стрессовые ситуации, прием белковой пищи, физическая нагрузка и половой акт способны увеличить содержание гормона в крови. В пубертатном периоде усиление секреции пролактина связано с повышенным уровнем эстрогенов и гормона роста, в постменопаузальном синтез снижается ввиду выключения функции яичников.
В последние годы по всему миру активно изучаются биологические эффекты пролактина. Биологическая активность гормона определяется не только его концентрацией, но и состоянием рецепторов в органах-мишенях [12]. Общеизвестно, что пролактин обладает большим количеством биологических действий, чем все гипофизарные гормоны в совокупности. В отличие от них он не специализирован на регуляции какой-либо одной функции. В организме человека он оказывает прямое или опосредованное метаболическое действие практически на все ткани и системы организма. Ввиду многообразия физиологического воздействия пролактина была попытка переименовать его в «версатилин» (от английского versalite – многосторонний).
Доминирующим свойством пролактина является его воздействие на органы репродуктивной системы и прежде всего на молочные железы, как один из самых активных органов – мишеней для стероидных и некоторых пептидных гормонов.
За исключением семейного рака и генетической предрасположенности к раку молочной железы (РМЖ) (доказана роль мутации генов BRCA1 и BRCA2 в вероятности возникновения РМЖ) почти все установленные факторы риска рака имеют гормональный компонент [13]. В структуре заболевания гормонально-зависимый тип доминирует над гормонально-независимым и наследственно обусловленным [14]. Данные ряда исследований позволяют утверждать c высокой степенью вероятности, что повышение концентрации пролактина в крови (даже в значениях, не превышающих нормативный показатель) ассоциируется с риском развития РМЖ (рис. 3 см. на вклейке) [15].
Помимо РМЖ, предполагается участие пролактина в развитии рака простаты, языка, колоректального рака и рака матки и яичников [16].
В исследовании на трансгенных мышах (NRL-PRL, neu-related lipocalin-prolactin), у которых повышен локальный синтез пролактина молочными железами, было показано, что у животных развивались заболевания молочных желез, сходные с таковыми у человека. Эти заболевания включали как ранние повреждения (гиперплазия и интраэпителиальная неоплазия, сходная с протоковой carcinoma in situ у женщин), а также ER+ и ER-карциномы [17].
Эти результаты были подтверждены и в более позднем исследовании in vivo, где у мышей на фоне локального повышения синтеза пролактина маммарным эпителием без изменения уровня эстрогенов развивались различные гистотипические типы метастатического рака, преимущественно ER+. По результатам работы исследователи выдвинули тезис об идентификации нового подхода к профилактике и лечению РМЖ [18]. Механизм действия пролактина в развитии РМЖ заключается в повышении клеточной пролиферации, подвижности клеток и васкуляризации опухолей, то есть факторов, способствующих канцерогенезу и метастазированию [15].
Результаты исследований продемонстрировали, что повышенный уровень пролактина связан с высокой агрессивностью опухолей, повышенным риском метастазирования и низкой долгосрочной выживаемостью. Риск развития ER+ опухолей на фоне повышенного уровня пролактина возрастает на 60% [19].
На клеточном уровне показано, что состояние клеточного матрикса может оказывать влияние на качественный переход сигналов пролактина от физиологических к проканцерогенным. Так, эластичный матрикс способствует физиологической реализации действия пролактина, жесткий – проканцерогенному действию [20]. Пролактин-индуцированный белок (Prolactin-induced protein (PIP)), экспрессия которого регулируется пролактином, стимулирует пролиферацию опухолевых клеток и повышает их способность к инвазии [21]. Известные проонкогенные сигнальные пути, активируемые пролактином, представлены на рис. 4 (см. на вклейке) [22].
До недавнего времени данные эпидемиологических исследований относительно влияния повышенного уровня пролактина на риск развития РМЖ оставались противоречивыми. Например, два крупных проспективных исследования подтвердили связь пролактина и РМЖ [23, 24], а три более ранних небольших наблюдения не выявили подобной корреляции [25–27]. В популяционном когортном исследовании, включавшем 585 пациентов с гиперпролактинемией и 384 пациента с пролактиномой, не было выявлено корреляции между РМЖ и повышенным уровнем пролактина, однако было зафиксировано значимое повышение риска развития рака верхних отделов желудочно-кишечного тракта у женщин и мужчин и гематопоэтического рака у женщин [16].
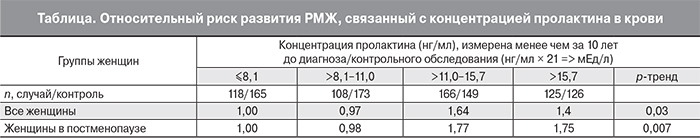
В работе S.S. Tworoger и соавт. (2013) были проанализированы данные двух групп женщин, которым проводили исследование уровня пролактина менее (1-я группа) и более (2-я группа) чем за 10 лет до установления диагноза РМЖ. В 1-ю группу вошли 2468 женщин с установленным диагнозом РМЖ и 4021 женщина без РМЖ (группа сравнения). Во 2-ю группу вошли 953 и 1339 женщин соответственно.
Результаты исследований выявили увеличение риска развития РМЖ при повышенном уровне пролактина, определенном менее чем за 10 лет до контрольного исследования: RR=1,20 при сравнении максимальной и минимальной концентраций (>15,7 нг/мл против <8,1 нг/мл). При этом положительная связь была сильнее в отношении ER+ рака: RR=1,28 и для женщин в постменопаузе: RR=1,37 (таблица). Для повышенной концентрации пролактина, определенной более чем за 10 лет до контрольного исследования, корреляции между РМЖ и пролактином определено не было [28].
Риск возникновения cancer in situ молочной железы на фоне повышенной концентрации пролактина оценили в исследовании случай-контроль с участием 307 пациенток. Была определена значимая положительная связь между концентрацией пролактина и риском cancer in situ для всех женщин: ORlog2=1,35. Медиана уровня пролактина составила 8,3 нг/мл у пациенток, у которых в дальнейшем развился инвазивный рак, и 6,8 нг/мл у тех, у которых инвазивный рак не развился. При анализе подгрупп положительная связь между концентрацией пролактина и РМЖ была более выраженной у тех женщин, у которых повышение уровня пролактина было установлено менее чем за 4 года до заболевания, а также у нерожавших женщин [29].
По мнению ряда исследователей, воздействие на пролактин и его сигнальные пути можно рассматривать как перспективный путь лечения РМЖ [22, 30, 31]. Еще в 2008 году велось обсуждение перспективы применения антагонистов пролактина в терапии РМЖ [32]. Как одно из возможных направлений рассматривается применение моноклональных антител, блокирующих экстрацеллюлярную часть пролактиновых рецепторов [33].
В настоящее время нейтрализующие антитела к пролактину уже проходят I фазу клинических исследований как средство терапии распространенного РМЖ и рака предстательной железы [34].
В случае доброкачественной дисплазии молочных желез при концентрации пролактина до 1200 мЕм/мл рационально применение лекарственных растительных препаратов на основе Vitex Agnus castus [35, 36], эффективность которых подтверждена в плацебо-контролируемых клинических исследованиях [37, 38].



