Рак шейки матки (РШМ), вызванный высоко онкогенными типами вируса папилломы человека (ВПЧ), продолжает занимать второе место среди злокачественных опухолей репродуктивной системы у женщин [1]. Значительная вариабельность заболеваемости и смертности от РШМ отмечается не только в различных странах мира, но и в различных областях одной и той же страны. Ежегодно в мире регистрируются 470 000 новых случаев РШМ, 233 000 заканчиваются смертельным исходом (15% приходится на женщин от 20 до 34 лет) [2].
Предраковым поражением, которое можно эффективно лечить, для предупреждения развития РШМ является цервикальная интраэпителиальная неоплазия (CIN). CIN I обычно наблюдают без лечения. Однако в 10% случаев CIN I может прогрессировать до CIN III или РШМ; у пациенток с CIN II, 20% прогрессирует в CIN III или РШМ и 40% CIN II спонтанно регрессирует [3, 4]. Для многих гинекологов ведение пациентов с CIN I является спорным: наблюдать пациентов до спонтанной регрессии или лечить их с использованием деструктивных методов? Лечение может быть целесообразным для пациентов, которые относятся к группе высокого риска по прогрессированию заболевания. В отношении пациентов с низким риском (спонтанная регрессия), можно выбрать тактику динамического наблюдения. В этой связи, существует необходимость определения эффективных специфичных биомаркеров, которые бы служили надежным предиктором исходов и могли бы внести существенный вклад в диагностику, прогноз и лечение ВПЧ-ассоциированных заболеваний шейки матки.
Цель исследования: выявить особенности изменения уровня экспрессии мРНК генов человека у пациенток с ВПЧ-ассоциированными заболеваниями шейки матки для прогнозирования риска развития и прогрессирования CIN.
Материал и методы исследования
В исследование были включены 225 женщин, в возрасте от 18 до 60 лет (средний возраст 31,6±0,5 года). Критерии включения: ВПЧ позитивные женщины, CIN различной степени тяжести, РШМ. Критерии исключения: беременность, отсутствие возможного следования протоколу. Длительность наблюдения за пациентами составила 12,4±5 месяцев.
Обследование женщин включало: сбор жалоб, анамнеза, гинекологический статус, расширенную кольпоскопию, молекулярно-биологические методы исследования, цитологическое исследование, гистологическое исследование биопсийного материала (по показаниям).
Молекулярно-биологические методы исследования включали проведение метода мультиплексной полимеразной цепной реакции (ПЦР) с детекцией результатов в режиме реального времени для определения 21 типа ВПЧ (6, 11, 16, 18, 26, 31, 33, 35, 39, 44(55), 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) с определением вирусной нагрузки (ООО «НПО ДНК-Технология», Россия).
Экспрессию мРНК генов MKI 67 (KI67), CTSL2, CDKN2A (P16), ESR1, PGR, BCL2, BAX, BAG1, CD68, SCUBE2, PTEN определяли при первичном обращении с использованием метода количественной ПЦР с обратной транскрипцией в режиме реального времени (ООО «НПО ДНК-Технология», Россия). Для количественной оценки уровня экспрессии мРНК генов использовался метод ∆ΔСq c нормировкой по 3 референсным генам TBP, B2M и GUSB. За 1 было принято значение уровня экспрессии в контрольной группе.
В качестве меры центральной тенденции всех количественных показателей использовали медиану (Me), в качестве интервальной оценки – нижний Q1 (0,25) и верхний Q3 (0,75) квартили.
Достоверность межгрупповых различий количественных показателей определяли с помощью критерия Манна–Уитни, качественных показателей –χ2-критерия с поправкой Йетса для малых выборок.
Для оценки вероятности риска развития и прогрессирования заболевания был использован метод регрессионного анализа (бинарная логистическая регрессия). Вероятность события определялась по формуле:
р=1/(1+e-z)*100 (1), где
p – вероятность принадлежности к одной из анализируемых групп классификации
z – регрессионная функция, имеющая вид:
z = b1×X1 + b2×Х2+ ...+ bn×Хn+ а(2);
Х1 ... Хn – уровень экспрессии мРНК генов;
b1 ... bn – регрессионные коэффициенты
а – константа.
Выбор наиболее информативных генов и значения регрессионных коэффициентов были получены путем многофакторного анализа.
Для расчета оптимального значения величины порога отсечения Р (точки cut off) использовали ROC-анализ (Receiver Operator Characteristic).
Для оценки кольпоскопической картины применяли единую Международную кольпоскопическую классификацию, одобренную на 14-м Всемирном конгрессе IFCPC в Рио-де-Жанейро (2011). Использовалась цитологическая система оценки теста Папаниколау – система Бетесда (TBS-Terminology Bethesda System) [5, 6]. Гистологические образцы классифицировали следующим образом: легкая дисплазия (CIN I), умеренная дисплазия (CIN II), тяжелая дисплазия (CIN III) и РШМ.
Статистическая обработка проводилась с помощью SPSS17 Statistics 17.0.
Результаты и обсуждение
По результатам обследования были сформированы 5 групп: 45 (20%) – ВПЧ-негативные (I группа – контрольная), 180 (80%) – ВПЧ-позитивные, которые были разделены на 4 группы: II группа – 56 (24,9%) женщин с латентной формой (ВПЧ-носительство) и с субклиническими формами папилломавирусной инфекции (экзофитные кондиломы шейки матки, плоская кондилома шейки матки), III группа – 50 (22,2%) с плоскоклеточным интраэпителиальным поражением низкой степени выраженности (LSIL), IV группа – 55 (24,4%) с плоскоклеточным интраэпителиальным поражением высокой степени выраженности (HSIL), V группа – 19 (8,5%) с РШМ.
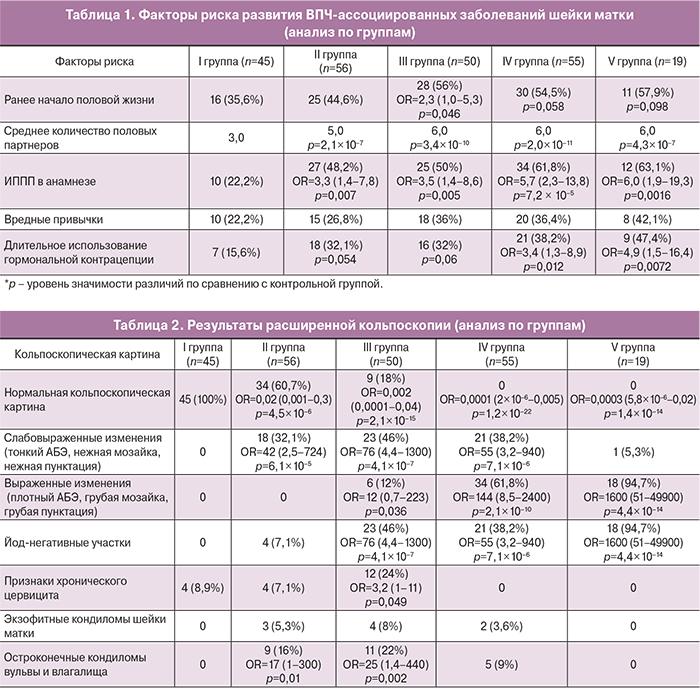
Оценка возрастного распределения показала высокую частоту выявления высокоонкогенных типов ВПЧ в возрасте до 30 лет (54,4%). Клинико-анамнестический анализ показал, что 52,2% ВПЧ-позитивных женщин отмечали ранее начало половой жизни (до 18 лет), 77,8% – большое количество половых партнеров (≥5), 54,4% – наличие в анамнезе инфекций, передающихся половым путем (ИППП), 33,9% – вредные привычки (курение), 35% – длительное использование гормональной контрацепции (более 3 лет). Анализ факторов риска по группам представлен в табл. 1.
Анализ результатов исследования показал, что наиболее значимыми факторам риска поражения эпителия шейки матки являются: большое число половых партнеров ≥5 (р<0,001), раннее начало половой жизни (менее 18 лет) (p<0,05), ИППП (p<0,01) и длительное использование гормональной контрацепции (p<0,05). Полученные данные согласуются с мнением ряда исследований о роли факторов риска в развитии ВПЧ-ассоциированных заболеваний шейки матки [7].
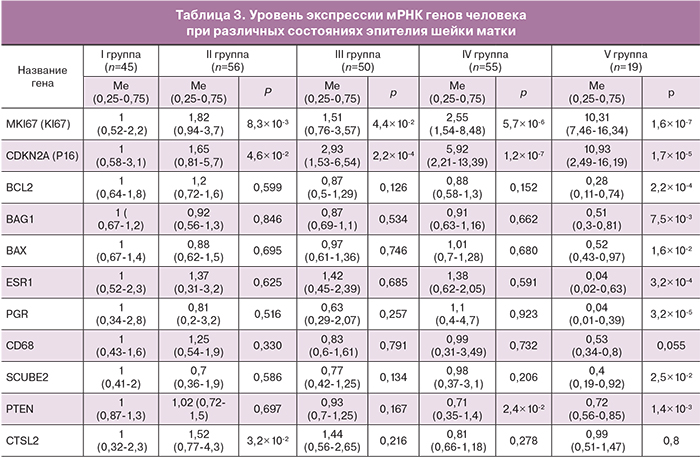
 При проведении расширенной кольпоскопии обнаружено: адекватная кольпоскопическая картина – 58,9%, неадекватная – 41,1%. Варианты ненормальной кольпоскопической картины включали в себя слабовыраженные и выраженные изменения, наиболее важным из которых явилось наличие ацетобелого эпителия (АБЭ), интенсивность побеления которого коррелировала со степенью тяжести процесса. Анализ кольпоскопических изменений по группам представлен в табл. 2.
При проведении расширенной кольпоскопии обнаружено: адекватная кольпоскопическая картина – 58,9%, неадекватная – 41,1%. Варианты ненормальной кольпоскопической картины включали в себя слабовыраженные и выраженные изменения, наиболее важным из которых явилось наличие ацетобелого эпителия (АБЭ), интенсивность побеления которого коррелировала со степенью тяжести процесса. Анализ кольпоскопических изменений по группам представлен в табл. 2.
При генотипировании 180 ВПЧ-позитивных женщин установлено, что наиболее часто встречающимися типами ВПЧ явились: 16 (50%), 58 (17,8%), 52 (13,3%), 31 (12,8%), 33 (9,4%). Другие типы ВПЧ встречались менее чем в 7,2% случаях. В 48,9% образцах выявлено несколько типов ВПЧ. Генотипирование по группам показало, что во II, III и IV группах, наиболее часто выявлялись ВПЧ 16 (30,3%, 42%, 65,4% соответственно) и 58 (14,3%, 24%, 16,4% соответственно) типов, а в V группе – 16 (84,2%), 31 (31,2%) 58 (15,8%) типов. Полученные нами данные отличаются от представленных ранее данных, согласно которым наиболее распространенными типами ВПЧ считались 16, 18, 33, 45, 31 [8].
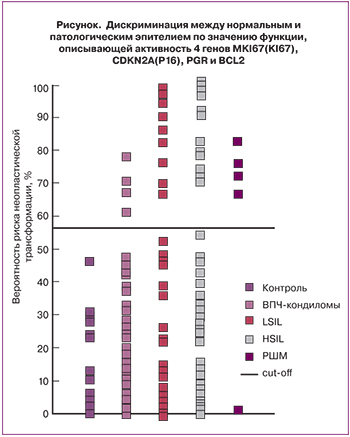
Всем пациенткам проводилось определение уровня экспрессии мРНК генов. В качестве маркеров были выбраны гены, регулирующие пролиферацию и клеточный цикл (MKI 67 (KI67), CDKN2A (P16)), инвазию (CTSL2), апоптоз (BCL2, BAX, BAG1), рецепторный аппарат клеток (ESR1, PGR , CD68), опухолевую супрессию (PTEN), сигнальный пептид SCUBE2.
По результатам исследования во II группе выявлено достоверное повышение экспрессии мРНК MKI67 (KI67) в 1,8 раза (р=8,3×10-3), CDKN2A (P16) в 1,6 раза (р=4,6×10-2), CTSL2 в 1,5 раза (р=3,2×10-2) по сравнению с контрольной группой.
В III группе отмечено достоверное повышение экспрессии мРНК MKI67 (KI67) в 1,5 раза (р=4,4×10-2) и CDKN2A (P16) в 2,9 раза (р=2,2×10-4) по сравнению с контрольной группой.
В IV группе выявлено достоверное повышение MKI67 (KI67) в 2,5 раза (р=5,7×10-6), CDKN2A (P16) в 5,9 раза (р=1,2×10-7) по сравнению с контрольной группой и снижение PTEN в 1,2 раза (р=2,4×10-2 ).
В V группе повышение экспрессии мРНК еще более существенно: MKI67 (KI67) в 10,3 раза (р=1,6×10-7), CDKN2A (P16) в 11 раз (р=1,7×10-5). При этом отмечается снижение BCL2 в 3,6 раза (р=2,2×10-4), SCUBE2 в 2,5 раза (р=2,5×10-2), BAG1 и BAX в 1,9 раза (р=7,5×10-3 и р=1,6×10-2 соответственно), PTEN в 1,4 раза (р=1,4×10-3). Значительно (в 25 раз) снижается экспрессия генов, кодирующих рецепторный аппарат клеток – ESR1и PGR (р=3,2×10-4 и р=3,2×10-5 соответственно), по сравнению с контрольной группой (табл. 3).
Полученные нами данные согласуются с литературными данными, согласно которым ряд маркеров пролиферации (MKI67 (KI67), CDKN2A (P16)) активно продуцируются в пролиферативную фазу клеточного цикла при РШМ и CIN [4]. В основе механизмов неопластической трансформации клеток эпителия рассматривают гиперэкспрессию вирусных белков Е6 и Е7, возникающую при интеграции ДНК вируса в геном клетки хозяина. При этом оказывается утерянной часть генома вируса, регулирующая экспрессию Е6 и Е7. Е6 взаимодействует с опухолевым супрессором p53 и активатором апоптоза BAK, блокируя их активность. В нашем исследовании установлено, что происходит снижения экспрессии всех маркеров апоптоза (BCL2, BAG1 и BAX), в результате чего апоптотическая активность снижается.
BCL2 обладает противоапоптотической активностью, контролируя проницаемость наружной мембраны митохондрий [9]. Е7 разрушает рRB, что приводит к высвобождению E2F и повышению экспрессии Р16INK4A (CDKN2A). Так же Е7 индуцирует амплификацию центриолей, провоцируя анеуплоидии, способствующие развитию опухоли [10].
При неопластической трансформации эпителия шейки матки происходит потеря некоторых рецепторов, в том числе ESR1 и PGR.
С целью разработки способа определения образцов с неопластической трансформацией тканей был выполнен регрессионный анализ (бинарная логистическая регрессия.
Уравнение регрессии имело вид:
Z=0,8×ln [KI67]/[PGR] + 1,6×ln [P16]/[BCL2] – 4,
где [KI67]/[PGR] – соотношение уровней экспрессии мРНК KI67 и PGR, [P16]/[BCL2] – соотношение уровней экспрессии мРНК P16 и BCL2.
На основании полученной функции для каждого образца была рассчитана вероятность развития неопластической трансформации эпителия шейки матки. Для определения критического значения вероятности (точка cut-off) был выполнен ROC-анализ. Площадь под ROC-кривой составила AUC=0,975±0,025, p=2,4×10-9, что позволило оценить модель как отличную. Пороговое значение функции в точке cut-off составило 57%. Образцы, где рассчитанная вероятность была больше пороговой, оценивались как имеющие вероятность развития неопластической трансформации. Чувствительность и специфичность предложенной модели в области порогового значения составила 94,7 и 100%. Результаты рассчитанных значений функции приведены на рисунке.
В группу высокого риска развития неопластической трансформации эпителия шейки матки попали 29 женщин: 5 (8,9%) – из II группы, 9 (18%) – из III группы, 15 (27,3%) – из IV группы.
При сравнении пациенток, попавших в группу риска, с другими пациентками соответствующих групп, установлено, что факторы риска по развитию и прогрессированию ВПЧ-ассоциированных заболеваний шейки матки (ранее начало половой жизни, большое количество половых партнеров, ИППП) у них были более выражены (р<0,01). Ненормальная кольпоскопическая картина у пациенток группы риска встречалась в 93,1% случаях и характеризовалась наличием слабо выраженных и выраженных изменений, что позволяет рассматривать данный метод, как один из важных в диагностике ВПЧ-ассоциированных заболевании шейки матки. Частыми типами ВПЧ у пациенток группы риска являлись: 16 (65%), 58 (24%), 31 (13%), 33 (13%), 39 (10%), 52 (6,8%), в 65,5% случаях выявлено наличие 2 и более типов ВПЧ, вирусная нагрузка в 69% случаев была клинически значимой (более 5lg копий вируса/100 тыс. клеток). Таким образом, пациентки, попавшие в группу высокого риска по развитию неопластического процесса эпителия шейки матки имели изменения клинических и лабораторных показателей.
Конечно, с точки зрения прогнозирования течения неопластического процесса для нас интерес представляли пациентки II и III группы, в связи с чем они были обследованы в динамике через 6 и 12 сяцев. Обследование включало цитологическое исследование мазков с шейки матки, определение ВПЧ и расширенную кольпоскопию.
Во II группе через 12 месяцев у всех пациенток ВПЧ сохранялся, т.е. наблюдалась персистенция ВПЧ с вирусной нагрузкой более 5 lg/100 тыс. клеток. Во всех случаях цитологический диагноз изменился на более неблагоприятный: ASCUS – у 20%, LSIL – у 80% (p=5x10-10), при кольпоскопии ухудшений не было ни в одном случае. Таким образом, длительная персистенция одного и того же типа ВПЧ высокого риска должна настораживать с позиций развития неопластического процесса эпителия шейки матки; молекулярно-генетические маркеры могут рассматриваться как ранние предикторы прогнозирования данного процесса.
В III группе через 12 месяцев ВПЧ выявлялся у всех пациенток, при цитологическом исследовании диагноз LSIL сохранился у 6 (66,6%), изменился на более неблагоприятный – HSIL у 3 (33,3%) (p=6,3×10-4). Ненормальная кольпоскопическая картина (плотный АБЭ, грубая пунктация) была у 4 (44,4%). Всем пациенткам III группы выполнена биопсия и эксцизия шейки матки.
У пациенток II группы, которые не попали в группу высокого риска, элиминация ВПЧ произошла в 24 (54,5%) случаев и только в 20 (45,5%) случаях ВПЧ сохранялся, цитологические заключения были нормальными.
У пациенток III группы, которые не попали в группу высокого риска, через 12 месяцев диагноз LSIL сохранился у 16 (39%), у остальных 25 (61%) – цитологические заключения были нормальными. В 21 (51,2%) случаях ВПЧ был сохранен, у 1 (2,4%) пациентки выявлен другой тип ВПЧ. В III группе элиминация ВПЧ произошла в 20 (50%) случаев. По результатам цитологии и кольпоскопии ухудшения не было выявлено ни в одной из этих групп.
Таким образом, только у пациенток группы риска наблюдалось развитие и прогрессирование CIN, из чего следует, что, исследование уровня экспрессии мРНК генов человека (MKI67 (KI67), CDKN2A (P16), PGR и BCL2) может быть использовано в прогнозе развития и прогрессирования ВПЧ-ассоциированных заболеваний. Мы полагаем, что при уровнях указанных показателей выше порогового значения, следует отдавать предпочтение более активным методам лечения или сокращать интервалы динамического наблюдения. Данную модель мы можем использовать для оценки риска поражения эпителия шейки матки у пациенток с персистенцией ВПЧ и риска прогрессии LSIL.
Заключение
Результаты проведенного исследования показали различия в уровне экспрессии мРНК потенциальных онкомаркеров в эпителии шейки матки у пациенток с цервикальными неоплазиями различной степени тяжести, РШМ и здоровых женщин.
Повышение экспрессии мРНК генов MKI67 (KI67), CDKN2A (P16), снижение экспрессии PGR, BCL2 в сочетании с высоко онкогенными типами ВПЧ, ненормальной кольпоскопической картиной, коррелируют с исходами LSIL и могут рассматриваться как возможные биомаркеры прогнозирования течения уже развившейся неоплазии; при ВПЧ-носительстве – как возможные биомаркеры прогнозирования развития неопластической трансформации эпителия шейки матки. Определение данных биомаркеров поможет правильно определить тактику ведения таких пациентов и тем самым снизить риск развития РШМ.
Таким образом, применение современных молекулярно-биологических методов исследования для диагностики эпителиальных дисплазий шейки матки, прогнозирования их течения, несомненно, имеет практическое значение и может служить основанием для дальнейших исследований на большом клиническом материале.



