Преэклампсия (ПЭ) возникает в 2–5% беременностей, является ведущей причиной материнской и перинатальной заболеваемости и смертности [1–5]. Существует консенсус в отношении того, что ПЭ представлена двумя основными фенотипами с ранней и поздней манифестацией заболевания [6, 7].
В настоящее время единственным методом лечения ПЭ является плановое родоразрешение. Последние исследования показали, что профилактические стратегии с назначением аспирина на начальных этапах беременности могут снижать распространенность заболевания [8], что обусловливает актуальность прогнозирования ПЭ в первом триместре [9].
Поскольку ПЭ имеет мультифакториальную природу [10], наиболее перспективным представляется использование многофакторной скрининговой модели, включающей в себя комбинацию данных о материнском анамнезе, биофизических и биохимических маркеров [11–18]. Однако даже при использовании многофакторного подхода результативность скрининга значительно различается, варьируя от 46,7 до 100% для прогнозирования ПЭ, требующей родоразрешения до 34 недель, и от 29,4 до 71,1% для поздней ПЭ [11–15, 19].
Одним из пробелов в современных данных по прогнозированию ПЭ является то, что в большинстве исследований изучались англо-саксонские, средиземноморские популяции в соответствующих условиях [14, 17, 20, 21]. Существует потребность в подтверждении эффективности скрининга ПЭ в первом триместре при выполнении типичных клинических условий и для популяций, отличающихся от описанных в исходных исследованиях [22]. Состав популяции при проведении исследования может оказывать существенное влияние на исходный материнский риск a priori. К примеру, в южных европейских странах, а тем более в европейской части России, доля черного населения и частота ожирения, хронической гипертензии ниже, чем в Великобритании [23–25].
Таким образом, является важным проведение внешней валидации скрининговых алгоритмов до момента их широкого внедрения в клиническую практику. Целью нашего исследования была оценка прогностической эффективности опубликованных алгоритмов первого триместра в когорте проспективно отобранных женщин российской популяции в первом триместре беременности.
Материал и методы исследования
В проспективной когорте, состоящей из одноплодных беременностей, проводился рутинный скрининг первого триместра в клинике Научного центра акушерства, гинекологии и перинатологии. Протокол исследования был утвержден локальным этическим комитетом, пациенты подписывали информированное согласие на участие в исследовании. Гестационный возраст всех беременных рассчитывался на основе данных о копчико-теменном размере (КТР), полученных во время выполнения ультразвукового исследования в первом триместре. Регистрировались данные о материнском анамнезе и факторах риска, уровне артериального давления (АД), допплерометрии маточных артерий и концентрации в плазме свободного β-хорионического гонадотропина, PAPP-A, а также плацентарного фактора роста (PlGF) и растворимого рецептора-1 типа fms-подобной тирозинкиназы (sFlt-1 или sVEGFR-1) (расширенная панель маркеров), измеренных в первом триместре.
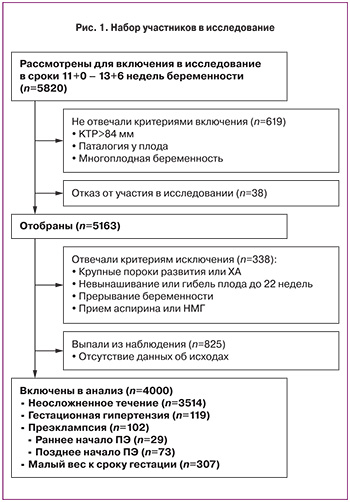 С августа 2013 по сентябрь 2015 г. в целом было обследовано 5820 женщин. Из них 619 беременных (10,6%) не отвечали критериям включения, 38 отказалось от участия в исследовании. Было исключено 1163 (19,9%) пациенток по следующим причинам (не исключительно): отсутствие данных об исходах (n=825), крупные пороки развития или хромосомные аномалии (n=32), случаи невынашивания или гибели плода при сроке беременности <22 недель (n=84), прерывание беременности при отсутствии медицинских показаний (n=37). После исключения в исследовании осталось 4000 наблюдений (рис. 1).
С августа 2013 по сентябрь 2015 г. в целом было обследовано 5820 женщин. Из них 619 беременных (10,6%) не отвечали критериям включения, 38 отказалось от участия в исследовании. Было исключено 1163 (19,9%) пациенток по следующим причинам (не исключительно): отсутствие данных об исходах (n=825), крупные пороки развития или хромосомные аномалии (n=32), случаи невынашивания или гибели плода при сроке беременности <22 недель (n=84), прерывание беременности при отсутствии медицинских показаний (n=37). После исключения в исследовании осталось 4000 наблюдений (рис. 1).
Данные об исходах беременности получали при анализе медицинских карт в МИС Медиалог (ПМТ, Россия). Госпитальные записи, связанные со всеми акушерскими поступлениями, анализировались на предмет постановки диагноза гипертензивного расстройства для уточнения отнесения пациенток в категорию хронической (предсуществующей) гипертензии (ХГ), гестационной гипертензии (ГГ) или ПЭ. ГГ и ПЭ определялись в соответствии с критериями, предложенными Международным обществом по изучению гипертензии во время беременности (International Society for the study of Hypertension in Pregnancy) [26] и федеральными клиническими рекомендациями Российского общества акушеров и гинекологов [27].
Гипертензия при беременности определялась при наличии систолического АД >140 мм рт. ст. и/или диастолического АД >90 мм рт. ст. при двукратной оценке с интервалами между измерениями более 4 часов. ХГ определялась на основе существования гипертензии в анамнезе до момента наступления беременности или диагностики гипертензии в сроки беременности <20 недель. ГГ определялась в случае гипертензии, возникшей de novo при отсутствии подтверждения о наличии протеинурии после 20 недель беременности и исчезавшей в послеродовом периоде; протеинурия определялась в ходе 24-часового сбора мочи при значениях белка ≥300 мг или при наличии соотношения в моче белка/креатинин ≥30 мг протеин/мМоль креатинин) [26]. Каждая пациентка классифицировалась при родоразрешении в зависимости от наличия или отсутствия гипертензивного заболевания при беременности, ГГ, ранней ПЭ (требующей родоразрешения <34 недель беременности) или поздней ПЭ (требующей родоразрешения ≥34 недели). Женщины с ХГ не относились в группу гипертензивных расстройств беременности до тех пор, пока у них не развивалась ПЭ на фоне гипертензии [27]. Новорожденные считались маловесными к сроку беременности, если вес при рождении был ниже 10-й процентили в соответствии с местными стандартами. Регистрировались данные о рождении, включая срок беременности, метод родоразрешения, вес ребенка при рождении. Доктора, ставившие диагноз, не имели информации о параметрах исследования, оцениваемых во время первого триместра беременности.
Материнские характеристики и медицинский анамнез регистрировались проспективно во время скринингового ультразвукового исследования (11+0 – 13+6 недель). Заполнялся опросный лист пациента, в котором содержалась информация об этнической принадлежности, способе наступления беременности, акушерском (паритет, преждевременные роды), медицинском (сахарный диабет, заболевания почек, антифосфолипидный синдром, системная красная волчанка), семейном анамнезе, статусе курильщика. Отдельный пункт анкеты был посвящен вопросу о наличии гипертензии, гипертензии в предыдущие беременности или случаям ПЭ в семейном анамнезе (у матери). Пациентки исключались из исследования в случае, если они получали антигипертензивные препараты, аспирин или любые другие медикаменты, которые могли повлиять на распространенность ПЭ. Оценивались вес, рост матери, рассчитывался индекс массы тела (ИМТ).
Измерение АД у беременной выполнялось после периода отдыха женщины, пациентка находилась в положении сидя, проводилось двукратное измерение уровня систолического и диастолического АД на обеих руках с интервалом в 1 мин, рассчитывалось среднее АД (АДср или MAP, mean arterial pressure). Значение АД у матери регистрировалось обученным персоналом с помощью автоматизированного устройства (OMRON HEM 907, Omron Healthcare, Япония), использовался соответствующий размер манжеты. В ходе исследования с регулярными интервалами выполнялась калибровка прибора.
Эхографическое исследование выполнялось как один из компонентов скрининга на анеуплоидии в первом триместре на приборах экспертного класса последнего поколения (GE Voluson E8, Toshiba ApplioXG). Срок беременности рассчитывался на основе данных о КТР плода. Заполнялись данные о толщине воротникового пространства, частоте сердечных сокращений и оценке анатомии плода в ходе ультразвукового исследования. Маточные артерии определялись при выведении шейки матки в среднемедиальное положение, а затем при перемещении ультразвукового датчика латерально от шейки в обе стороны, использовался режим цветового допплеровского картирования для визуализации восходящей части маточной артерии на уровне внутреннего зева шейки матки. Значения пульсационного индекса маточных артерий с обеих сторон (UtAPI) автоматически измерялись и рассчитывалось среднее значение UtAPI.
Измерение уровней материнских сывороточных PAPP-A было частью скрининговой программы на анеуплоидии в первом триместре, PlGF и sFlt-1 – ее компонентом в расширенном варианте. Количественное определение в материнской сыворотке PAPP-A, PlGF проводилось с использованием клинической технологической платформы для скрининга с произвольной выборкой DELFIA Xpress и соответствующими наборами реагентов DELFIA Xpress kit (Wallac Oy, Турку, Финляндия). Количественное определение растворимой fms (фарнезил-янтарная кислота)-подобной тирозинкиназы sFlt-1 (sVEGFR-1) в сыворотке матери проводилось с помощью электрохемилюминесцентного иммунотеста ECLIA sFlt-1 на иммунохимическом анализаторе COBAS e411. Сырые данные конвертировались в значения кратные медианам (Multiple of Median, MoM), которые рассчитывались исходя из гестационного возраста (на основе данных о КТР), веса матери, этнической принадлежности, курения и метода наступления беременности, возраста матери (для PlGF). Для расчета рисков использовалось программное обеспечение Astraia (Astraia v23.4, Astraia Software Gmgh, Германия).
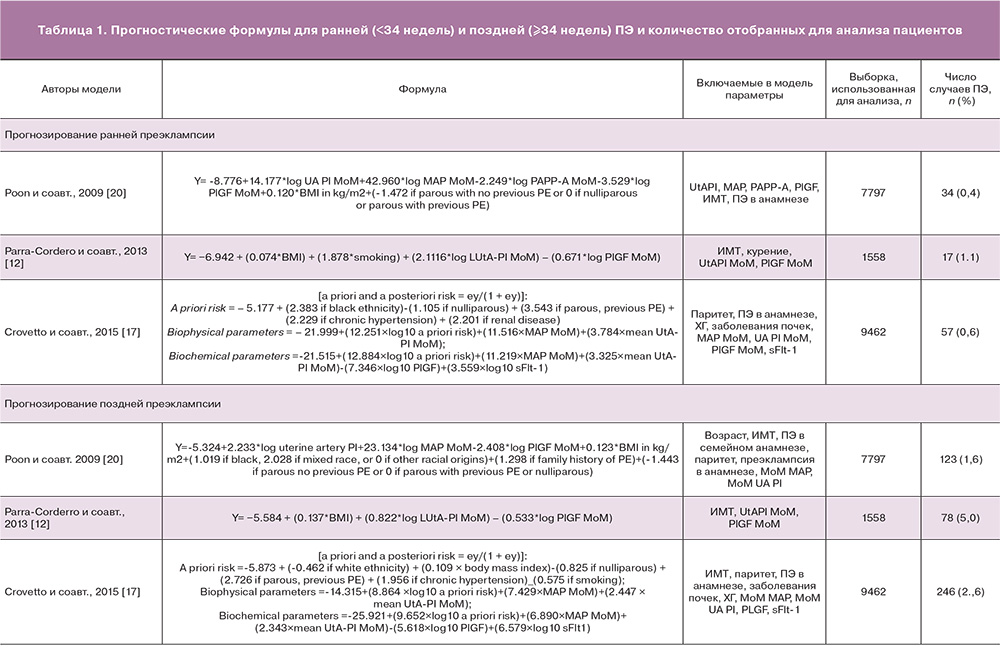
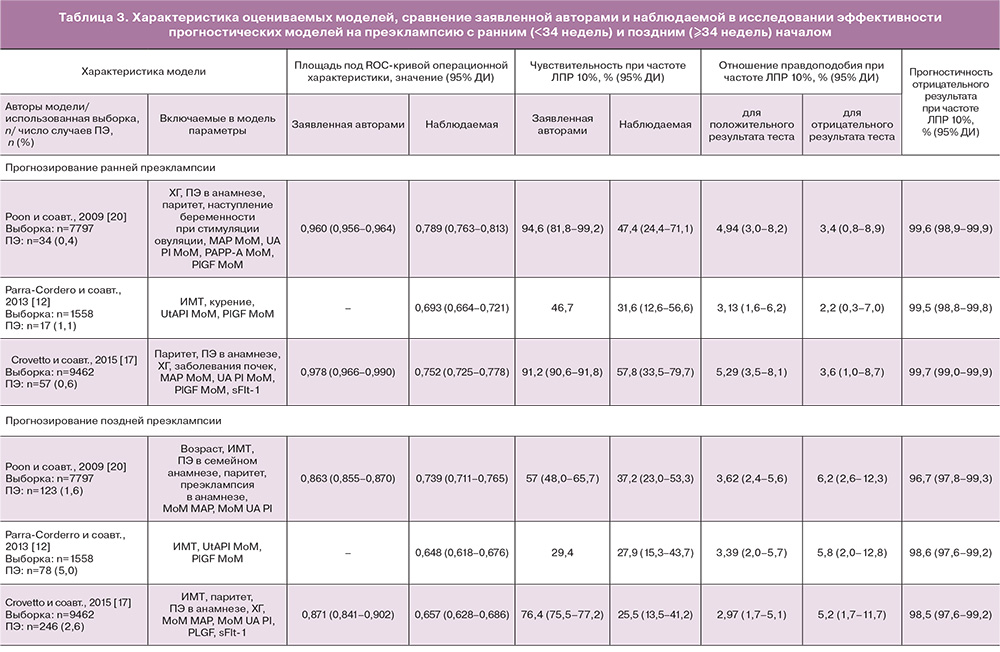
Для проведения внешней валидации скрининговых алгоритмов были отобраны три работы одних из наиболее известных исследовательских групп по прогнозированию ПЭ. В опубликованных работах были описаны оригинальные модели логистической регрессии на основе оценки клинико-анамнестических факторов, данных биохимических и биофизических маркеров для оценки вероятности развития ранней и поздней ПЭ. В исследовании Poon и соавт. (2009) [20], представляющем группу Prof. K. Nicolaides (Fetal Medicine Foundation, Великобритания, Лондон), авторы проанализировали течение 8366 одноплодных беременностей, среди которых у 165 пациенток развилась ранняя ПЭ, у 128 – поздняя ПЭ. В исследовании Parra-Cordero и соавт. (2013) [12], представляющем Южноамериканских авторов из Чили, было проанализировано течение 5170 одноплодных беременностей, среди которых у 26 пациенток верифицирована ранняя ПЭ, у 110 – поздняя. В исследование Crovetto и соавт. (2015) [17], представляющем группу испанских авторов, возглавляемых Prof. E. Gratacos (Fetal Medicine Barcelona), включены 9159 беременных, среди которых у 57 развилась ранняя, у 246 – поздняя ПЭ. Авторами всех статей предложены различные комбинации предикторов для включения в модель (табл. 1), нами были рассмотрены и применены обеспечивающие максимальную точность предсказания.
Для одномерных сравнений между группами количественных и качественных переменных использовались U-тест Манна–Уитни и χ2-тест Пирсона или точный тест Фишера соответственно (уровень значимости p<0,05). Анализ эффективности скрининга по оценки вероятности событий проводился с помощью построения кривых операционных характеристик (Receiver Operating Characteristic, ROC-анализ), при этом сравнивались области под ROC-кривыми различных моделей. При этом площадь, равная 1, представляет наилучший тест, площадь, равная 0,5 – бесполезный тест. Эффективность прогностического алгоритма также оценивалась на основе данных о чувствительности и специфичности теста, прогностической ценности положительного и отрицательного результата в изучаемой популяции, отношения правдоподобия положительного результата теста. Прогностические точности определялись для фиксированной частоты ложноположительных результатов 10%. Для анализа данных использовался пакет статистических программ SPSS 23.0 (IBM SPSS Statistics for Windows, Version 23.0), статистический программный пакет R (R Development Core Team), графическое представление данных выполнялось с помощью программного продукта MedCalc (MedCalc v.14.8.1, Mariakerke, Belgium).
Результаты исследования
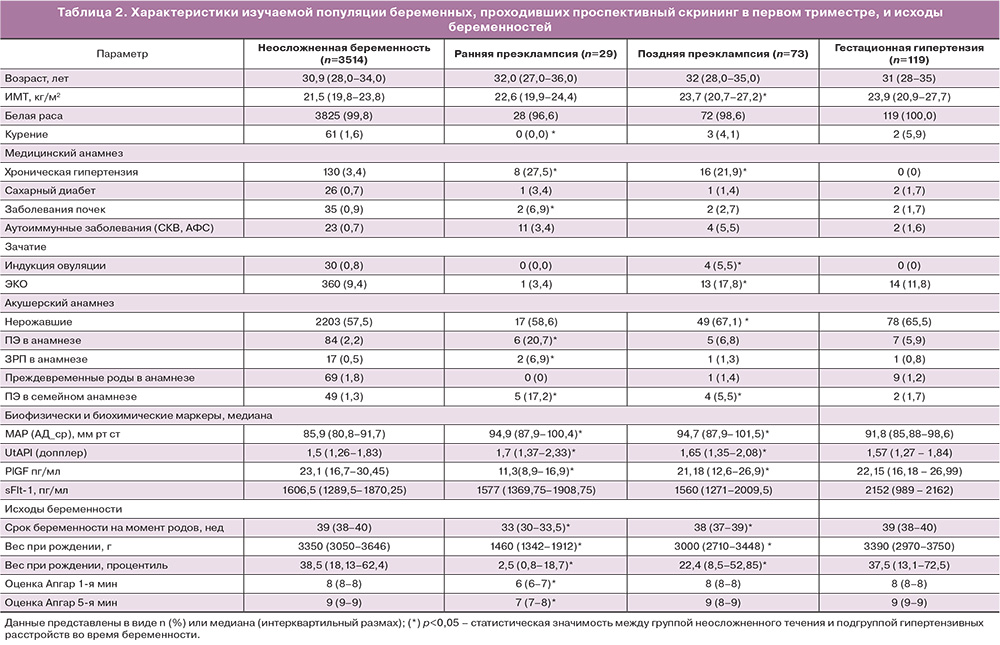
Среди 4000 беременных, включенных в исследование, у 102 (2,5%) развилась ПЭ, включая 73 (1,8%) случая поздней ПЭ и 29 (0,7%) случаев ранней ПЭ, 119 (2,9%) случаев ГГ, 307 (7,6%) случаев рождения детей с малым весом для соответствующего срока беременности (рис. 1). В табл. 2 приведены эпидемиологические и клинические характеристики популяции, стратифицированные в зависимости от разновидности гипертензивного расстройства при беременности и клинического варианта ПЭ. В группе ранней ПЭ по сравнению с контрольной группой наблюдались значимые отличия по частоте ХГ, заболеваний почек, ПЭ в акушерском и семейном анамнезе, задержки роста плода в акушерском анамнезе, среднего АД, пульсационного индекса маточных артерий UtAPI, по сроку беременности на момент родов, весу новорожденного при рождении. В группе поздней ПЭ в сравнении с группой контроля были значимо выше ИМТ, ХГ, частота наступление беременности в результате ЭКО и индукции овуляции, частота первородящих женщин; значимо более низкими были среднее АД, значения PlGF, срок беременности на момент родоразрешения, вес новорожденного при рождении.
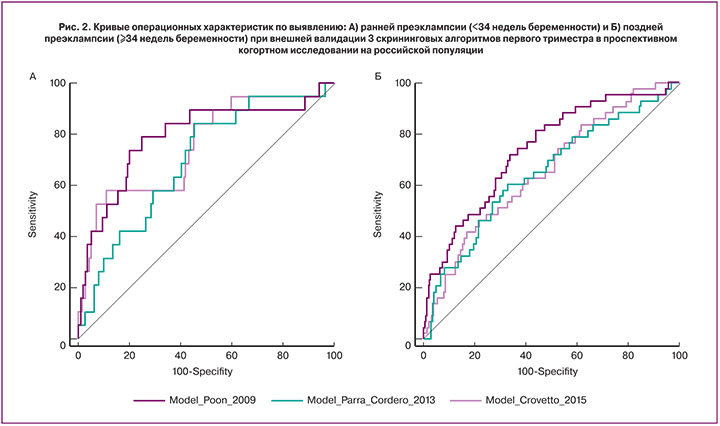
Эффективность алгоритмов Poon (2009), Parra-Cordero (2013) и Crovetto (2015) в прогнозировании ранней и поздней ПЭ на изучаемой популяции приведена в табл. 3. Все расчетные вероятности событий показали значимые для прогнозирования ПЭ площади под ROC-кривыми, варьируя от 0,693 до 0,789 для ранней ПЭ и от 0,648 до 0,739 для поздней ПЭ (рис. 2).
При фиксированной частоте ложноположительных результатов 10% прогностические модели имели чувствительность, варьирующуюся от 31,6 до 57,8% для ранней ПЭ и от 25,5 до 37,2% для поздней ПЭ, высокую прогностическую ценность отрицательного результата, но низкую прогностическую ценность положительного результата теста от 3,1 до 5,3% для ранней ПЭ и от 2,9 до 3,6% для поздней ПЭ. Отношение правдоподобия положительного результата теста варьировало от 3,13 до 5,29 для ранней ПЭ и от 2,97 до 3,62 для поздней ПЭ. Все прогностические алгоритмы показывали прогностические величины ниже опубликованных в оригинальных исследованиях (табл. 3).
Обсуждение
Нами было показано, что проведение скрининга беременных в первом триместре в типичных клинических условиях с использованием алгоритмов, разработанных группой Фонда медицины плода Poon и соавт. (2009), Parra-Cordero и соавт. (2013) и Crovetto и соавт. (2015) может осуществляться в рутинной клинической практике на российской популяции. Расчет риска на раннюю и позднюю ПЭ осуществлялся аналогично заявленным в оригинальных работах, хотя и с более низкой чувствительностью 31–57% и 25–37% соответственно при фиксированной частоте ложноположительных результатов 10%. Алгоритмы Poon и соавт. (2009) и Crovetto и соавт. (2015) продемонстрировали обнадеживающие результаты. Более скромные результаты в нашем исследовании продемонстрировали модели Parra-Cordero и соавт. (2013). В целом исследование подтверждает ранее полученные данные о том, что интегрированный скрининг первого триместра на ПЭ обладает более высокой эффективностью в выявлении ранней ПЭ.
К сильным сторонам данного исследования можно отнести его проспективный дизайн, сравнение эффективности трех алгоритмов расчета риска ПЭ в Российской популяции. Также при проведении исследования применялись четкие критерии оценки исходов, соблюдались международные рекомендации проведения скрининговых программ, оценки клинико-анамнестических, биофизических и биохимических маркеров. Другим преимуществом исследования является то, что все тестируемые модели включали в качестве предикторов ангиогенные факторы (PlGF, sFlt-1). Накапливаются доказательства, что добавление таких биохимических факторов приводит к улучшению диагностической эффективности моделей [11, 28]. Однако мы не получили подтверждения того, что добавление к PlGF другого маркера ангиогенеза sFlt-1 улучшает прогностическую способность модели при скрининге на ПЭ в первом триместре. Так значимых различий при анализе площади под ROC-кривыми между моделью Poon и соавт (2009), включающей данные только о PlGF, и моделью Crovetto и соавт. (2015), включающей данные о PlGF и sFlt-1, выявлено не было.
Важным ограничением исследования является относительно малый размер выборки. Несмотря на отбор в исследование 4000 беременных, лишь у небольшого количества из них развилась ранняя ПЭ (n=29). Следовательно, доверительные интервалы, описывающие эффективность теста, варьируют в широких пределах, в связи с чем результаты следует интерпретировать с осторожностью. Однако исследование имело строгий дизайн, и поскольку отсутствуют аналогичные более крупные исследования, оно привносит новые данные в данной области. Оно может также внести ценный вклад в будущий мета-анализ подобных исследований.
К ограничениям данного исследования следует отнести наличие высокого процента пациенток, выбывших из исследования вследствие отсутствия данных об исходах беременности, что в большой степени можно объяснить тем, что не все пациентки имели возможность родоразрешения в нашей клинике и часть информации, касающаяся течения беременности и родов, терялась. Другим возможным ограничением данного исследования является то, что женщины обращались за проведением скрининга первого триместра в нашу федеральную клинику самостоятельно. Они представляли все регионы России, но преимущественно – городское население центрального региона страны, в основном Москвы и Московской области, что могло вносить смещение в этнический и социально-экономический состав изучаемой когорты и вызывать вопросы относительно того, могут ли полученные результаты быть генерализованы на всю популяцию женщин России. Однако мы выявили, что участвующие женщин были сравнимы с общей популяцией беременных в отношении курения, возраста, ИМТ, кардиоваскулярных рисков.
В отношении внешней валидации в литературе имеются противоречивые результаты. Некоторые модели показали похожий уровень эффективности, когда использовались в условиях отличных от существовавших при разработке моделей [29, 30], в то время как другие демонстрировали более низкую оценку [31, 32]. Farina и соавт. изучили внешнюю валидацию 8 прогностических моделей на позднюю ПЭ в когорте 554 проспективно отобранных европейских пациенток [32]. Они показали, что 5 моделей не достигли частот выявления, полученных в оригинальных работах с отрицательной разницей в прогностической чувствительности, варьирующейся от 2,5 до 6,8%. Farina и соавт. пришли к выводу, что смешанные прогностические модели, содержащие данные о материнских факторах риска и биомаркерах, обладают наибольшей воспроизводимостью результатов. Работа Oliveira и соавт. [31] показала, что среди восьми алгоритмов, которые были применены при анализе когорты населения США, лишь один достиг эффективности, сопоставимой с таковой, полученной при создании модели. Следует отметить, что эта подвергшаяся внешней валидации модель также разрабатывалась на популяции США [14]. Наши данные согласуются с заключением Oliveira и соавт. [31], что эффективность модели зависит от сходства профиля риска изучаемой популяции.
Poon и соавт. выполняли свое исследование в клинике Великобритании третьего уровня, в популяции, характеризующейся большой долей пациентов афро-карибского происхождения, высокой долей пациенток с сердечно-сосудистыми факторами риска [20]. Модель Parra-Cordero была разработана на латиноамериканской популяции в Чили [12]. Crovetto и соавт. изучали европейскую средиземноморскую популяцию, обычно ассоциированную с невысоким уровнем кардиоваскулярного риска [23]. Учитывая эти различия, было важно показать, насколько эффективны или не эффективны алгоритмы в когорте беременных из России. Poon и соавт. [20] сообщили, что 95% случаев ранней ПЭ могут прогнозироваться в ходе скрининга первого триместра (при частоте ложноположительных результатов 10%), что вдвое ниже, чем в нашем исследовании (47,4%). Аналогичная ситуация для алгоритмов Parra-Cordero и соавт. – 46 против 32% в нашем исследовании, Crovetto и соавт. – 91 против 58% в нашем исследовании для ранней ПЭ.
К отличительным чертам хорошего теста на ПЭ относятся простота, скорость, неинвазивность, невысокая стоимость, легкость выполнения и отсутствие риска значимого дискомфорта для пациентов [22]. Внедрение оценки дополнительных параметров, требуемых для проведения скрининга в 11–13+6 недель беременности на ПЭ, не вызвало у нас затруднений, хотя следует обратить внимание на надлежащий тренинг по выполнению допплерометрии маточных артерий и обеспечению процесса поддержки качества выполнения исследований.
Скрининг является ценным только при наличии терапевтических вмешательств, которые могли бы улучшить исходы заболевания. Крупные обзоры выявляют небольшое, но значимое снижение риска ПЭ в случае назначения низких доз аспирина [9]. На стадии разработки находится ряд перспективных терапевтических подходов, направленных на улучшение роста плода и профилактику неблагоприятных неонатальных исходов [33].
Данное исследование подтверждает, что многофакторные скрининговые алгоритмы, предложенные Фондом медицины плода и другими исследователями для раннего прогнозирования ПЭ эффективны при обследовании российской популяции. Отношение правдоподобия положительного результата, отражающее одновременно и чувствительность, и специфичность теста, показывает, что вероятность положительного теста у пациенток с ПЭ была в 3–5 раз выше, чем вероятность положительного результата теста у пациентки с неосложненным течением беременности. Если бы данные алгоритмы применялись для нашей популяции проспективно в 11+0 – 13+6 недель беременности, мы бы получили при частоте ложноположительных результатов 10% значения прогностической ценности положительного и отрицательного результата 3,6 и 99,7% соответственно. Высокие значения прогностической ценности отрицательного результата теста могли бы быть использованы для определения группы женщин с очень низким риском по развитию ПЭ с ранним началом, которые можно было бы вести в рамках программы антенатального наблюдения с низким риском. Прогностическая ценность положительного результата остается относительно низкой, означая, что у одной из каждых 29 пациенток, попавших в группу высокого риска, в действительности разовьется ПЭ с ранним началом, и это следует учитывать при планировании вмешательств в данной группе.
Эффективность многофакторных скрининговых алгоритмов может быть в дальнейшем улучшена. Материнские факторы риска ПЭ могут значительно варьировать в различных популяциях, что указывает на необходимость расчета и уточнения риска a priori в каждой конкретной популяции. Безотносительно от характеристики популяции, прогностические алгоритмы на ПЭ обладают высокой предсказательной ценностью отрицательного результата и более низкой чувствительность, если применяются на внешней популяции.
Заключение
Исследование показало, что изученные многофакторые скрининговые алгоритмы первого триместра для прогнозирования ПЭ, в числе которых алгоритм Фонда медицины плода, приемлемы для использования на российской популяции, демонстрируют одинаково высокую прогностическую ценность отрицательного результата, более низкую специфичность при внешней оценке на российской популяции в сравнении с заявленными в оригинальных исследованиях. Заслуживает дальнейшего изучения и внедрения рутинный скрининг в первом триместре на тяжелую ПЭ, который может выполняться в те же сроки беременности, что и оценка рисков на хромосомные анеуплоидии. Требуется проведение дальнейших исследований для определения наиболее оптимальных прогностических алгоритмов на ПЭ с возможным включением в них новых как эхографических, так и биохимических маркеров.



