Несмотря на достигнутые в последние десятилетия успехи в области акушерства и гинекологии, снижение перинатальной заболеваемости и смертности в России остается чрезвычайно актуальной медико-социальной проблемой, далекой от окончательного решения. До настоящего времени причины и факторы риска, определяющие уровень и темпы снижения этих показателей, все еще недостаточно изучены и обобщены. Зачастую снижение перинатальной заболеваемости происходит не от воздействия на причину их возникновения, а благодаря успехам неонатологов.
Одним из наиболее рациональных направлений, способствующих решению проблемы невынашивания беременности, является выделение среди беременных групп риска и их мониторирование. Это позволит определить новые подходы к ведению беременности, учесть и использовать все возможные профилактические и лечебные мероприятия.
В последние годы в зависимости от акушерского анамнеза выделяют две формы привычного невынашивания беременности (ПНБ): первичное — когда все беременности заканчивались самопроизвольными выкидышами, и вторичное – когда в анамнезе наряду с выкидышами были и/или
медицинские аборты, роды, внематочная беременность. У женщин, не имеющих живых детей, т.е. страдающих первичным привычным невынашиванием (ППН), вероятность выкидыша выше и составляет 40–45% после третьего самопроизвольного прерывания [1, 5].
Несмотря на значительные успехи, достигнутые в преодолении привычного невынашивания, дискутабельным остается вопрос о результатах этих побед. Всегда ли исход беременности и родов
приводит к рождению здорового ребенка, какие существуют резервы в улучшении перинатальных исходов у женщин с преодоленным невынашиванием?
Для получения положительного результата у женщин с привычным невынашиванием упрощенные стандартные подходы малоэффективны. И наоборот, осмысление комплексной профилактики и терапии позволяет улучшить перинатальные исходы.
Материал и методы исследования
Объектом исследования явились 266 женщин с ПНБ в анамнезе, родивших в НИИ ОММ в 2004–2009 гг., и их новорожденные.
Критериями включения являлись наличие ПНБ в анамнезе (две и более самопроизвольные потери
плода в I или II триместрах или преждевременные роды в анамнезе), наличие угрозы прерывания
беременности в I триместре, одноплодная беременность, рождение живого ребенка, отсутствие
тяжелой соматической патологии.
Критериями исключения являлись первобеременные женщины, имеющие одну самопроизвольную потерю плода в I или II триместрах, многоплодную беременность, тяжелую экстрагенитальную патологию (противопоказания для вынашивания беременности), антенатальную гибель плода при исследуемой беременности, ОРВИ в I триместре беременности.
В рамках нашей исследовательской работы произведено разделение женщин по принципу репродуктивного дебюта, в зависимости от которого были сформированы 2 группы: 175 пациенток с ППН и 91 пациентка с вторичным привычным невынашиванием (ВПН).
Клинический мониторинг состоял из детального изучения общесоматического, акушерскогинекологического анамнезов, особенностей репродуктивной функции, течения данной беременности, родов, гистологического исследования плацент. У новорожденных анализировали
течение раннего неонатального периода: весоростовые показатели, оценку по шкале Апгар, длительность нахождения в роддоме, необходимость реабилитации в детской клинике НИИ ОММ, заболеваемость.
Оценка состояния плода при беременности проводилась по данным ультразвукового исследования и кардиотокографии. В I триместре проводилась ультразвуковая сонография с определением жизнедеятельности плода, копчико-теменного размера, толщины воротникового пространства
как маркера хромосомных аномалий, оценивались экстраэмбриональные структуры (желточный мешок, амниональные и хориальные полости), состояние хориона, объем и локализация внутриматочной гематомы, состояние желтого тела. Во II и III триместрах проводилась оценка состояния плода по фетометрическим показателям, результатам плацентометрии, плацентографии, изучалось состояние маточноплацентарного кровотока, оценивался объем околоплодных вод, измерялась длина шейки
матки.
Состояние новорожденных традиционно оценивалось на первой и пятой минутах по шкале Апгар. Осмотр новорожденного невропатологом с проведением нейросонографии (НСГ) осуществлялся на 3–5 сут жизни ребенка.
У детей после рождения проводили эхокардиографическое исследование (Эхо-КГ) сердца, НСГ и УЗИ органов брюшной полости на аппарате Sigma 5000 фирмы «Kontron medical S.A.S.», Франция.
Вычисления и статистическая обработка результатов выполнены с помощью программного пакета
Microsoft Excel 2002 для Windows XP, Statistic 6.0.
Результаты исследования и обсуждение
Средний возраст пациенток в исследуемых группах достоверно отличался. Женщины с ВПН были
старше. Их возраст составил 32,43±0,50 года в отличие от женщин с ППН 29,93±0,37 (p<0, 05).
При анализе структуры имеющейся в основных группах соматической патологии достоверных различий по частоте встречаемости отдельных нозологий выявлено не было. Первое ранговое место во всех группах занимают тромбофилии, ассоциированные с беременностью и маркеры недифференцированной дисплазии соединительной ткани (НДСТ) [2]. В группе с ППН тромбофилии встречались в 44% наблюдений, а в группе с ВПН – в 48% наблюдений. Маркеры НДСТ в группе с ППН встречались у 48% женщин, а в группе с ВПН — у 44% пациенток (p≥0,05).
Заболевания сердечно-сосудистой системы встречались в группе с ППН в 40,6% случаев, а в группе с ВПН – в 36,3%. Из них синдром диспластического сердца достоверно чаще встречался в группе с ППН – 8%, а в группе с ВПН он встречался в 1% случаев (p≤0,05). Врожденные пороки сердца в 1,7% регистрировались у пациенток только группы ППН. Артериальная гипертензия выявлена в группе с ППН в 5,1%, а у женщин с ВПН – в 6,6% случаев (p≤0,05).
Для ППН характерными были артифициальные аборты в анамнезе у 16% женщин. Достоверно чаще в данной группе встречались самопроизвольные выкидыши в I триместре (74%), чем во II триместре (29%). Такая же тенденция характерна и длягруппысВПН.Удельныйвесартифициальных абортов в группе ВПН достоверно выше, чем в группе с ППН (16 и 66% соответственно) (p≤0,05). Срочных родов в анамнезе у пациенток группы ВПН в 1,5 раза больше, чем преждевременных. Удельный вес синдрома замершей беременности одинаковый в обеих группах. В группе ППН данная патология регистрировалась в 43% случаев, в группе ВПН – в 40%.
Особенностью гинекологического анамнеза группы ППН явилось то, что присутствовал широкий спектр различной патологии. Первичное бесплодие в данной группе встречалось достоверно чаще — 7,4%, в отличие от группы с ВПН, где данная патология регистрировалась в 4,4% случаев (p≤0, 05). Также в данной группе достоверно чаще регистрировалась гиперпролактинемия (4%).
При этом обращает на себя внимание высокая частота травматической деформации шейки матки
у пациенток из группы с ВПН (достоверная разница с женщинами из группы с ППН –11 и 3,4% соответственно, p≤0,05).
В ходе анализа течения беременности выявлено, что среди гестационных осложнений I триместра
у женщин всех групп превалирующей патологией стал ранний токсикоз и угроза выкидыша.
Среди женщин с ППН частота токсикоза составила 33,7±4,2%, а в группе ВПН токсикоз развился в 36,3% (р≤0,05). Угроза прерывания беременности в I триместре у пациенток протекала в двух клинических вариантах. Только с болевым синдромом (угрожающий выкидыш) и с признаками отслойки хориона в виде кровянистых выделений (начавшийся выкидыш). В группе ППН болевой синдром выступал клиническим проявлением угрозы прерывания беременности у 82% женщин, а кровянистые выделения зарегистрированы у 18% женщин. У пациенток с ВПН болевой синдром манифестирован у 78%, а кровянистые выделения – у 22% (р≤0,05).
Угроза позднего выкидыша во II триместре диагностировалась с одинаковой частотой: 62,3% в группе ППН, 70,3% в группе ВПН, так же как и угроза преждевременных родов после 28 нед гестации (III триместр) (р≥0,05). Преэклампсия легкой степени тяжести (по шкале Савельевой-Гекке) выявлялась во всех группах с примерно одинаковой частотой: 56,6±3,0% в группе ППН и 60,4±3,5% в группе ВПН (р≥0,05). Преэклампсию средней степени тяжести достоверно чаще мы наблюдали в группе ППН (8,0%), а в группе с ВПН — у 5,5% пациенток (р≤0.05). Тяжелую преэклампсию, наоборот, достоверно чаще имели пациентки из группы с ВПН — 3,3%, по сравнению с пациентками из группы с ППН — 2,3% (р≤0,05). Центральное предлежание плаценты достоверно чаще встречалось в группе с ВПН — в 3,3% случаев по сравнению с группой ППН — 0,6% (р≤0,05). Частота ОРВИ во II и III триместрах во всех исследуемых группах достоверно не различалась. Не отличался удельный вес истмико-цервикальной
недостаточности в группах. Но если в группе ППН она чаще носила функциональный характер и
была обусловлена соединительнотканной дисплазией и гиперандрогенией,то в группе ВПН изменения носили органический характер и были связаны с травматической деформацией шейки матки. Особый интерес представляло родоразрешение у пациенток в сроках недоношенной беременности. В группе с ППН 14,85% и 18,7% в группе с ВПН составили преждевременные роды ( p≥0, 05). Причем у 41% пациенток в группе ВПН в анамнезе уже были преждевременные роды.
В группе ППН преждевременные роды начались со схваток у 53,8% пациенток, с преждевременного излития околоплодных вод – у 23,0%, в 7,7% случаях произведено оперативное родоразрешение в связи с прогрессированием тяжелой преэклампсии, а также в 7,7% случаев показанием к кесареву сечению явилась задержка внутриутробного развития (ЗВУР) плода тяжелой степени. В 7,7% случаев показанием к кесареву сечению явилась прогрессирующая отслойка нормально расположенной плаценты.
В группе ВПН преждевременные роды начались со схваток у 47,0% пациенток, с преждевременного
излития околоплодных вод – у 17,6% пациенток. В 11,7% случаях произведено оперативное родоразрешение в связи с прогрессированием тяжелой преэклампсии. В 17,6% случаях показанием к кесареву сечению явилась прогрессирующая отслойка нормально расположенной плаценты. В 5,9% случае показанием к кесареву сечению явилась ЗВУР плода тяжелой степени.
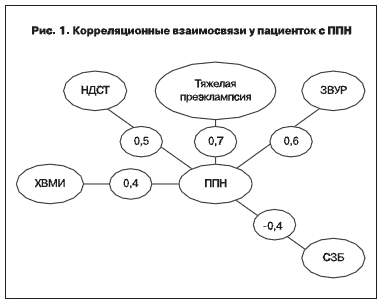
Для оценки влияния различных показателей анамнеза, течения беременности на недонашивание беременности у женщин с ППН и ВПН, были изучены корреляционные связи в исследуемых группах и определены информативные параметры риска преждевременных родов. Характер корреляционных связей представлен на рис. 1, 2. Наоснованииполученныхданныхнамивыявлены предикторы преждевременных родов для каждой из групп. Для ППН ими явились: наличие хронической внутриматочной инфекции (ХВМИ, к.а. 0,4), маркеров НДСТ у матери (к.а. 0,5), тяжелой преэклампсии (к.а. 0,7), синдрома ЗВУР (к.а. 0,6) и синдрома замершей беременности в анамнезе
(СЗБ, к.а. -0,4).
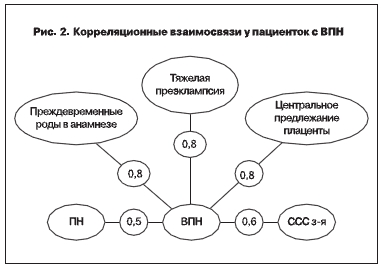
Для ВПН такими предикторами выступили преждевременные роды в анамнезе (к.а. 0,8), наличие плацентарной недостаточности (ПН, к.а. 0,5), преэклампсии тяжелой степени (к.а. 0,8), предлежания плаценты при исследуемой беременности (к.а. 0,8), заболеваний сердечно сосудистой системы пациентки (ССС з-я, к.а. 0,6).
В последнее десятилетие произошло понимание иммуномодулирующей функции эндогенного
прогестерона при беременности и его уникального свойства перепрограммировать воспалительный тип иммунного ответа с провоспалительного на противовоспалительный [3, 4]. Ряд аналогов прогестерона обладает большим сродством к прогестероновым рецепторам по сравнению с самим эндогенным прогестероном, и это открывает дополнительные лечебные возможности в условиях дефицита рецепторных площадок (как в эндометрии, так и в клетках иммунной системы). Дидрогестерон в отличие от натурального прогестерона не связывается с рецепторами глюкокортикоидов и минералокортикоидов и имеет более высокое сродство к рецепторам прогестерона. Доказана роль дидрогестерона в нормализации маточно-плацентарного кровообращения за счет повышения синтеза оксида азота (NO), который, как известно, обладает выраженным сосудорасширяющим эффектом [4, 6].
В рамках нашего исследования внутри групп были выделены женщины, которые в комплексной терапии невынашивания при данной беременности получали прогестины – дидрогестерон (дюфастон), и те, кто по какой-либо причине их не получал. В группе ППН получали прогестины 65% женщин, а в группе ВПН – 68%. Дидрогестерон назначали с 5-й нед гестации. Средняя суточная доза составляла 20 мг, при наличии кровянистых выделений 40 мг однократно, а затем по 10 мг каждые 8 ч до исчезновения симптомов с переходом на поддерживающую дозировку 20 мг/сут.
Женщины, у которых степень выраженности угрозы прерывания в I триместре была более выражена, прогестины применяли достоверно чаще. Прогестины являются патогенетически обоснованной частью комплексной терапии угрозы прерывания беременности в I и II триместрах. На фоне приема дидрогестерона отмечается значительное снижение удельного веса угрозы прерывания беременности: в группе ППН во II триместре (61%), в III триместре – 32% , а в группе ВПН – во II триместре 50%, в III триместре 14% (р≤0,05). Тенденция к снижению частоты угрозы прерывания беременности по триместрам отмечена и у женщин, не принимавших прогестины в силу каких-либо причин, однако темп снижения был неудовлетворительным.
У пациенток, принимавших дидрогестерон в комплексной терапии, компенсированные формы
ПН регистрированы чаще: в 81% случаев – при ППН, в 76% – при ВПН. Удельный вес компенсированных форм ПН у пациенток, не принимавших прогестины, достоверно меньше: в группе ППН – 56%, среди пациенток с ВПН – 62% (р≤0,05). В исследуемых группах прерываний беременности в сроках позднего выкидыша не зарегистрировано. Удельный вес преждевременных родов в группах, принимавших дидрогестерон, составил для ППН – 9%, для ВПН – 11%, среди женщин, не принимавших прогестины, – 18% при ППН и 21% – при ВПН (р≤0,05).
Таблица. Оценка по шкале Апгар новорожденных от женщин, получавших прогестины в группах ППН и ВПН (в баллах).
Среди недоношенных превалировали дети, ро дившиеся массой тела более 2000 г. Новорожденные от матерей, получавших прогестины при беременности, достоверно чаще имели более высокую оценку по шкале Апгар на 1-й и 5-й мин после рождения (см. таблицу).
В заболеваемости новорожденных исследуемых групп доминировала асфиксия умеренной степени, при этом в подгруппах с начавшимся выкидышем I триместра она была достоверно выше: при ППН – 25,7±3 и 45,5±9%, при ВПН – 29,6±5 и 52,4±10% (р≤0,05). Асфиксия тяжелой степени, дыхательные нарушения, аспирационный синдром, перинатальные инфекции и церебральная ишемия также достоверно чаще регистрировали в подгруппах с клиникой начавшегося выкидыша в I триместре. Установлено, что 40% детей имели отклонения в адаптации сердечно-сосудистой системы после рождения в основном за счет сохранения стойкого фетального кровообращения новорожденных во всех группах.
При Эхо-КГ исследовании обнаружены дополнительные хорды левого желудочка у 50–66% обследованных новорожденных, вероятнее всего, связанные с гипоксическими нарушениями в
эмбриональном периоде, которые привели к нарушению отшнуровки папиллярных мышц примитивного сердца [3]. В подгруппах женщин с начавшимся выкидышем в I триместре достоверно чаще регистрированы множественные аномально расположенные хорды (рис. 3).
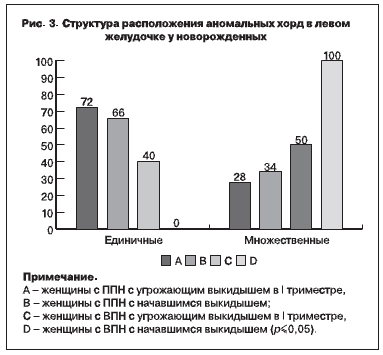
Заключение
Таким образом, правомочность выделения двух форм привычного невынашивания беременности — первичного и вторичного, подтверждена данными анамнеза, а также особенностями течения беременности и перинатальных исходов.
Предикторы преждевременных родов для женщин с ПНБ в анамнезе отличаются в зависимости от репродуктивного дебюта. Для ППН ими явились ХВМИ, маркеры НДСТ у матери, тяжелая преэклампсия, синдром ЗВУР и СЗБ в анамнезе. Для ВПН такими предикторами выступили преждевременные роды в анамнезе, наличие ПН, преэклампсии тяжелой степени, заболеваний сердечно сосудистой системы, предлежание плаценты.
Формированию гемодинамически значимых аномально расположенных дополнительных хорд левого желудочка способствует начавшийся выкидыш в I триместре у матери.
Включение дидрогестерона (дюфастон) в комплексную терапию угрозы прерывания беременности у женщин с первичным и вторичным привычным невынашиванием позволяет снизить удельный вес персистирующей угрозы прерывания и оказывает протективное действие на факторы, определяющие досрочное родоразрешение у пациенток этих групп и на раннюю неонатальную адаптацию их новорожденных.



