Анемия – это клинико-гематологический синдром, характеризующийся уменьшением количества эритроцитов и гемоглобина в единице объема крови. Причиной анемии служат самые разнообразные патологические процессы, поэтому анемия часто является симптомом какого-либо основного заболевания [1]. К возникновению анемии могут привести острые или хронические кровопотери (постгеморрагические анемии), невозможность образования новых эритроцитов (дефицитные и гипопластические анемии) или усиленное их разрушение (гемолитические анемии) [2, 3].
Самыми частыми (около 80% всех анемий) являются железодефицитные анемии (ЖДА), связанные с недостатком в организме железа. По данным ВОЗ ЖДА находится в перечне самых распространенных заболеваний. Около 1,8 млрд населения планеты страдают железодефицитной анемией [4]. Наиболее часто заболевание фиксируется у женщин детородного периода, в России этот показатель составляет 12%, а латентный дефицит железа в некоторых районах достигает 50% [5, 6]. За последние 10 лет частота ЖДА в России увеличилась в 6,3 раза.
Железо является незаменимым элементом, играющим важную роль в функционировании клеток многих систем организма. Железо необходимо для работы внутриклеточных ферментов (каталаз, пероксидаз) и клеточного дыхания (цитохром), оно участвует в синтезе ДНК и регуляции клеточного цикла, обеспечивает сокращение поперечнополосатых мышц (миоглобин), влияет на иммунитет, участвуя в пролиферации Т-лимфоцитов, модулирует эффект инсулина. Но прежде всего железо необходимо для синтеза гемоглобина, осуществляющего доставку кислорода клеткам.
Железо поступает в организм с пищей. Около 10% пищевого железа абсорбируется в двенадцатиперстной кишке и начальном отделе тонкой кишки. Различают два вида железа: гемовое и негемовое. Гемовое железо, входящее в состав гемоглобина, содержится лишь в мясных продуктах, хорошо всасывается (на 20–30%), на его всасывание практически не влияют другие компоненты пищи. Негемовое железо (содержится преимущественно в овощах) находится в свободной ионной форме в виде трехвалентного железа (Fe+3). Степень его усвоения ниже, чем у гемового, и зависит от целого ряда факторов. Из продуктов питания усваивается только двухвалентное негемовое железо, которое восстанавливается из трехвалентного под воздействием соляной кислоты. В процессе всасывания в клетках слизистой оболочки кишечника железо окисляется и снова переходит в трехвалентное состояние. Переносчиком железа в организме является белок трасферрин, который разносит его к гемопоэтическим тканям и местам депонирования. Депонируется железо преимущественно внутриклеточно в виде белка ферритина. В среднем 1 молекула ферритина содержит около 2000 атомов трехвалентного железа. Ферритин, циркулирующий в крови, практически не участвует в депонировании железа, однако его уровень коррелирует с уровнем депонированного железа. Существует еще одна форма ферритина – кристаллизованная (гемосидерин), которая образуется после гематом, внутримышечных инъекций препаратов железа. Гемосидерин не растворяется в воде, железо из него мобилизуется с большим трудом. В плазму также поступает железо разрушившихся эритроцитов после распада миоглобина, тканевых ферментов. Выводится железо со стулом, мочой, потом, при удалении волос, ногтей, а у женщин – с менструальной кровью. Суточная потребность в железе у здоровых женщин составляет 2 мг.
Существует несколько причин развития ЖДА [2, 7–9]:
- Хронические кровопотери, в том числе маточные.
- Нарушения всасывания железа, связанные в основном с патологией желудочно-кишечного тракта.
- Повышенная потребность в железе при беременности, лактации, в период интенсивного роста
- Недостаточное поступление железа с пищей.
Этиопатогенетической основой для возникновения ЖДА является дефицит железа. Дефицит железа условно делится на несколько стадий [10, 11]:
- прелатентный дефицит железа (истощение запасов железа в депо), при котором отмечается снижение уровня ферритина, содержания железа в костном мозге, повышена абсорбция железа;
- латентный дефицит железа (железодефицитный эритропоэз) – дополнительно снижается сывороточное железо (транспортное железо);
- выраженный дефицит железа, что соответствует ЖДА, – дополнительно снижается концентрация гемоглобина, эритроцитов и гематокрит.
В период скрытого дефицита железа пациенты отмечают общую слабость, недомогание, снижение работоспособности. Могут наблюдаться извращение вкуса, нарушение глотания с ощущением инородного тела в горле, сердцебиение, одышка. Объективно обнаруживаются «малые симптомы дефицита железа»: атрофия сосочков языка, хейлит, сухость кожи и волос, ломкость ногтей, жжение и зуд вульвы. Все эти признаки нарушения трофики эпителиальных тканей связаны с тканевой сидеропенией и гипоксией [1, 12].
При развитии ЖДА эти симптомы усиливаются – возникают мышечная слабость, сонливость, головная боль, головокружение, возможны обмороки, снижается аппетит. Выраженность жалоб зависит не от уровня гемоглобина, а от продолжительности заболевания и возраста больных. Специфичны изменения ногтей: они становятся тонкими, матовыми, уплощаются, легко расслаиваются и ломаются, появляется исчерченность [1, 2].
При лабораторной диагностике кроме снижения гемоглобина, эритроцитов, цветового показателя и гематокрита следует обращать внимание на снижение индексов эритроцитов: среднее содержание гемоглобина в эритроците, средняя концентрация гемоглобина в эритроците, средний объем эритроцита [13, 14]. При ЖДА микроскопия мазка крови выявляет следующие изменения эритроцитов – они становятся гипохромными с увеличением зоны просветления в середине (анулоцитоз), мелкими (микроцитоз), разной формы (пойкилоцитоз) и интенсивности окраски (анизохромия). Содержание лейкоцитов и тромбоцитов чаще остается в пределах нормы.
Биохимическими маркерами дефицита железа и ЖДА являются снижение содержания ферритина и железа в сыворотке крови, повышение общей железосвязывающей способности сыворотки (ОЖСС), определяющей, сколько железа может связать весь трансферрин плазмы [14–16]. Начинающийся (прелатентный) дефицит железа можно определить по снижению уровня ферритина еще до исчерпания запасов железа, при сохранении нормальной концентрации железа и трансферрина в сыворотке крови. Однако этот показатель имеет значение при отсутствии воспалительных процессов, сопровождающихся повышением содержания С-реактивного белка. Только уровень ОЖСС при ЖДА всегда повышен. К сожалению, ни один биохимический показатель нельзя рассматривать как абсолютный диагностический критерий ЖДА. В то же время морфологическая характеристика эритроцитов периферической крови является решающей в скрининговой диагностике ЖДА.
Лечение ЖДА должно быть направлено не только на ликвидацию анемии как симптома, но и на устранение дефицита железа и восполнение его запасов в организме. Безусловно, необходимо установить и по возможности устранить непосредственную причину возникновения ЖДА [3, 15, 17].
Больным ЖДА рекомендуется употреблять больше мясных продуктов, содержащих гемовое железо, белка, витаминов [6, 18]. Следует отметить, что железо из растительных продуктов усваивается плохо (всего 3–5%). С пищей поступает 18 мг железа, при этом всасывается 1–1,5 мг. Даже пpи идеальной диете усвоение железа достигает лишь 2–2,5 мг в сутки, поэтому дефицит железа можно устранить лишь его препаратами. Из лечебных препаратов всасывание железа в 15–20 раз больше, чем из продуктов питания.
В настоящее время в распоряжении врача имеется большой арсенал лекарственных препаратов железа, характеризующихся различным составом, свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов, различных лекарственных форм. Идеальный железосодержащий препарат должен обладать минимальным количеством побочных эффектов, иметь простую схему применения, оптимальное содержание железа. Препараты для лечения железодефицитной анемии назначают преимущественно перорально [19]. Парентеральное введение используется при непереносимости пероральных форм или нарушении всасывания железа в желудочно-кишечном тракте, а также в случаях жизненной необходимости быстрого восполнения дефицита железа, и только после определения показателей обмена железа (риск передозировки).
Гемотрансфузии проводят только по жизненным показаниям, руководствуясь не уровнем гемоглобина, а состоянием пациента [14, 19] .
Для перорального применения используют либо соли двухвалентного железа (сульфат, глюконат, фумарат), либо комплексные препараты. Однако лечение наиболее часто используемыми препаратами железа, например, сульфатом железа, вызывает побочные реакции у 10–40% пациентов в виде диареи, запора, анорексии. Симптомы дисфункции верхних отделов желудочно-кишечного тракта появляются обычно в течение 1 часа после приема лекарства и могут протекать как в легкой (тошнота или дискомфорт в эпигастральной области), так и в тяжелой форме – с болью в животе или рвотой. В этих случаях препараты рекомендуют принимать не до еды, а после, хотя всасывание железа значительно снижается. Наиболее опасным можно считать возможность язвенного поражения двенадцатиперстной кишки. Такая вероятность обусловлена образованием свободных радикалов при окислении двухвалентного железа в трехвалентное после всасывания в кишечнике, что обозначается как оксидативный стресс, способный оказывать негативное влияние на физиологические процессы в различных органах и тканях [20]. В этом отношении наиболее безопасным препаратом железа представляется мальтофер. Мальтофер содержит железо в виде полимальтозного комплекса гидроокиси железа III). Мальтоза стабилизирует и солюбилизирует гидроксид железа за счет поверхностного взаимодействия. Образовавшиеся комплексы представляют водорастворимую биодоступную форму гидроокиси железа, эффективно выделяющий ионы железа. Железо, входящее в состав полимальтозного комплекса гидроксида железа (III), не обладает прооксидантными свойствами, в отличие от простых солей железа. Структура мальтофера сходна с естественным соединением железа ферритина. Благодаря такому сходству железо (III) поступает из кишечника в кровь путем активного транспорта. Всосавшееся железо связывается с ферритином и хранится в организме в ретикуло-эндотелиальной системе. Затем в костном мозге оно включается в состав гемоглобина. Поэтому профиль безопасности мальтофера значительно выше, чем у других препаратов железа 14, 15, 21–23].
Мальтофер не вступает в значимые взаимодействия с какими-либо продуктами питания, компонентами пищи или лекарствами, поэтому его можно принимать независимо от приема пищи.
Необходимо иметь в виду, что адекватный прирост показателей гемоглобина у больных ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг элементарного железа, так как при развитии ЖДА всасывание железа увеличивается по сравнению с нормой, составляя 25–30%. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается [18].
Терапия не должна прекращаться после нормализации уровня железа, так как геминный фонд восстанавливается первым, только затем тканевый и резервный. Продолжительность лечения, таким образом, должна составлять не менее трех месяцев (иногда до 4–6 месяцев).
Ниже приводится опыт применения мальтофера для лечения ЖДА у пациенток с гинекологической патологией.
Проводили обследование и лечение 68 пациенток с ЖДА в возрасте от 21 до 45 лет. Первую группу составили 30 пациенток, корригирующие ЖДА сульфатом железа перорально 3 раза в день в суммарной дозе 200 мг/сут (в пересчете на элементарное железо). Вторую группу образовали 38 пациенток, принимавшие препарат мальтофер перорально по 100 мг 2 раза в день. Длительность терапии составила 3 месяца.
Анемия легкой степени была установлена у 47, а анемия средней степени – у 21 больной. Причинами анемии являлись хронические маточные кровопотери, как обусловленные органической патологией – миомой матки (23), аденомиозом (13), гиперпластическими процессами эндометрия (6) или их сочетанием (18), так и дисфункциональные маточные кровотечения (8). Перед назначением антианемической терапии 42 пациенткам для уточнения состояния эндометрия была проведена гистероскопия, раздельное диагностическое выскабливание слизистой матки.
Заболевания желудочно-кишечного тракта (гастрит, колит, язвенная болезнь желудка и двенадцатиперстной кишки) диагностированы у каждой третьей пациентки – 24 (35,3%).
 Клиническими проявлениями железодефицитной анемии у обследованных пациенток были: общая слабость и повышенная утомляемость у 25 (37,8%), снижение работоспособности – у 8 70,6%), головокружение – у 23 (33,8%), головная боль – у 17 (25,0%), приступы тахикардии у 15 (22,1%), одышка – у 14 (20,5%), мышечная слабость – у 20 (29,4%), извращение вкуса – у 13 (19,1%). Сухость кожи, характерные для ЖДА изменения ногтей и волос наблюдалось у 21 (30,9%). Наиболее выраженная симптоматика отмечалась при анемии средней степени тяжести.
Клиническими проявлениями железодефицитной анемии у обследованных пациенток были: общая слабость и повышенная утомляемость у 25 (37,8%), снижение работоспособности – у 8 70,6%), головокружение – у 23 (33,8%), головная боль – у 17 (25,0%), приступы тахикардии у 15 (22,1%), одышка – у 14 (20,5%), мышечная слабость – у 20 (29,4%), извращение вкуса – у 13 (19,1%). Сухость кожи, характерные для ЖДА изменения ногтей и волос наблюдалось у 21 (30,9%). Наиболее выраженная симптоматика отмечалась при анемии средней степени тяжести.
Возраст, частота экстрагенитальной патологии, длительность течения и характер ЖДА у пациенток исследуемых групп не имели достоверных различий.
Основанием для постановки диагноза наряду с клиническими данными стали результаты лабораторных исследований: снижение гемоглобина (ниже 115 г/л), гематокрита (ниже 35%), цветового показателя (ниже 0,85). Эритроцитарные индексы у обследованных были также снижены.
Железо сыворотки не фиксировалось выше 9 мкмоль/л. Для изучения запасов железа определяли общую железосвязывающую способность сыворотки (ОЖСС) – более 70 мкмоль/л, ферритин сыворотки крови – менее 10 мкг/л.
Кроме восполнения недостатка железа в организме проводили корригирующее лечение основных гинекологических заболеваний для уменьшения возможности кровопотери.
Эффективность терапии препаратами железа контролировали на основании изменения клинической картины (улучшение самочувствия больных, исчезновение жалоб), а также по результатам гематологических и феррокинетических параметров: концентрации гемоглобина, количества эритроцитов, уровня гематокрита, концентрации ферритина и сывороточного железа.
Уже через 4 недели от начала лечения в обеих группах отмечена существенная положительная динамика клинической картины – жалобы на слабость, недомогание, забывчивость, головокружение, одышку, сухость кожи и слизистых, мышечную слабость, боли в области сердца, ломкость ногтей исчезли, самочувствие значительно улучшилось. Пациентки ощущали прилив сил. Показатели гемоглобина, эритроцитов, гематокрита нормализовались в 1-й группе у 27, во 2-й у 35 пациенток.
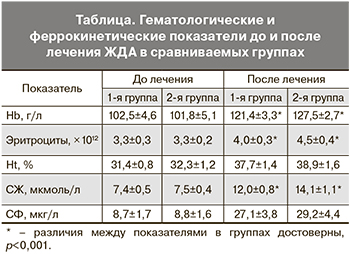
Через 3 месяца от начала терапии зафиксирован достоверный рост гематологических и феррокинетических показателей в сравнении с исходным уровнем (таблица).
Как следует из данных таблицы, эффективность лечения была несколько выше в группе, получавшей мальтофер (достоверные различия по приросту гемоглобина, эритроцитов и железа сыворотки).
Более выраженные отличия отмечены в группах по показателям переносимости сульфата железа и полимальтозата. При приеме сульфата железа фиксировались тошнота (3), рвота (1), запоры (5), дискомфорт в области эпигастрия (2), неприятный привкус во рту (4). В силу нежелательных явлений 2 пациентки отказались от длительного использования сульфата железа. При клиническом наблюдении за пациентками 2-й группы отмечена хорошая переносимость мальтофера – только 2 из 37 пожаловались на запоры, однако отказа от приема препарат не отмечено. Аллергических реакций в обеих группах не наблюдали.
Таким образом, результаты проведенного исследования указывают, что препарат мальтофер безопасен и высокоэффективен для лечения ЖДА у женщин с различной гинекологической патологией.



