Преждевременный разрыв плодных оболочек (ПРПО) осложняет 4% всех беременностей, составляет 45% преждевременных родов и является одной из основных причин перинатальных потерь [1–3].
ПРПО при недоношенном сроке беременности, приводящий к массивной потере амниотической жидкости, способствует не только перинатальным потерям, но и развитию многочисленных перинатальных осложнений: легочной гипоплазии, некротизирующего энтероколита, неонатальному сепсису, неврологическим проблемам, внутрижелудочковым кровоизлияниям, деформации суставов, респираторному дистресс-синдрому плода [4].
В современной литературе отсутствует однозначное мнение об этиологии и патогенезе ПРПО. В последнее время появились исследования, посвященные роли усиленной экспрессии матричной металлопротеиназы, провоспалительных цитокинов – интерлейкина-1 (ИЛ-1), интерлейкина-6 (ИЛ-6), фактора некроза опухоли-α (TNF-α) и многих других [5–9]. Особый интерес представляет верификация ключевых сигнальных молекул, обеспечивающих целостность плодных оболочек и разработка на этой основе программ, позволяющих оптимизировать прогноз при ПРПО [5].
Воспаление в системе мать-плод, как известно, участвует в патогенезе преждевременных родов. Интерлейкин-27 (ИЛ-27) может являться посредником воспалительного ответа при некоторых осложнениях беременности. N. Yin и соавт. (2017) впервые сообщали, что при аберрантной экспрессии ИЛ-27 может выступать посредником в чрезмерной воспалительной реакции в плодных оболочках, что способствует началу преждевременных родов [10].
В исследовании J. Armstrong-Wells (2015) воспаление со стороны плода и плаценты было связано с повышенным уровнем материнских интерлейкинов (ИЛ-6 и ИЛ-8) при родах и плодовых интерлейкинов (ИЛ-1β, ИЛ-6, ИЛ-8 и TNF-α). При этом неблагоприятный неврологический исход у новорожденных был связан с воспалением со стороны плода и плаценты и коротким промежутком времени от момента ПРПО до родов, независимо от гестационного возраста при рождении или результатов ультразвукового исследования головного мозга [9].
Также установлено, что ассоциированные с окислительным стрессом повреждения мембраны эмбриона и остановки клеточного цикла могут определять неблагоприятные исходы беременности, такие как спонтанные преждевременные роды и ПРПО. Стресс-ассоциированные окислительные повреждения молекулярных сигнальных путей могут позволить врачам дифференцировать между спонтанными преждевременными родами и преждевременными родами вследствие ПРПО [11].
В настоящее время у беременных с олиго- и ангидрамнионом после ПРПО приоритетной является выжидательная тактика с проведением антибактериальной терапии, токолиза и антенатальным введением кортикостероидов для профилактики респираторного дистресс-синдрома плода [12–14].
Высокая частота развития серьезных акушерских и перинатальных осложнений, которые являются следствием ПРПО, диктуют необходимость поиска совершенно новых высокотехнологичных методов лечения. В последние годы за рубежом активно проводят исследования по применению амниоинфузии с целью пролонгирования беременности у женщин с ПРПО и маловодием, прежде всего в интересах плода [4, 15–18].
Проведенные в зарубежных клиниках немногочисленные исследования предполагают с целью повышения выживаемости крайне недоношенных новорожденных использовать в случаях ПРПО периодически повторяемые амниоинфузии для поддержания нормального объема околоплодных вод [15–17]. Проведенный анализ показал, что первый опыт применения трансабдоминальных амниоинфузий, особенно при гестационном сроке менее 26 недель, позволяет надеяться на позитивный перинатальный исход. Однако периодически повторяющиеся амниоинфузии опасны возможной травматизацией плода и инфицированием [18, 19].
М. Tchirikov впервые предложил методику постоянной амниоинфузии через подкожно имплантируемую порт-систему. Использование этой технологии позволило автору не только избежать осложнений, характерных для периодической амниоинфузии, но и пролонгировать беременность у 7 женщин после ПРПО в среднем на 49 дней на фоне семидневной антибиотикотерапии. Преимущество данной методики связано, в первую очередь, с осуществлением постоянного вымывания из полости матки бактерий и факторов воспаления [4, 19].
В настоящее время продолжаются исследования, изучающие эффективность амниоинфузии после ПРПО при олиго-/ангидрамнионе, но нет достаточного числа исследований, сравнивающих акушерские и перинатальные результаты после выжидательного консервативного лечения и такого инвазивного вмешательства, каковым является амниоинфузия.
Цель исследования: оценка эффективности постоянной амниоинфузии в сочетании с антибактериальной терапией у беременных с ПРПО и олиго/ангидрамнионом при сроке беременности от 22 до 28 недель на примере продемонстрированного в данной статье собственного клинического случая.
Материал и методы исследования
В 2016 году в Красноярском краевом клиническом центре охраны материнства и детства (ККК ЦОМД) было начато международное рандомизированное проспективное исследование по изучению эффективности метода непрерывной трансабдоминальной амниоинфузии (НТАИ) с использованием имплантируемой подкожной порт-системы для пролонгирования беременности при ПРПО, поддержанное международным грантом и спонсируемое Университетской клиникой и Центром фетальной хирургии (Халле, Германия), а также Российским научным фондом (№ 15-15-00137). В этой статье мы представляем наш первый опыт проведения метода НТАИ.
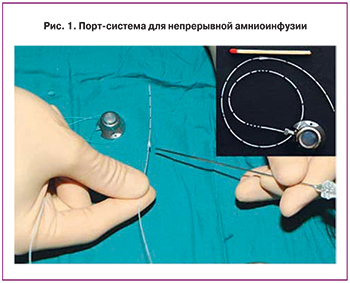 Пациентка была тщательно отобрана, согласно положениям протокола исследования, который содержит критерии включения и исключения. Критерии включения: одноплодная беременность, классический вариант ПРПО, наличие олиго- или ангидрамниона при сроке от 22 до 28 недель беременности. Критерии исключения: внутриутробная гибель плода, эмбриональные хромосомные аберрации, пороки развития плода, высокий надрыв плодных оболочек, начавшиеся преждевременные роды, клинически и лабораторно подтвержденный хорионамнионит. Всем регламентированным в исследовании параметрам включения пациентка полностью соответствовала, при этом критерии исключения отсутствовали.
Пациентка была тщательно отобрана, согласно положениям протокола исследования, который содержит критерии включения и исключения. Критерии включения: одноплодная беременность, классический вариант ПРПО, наличие олиго- или ангидрамниона при сроке от 22 до 28 недель беременности. Критерии исключения: внутриутробная гибель плода, эмбриональные хромосомные аберрации, пороки развития плода, высокий надрыв плодных оболочек, начавшиеся преждевременные роды, клинически и лабораторно подтвержденный хорионамнионит. Всем регламентированным в исследовании параметрам включения пациентка полностью соответствовала, при этом критерии исключения отсутствовали.
Непрерывная амниоинфузия осуществлялась по методике, разработанной и выполненной в 2013 году немецкими специалистами, через введенную подкожно в области передней брюшной стенки портовую систему (Tchirikov Perinatal Port System, PakuMed GmbH, Germany) [19]. Согласно этой методике выполняются следующие манипуляции и требования: под контролем ультразвука с использованием иглы 18G проводят пункцию амниотической полости, катетер вводят в амниотическую полость через иглу со стилетом 1 French, соединяют катетер и капсулу порта, порт устанавливают в подготовленный подкожный карман и фиксируют лигатурами, скорость введения жидкости – 100 мл/час, объем вводимой жидкости – 2400 мл/сутки, поддержание высоты водного «кармана» околоплодных вод – на уровне 4±2 см (рис. 1, 2). Для амниоинфузии мы использовали гипотонический водный раствор с пониженным содержанием хлорида и концентрацией электролитов, подобной их концентрации в околоплодных водах беременных женщин [4].
В процессе ведения пациентки нами осуществлялось динамическое наблюдение: ежедневное измерение окружности живота и высоты дна матки, контроль качества и характера околоплодных вод, исследование уровня лейкоцитов крови с интервалом в 12 часов, иммунологические исследования (С-реактивный белок (СРБ), интерлейкин-6 (ИЛ-6) и прокальцитониновый тест (ПКТ)) – с кратностью каждые 5 дней, а также бактериологические исследования (вагинальный биотоп и околоплодные воды) – с кратностью каждые 5 дней.
Результаты исследования
Пациентка В.Ю., 37 лет, поступила в перинатальный центр с жалобами на подтекание околоплодных вод в течение трех часов к моменту госпитализации при сроке беременности 25 недель. Из акушерского анамнеза установлено, что настоящая беременность по счету четвертая, были одни срочные роды, два прерывания беременности в ранних сроках. Соматический анамнез отягощен желчекаменной болезнью. Во время настоящей беременности при сроке 3–4 недели была выполнена лапароскопическая холецистэктомия, осложнившаяся продолжающимся постхолецистэктомическим синдромом, отмечена вегето-сосудистая дистония по гипотоническому типу.
При поступлении пациентке был проведен традиционный объективный осмотр, наружное акушерское обследование, исследование при помощи акушерских зеркал, тест на наличие околоплодных вод «Amni Shure». По результатам осмотра в зеркала установлено: наружные половые органы правильно сформированы, признаков воспалительного процесса во влагалище нет, шейка матки обычной формы, наружный зев цервикального канала сомкнут, подтекают светлые околоплодные воды в умеренном количестве. Тест «Amni Shure» показал положительный результат.
Диагноз при поступлении: Беременность 25 недель. ПРПО. Тазовое предлежание плода. Отягощенный акушерский анамнез. Постхолецистэктомический синдром. Вегето-сосудистая дистония.
Коллегиально был составлен план ведения пациентки, предусматривающий пролонгирование беременности с применением метода НТАИ. Получено информированное согласие пациентки на проведение данного метода и включение в исследование. Предварительный план родов предусматривал родоразрешение путем операции кесарева сечения ввиду тазового предлежания плода и малого срока гестации.
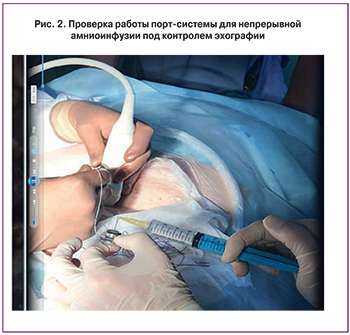 В ходе проведенного ультразвукового исследования было установлено, что свободный карман амниотической жидкости составил 2,4 см. По результатам допплерометрии гемодинамических нарушений маточно-плацентарного, пуповинного и плодового кровообращения не выявлено.
В ходе проведенного ультразвукового исследования было установлено, что свободный карман амниотической жидкости составил 2,4 см. По результатам допплерометрии гемодинамических нарушений маточно-плацентарного, пуповинного и плодового кровообращения не выявлено.
При поступлении был осуществлен забор всех необходимых клинико-лабораторных анализов, в том числе проведен забор материала из заднего свода влагалища на микроскопическое исследование и бактериологическое исследование состава вагинальной микрофлоры. Сразу была назначена антибактериальная терапия амоксициллином в режиме 2 грамма каждые 6 часов – в течение первых 48 часов, затем по 250 мг – каждые 8 часов. Для достоверного подтверждения ПРПО был проведен трансабдоминальный амниоцентез с введение индигокармина, получен положительный результат.
Полученные при поступлении пациентки результаты исследования, отражающие качественный и количественный состав микроорганизмов вагинального биотопа, показали, что при микроскопическом исследовании мазков на флору выявлен воспалительный процесс – количество лейкоцитов в мазке из заднего свода влагалища – до 50 единиц в поле зрения, из уретры и цервикального канала – до 10 единиц в поле зрения. Флора во всех порциях представлена Грам-положительными палочками (Дедерлейна). При бактериологическом исследовании получен обильный рост Lactobacillus crispatus.
Проведенное ранее исследование в нашем центре по изучению состояния вагинального биотопа у беременных с ПРПО (n=35), показало, что у таких пациенток в 49% случаев характер вагинальных мазков соответствовал нормоценозу. При этом дисбиотический тип мазка отмечался в 12% cлучаев (n=12), а явно воспалительный тип – в 17% случаев (n=6).
Согласно данным, представленным П.В. Козловым с соавт., превалирующими микроорганизмами у беременных с ПРПО являются грамотрицательные палочки семейства Enterobacteriaceae [20]. В этом исследовании состав выделенных культур микроорганизмов, наиболее часто встречающихся в цервикальном канале при ПРПО и недоношенной беременности, был представлен следующим образом: 1) Enterobacteriaceae – 47,9%, (Escherichia coli – 31,6%, Enterobacter – 9,2%, Klebsiella pneumoniae – 7,1%); 2) Streptococcaceae – 28,6%, (Streptococcus haemolyticus – 8,2%, Streptococcus agalactiae – 9,2%, Enterococcus – 11,2%); 3) Micrococcaceae (Staphylococcus epidermidis – 23,5%).
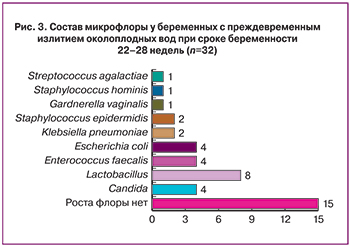
При исследовании состава микрофлоры у беременных с ПРПО в нашем ККК ЦОМИД в 53,1% случаев были выявлены представители условно-патогенной микрофлоры. В большинстве случаев роста микрофлоры не отмечалось, преобладали посевы с лактобактериями, а также микроорганизмами – представителями кишечной группы бактерий (рис. 3).
Перед проведением амниоинфузии повторно было проведено исследование вагинальных мазков, окрашенных по Граму. Результаты этого исследования соответствовали нормальному типу мазка, содержание лейкоцитов не превышало 10–15 единиц в поле зрения, микрофлора была представлена грамположительными палочками Дедерлейна. Показатели периферической крови беременной также соответствовали норме: уровень лейкоцитов составил 12,5×109/л, нейтрофилов – 88%, лимфоцитов – 7,4%. Показатель СРБ незначительно превышал нормативный уровень – 0,3 мг/дл, значение ПКТ 0,5 нг/мл соответствовало норме.
По данным недавно опубликованного исследования чувствительность и специфичность определения СРБ для диагностики хориоамнионита при ПРПО составляет 80% [6]. В нашем центре (КККБ ЦОМД) определение СРБ в сочетании с оценкой количества лейкоцитов периферической крови является стандартной и обязательной диагностической процедурой у пациенток с ПРПО при пролонгации беременности. Нами установлено, что в группе таких пациенток повышение уровня СРБ при длительности пролонгации свыше 7 дней отмечено в 67% случаев, а повышение уровня лейкоцитов – всего лишь в 43% случаев.
Ежедневно с момента установления порта и в течение всего времени проведения НТАИ проводился контроль лабораторных показателей (лейкоциты, СРБ, ПКТ), кардиотокография плода, ультразвуковое исследование фетоплацентарного комплекса. В течение 9 дней пролонгирования беременности на фоне проведения пациентке НТАИ все лабораторные показатели, а также данные кардиотокографии и ультразвукового исследования соответствовали нормативным значениям. Величина свободного кармана амниотической жидкости на протяжении всего периода пролонгации беременности находилась на уровне 2,0–2,4 см.
 На десятые сутки безводного периода при исследовании анализа периферической крови впервые отмечен незначительный лейкоцитоз 14,6×109/л. В тот же день отмечено появление спонтанной родовой деятельности. Было принято решение отказаться от проведения токолитической терапии и провести родоразрешение путем операции кесарева сечения. Таким образом, длительность пролонгирования беременности составила 10 дней.
На десятые сутки безводного периода при исследовании анализа периферической крови впервые отмечен незначительный лейкоцитоз 14,6×109/л. В тот же день отмечено появление спонтанной родовой деятельности. Было принято решение отказаться от проведения токолитической терапии и провести родоразрешение путем операции кесарева сечения. Таким образом, длительность пролонгирования беременности составила 10 дней.
В экстренном порядке было выполнено оперативное родоразрешение путем стандартной операции кесарева сечения поперечным разрезом в нижнем маточном сегменте. Родилась девочка массой 900 г, ростом 35 см, с оценкой по шкале Апгар на 1-й минуте – 1 балл, на 2-й минуте – 3 балла, на 5-й минуте – 5 баллов (новорожденная была переведена на искусственное аппаратное дыхание).
Результаты лабораторных показателей в периферической крови у новорожденного в первые сутки жизни не выявили признаков инфекционного поражения: уровень лейкоцитов – 8,23×109/л, нейтрофилов – 44%, лимфоцитов – 46,3%, моноцитов – 6,5%, показатель СРБ – 0,1 мг/л, ПКТ – 0,6 нг/мл.
Следует отметить, что показатели маркеров септического процесса находились в пределах нормы (СРБ и ПКТ).
В первые сутки жизни новорожденного проведены бактериологические исследования по изучению качественного и количественного состава микроорганизмов биотопов новорожденного. При бактериологическом исследовании было выявлено: в кале – энтеробактерии (Escherichia coli типичные, Escherichia coli лактозонегативные в титре 1×104); в крови – Enterococcus faecium, резистентный к ампициллину, и выявленной чувствительностью к имипенему, линезолиду, ванкомицину; в отделяемом с миндалин и задней стенки глотки – обильный рост Neisseria flafescens (самый безобидный представитель непатогенных нейссерий, редко вызывающий инфекции); в отделяемом из ушей – обильный рост Streptococcus salivarius. Таким образом, микрофлора, полученная у новорожденного с разных локусов, была различной.
На десятые сутки после рождения ребенок переведен на самостоятельное дыхание, отмечались редкие эпизоды апноэ. На 13-е сутки ребенок переведен для дальнейшего лечения и обследования в отделение патологии недоношенных новорожденных детей (на второй этап выхаживания).
После родоразрешения состояние вагинального биотопа пациентки соответствовало нормоценозу, в мазках – единичные лейкоциты, единичные грамположительные кокки (1–2 в поле зрения).
По результатам бактериологического исследования выделений из цервикального канала на 2-е сутки после родов выделены Escherichia coli (обильный рост), на 8-е сутки – обильный рост Escherichia coli и Streptococcus salivarius. При бактериологическом исследовании плаценты на аэробные и факультативно-анаэробные микроорганизмы выявлен умеренный рост Streptococcus salivarius, что является маловирулентной микрофлорой.
Послеродовый послеоперационный период протекал гладко, и роженица на 6-е сутки была выписана из акушерского стационара в удовлетворительном состоянии.
Результаты ретроспективного анализа продолжительности пролонгирования беременности при сроке от 22 до 28 недель гестации в нашем центре показали среднюю продолжительность этого периода – 5,6 дня. В случае применения метода непрерывной амниоинфузии с использованием подкожной порт-системы в сочетании с антибактериальной терапией длительность пролонгирования беременности составила 10 дней.
Заключение
Проведение метода непрерывной амниоинфузии с использованием подкожной порт-системы в сочетании с антибиотикотерапией позволило пролонгировать беременность в течение 10 суток, что в случаях ПРПО при сроке гестации до 28 недель удается крайне редко. При использовании традиционной выжидательной тактики без использования амниоинфузии длительность пролонгации беременности в подобной ситуации в большинстве случаев существенно короче в связи с критическим снижением количества околоплодных вод и более ранней манифестацией хорионамнионита.



