В настоящее время значительно возросла доля абдоминального родоразрешения у беременных с различной акушерской патологией и экстрагенитальными заболеваниями. Так, частота оперативного родоразрешения на территории РФ соответствует 30%, в США 32,8%; в Московской области доля кесарева сечения за последние два десятилетия возросла почти в 2,5 раза, составив 26% в 2017 г. [1]. Увеличение оперативной активности привело к повышению частоты послеоперационных гнойно-воспалительных осложнений (эндометрит, несостоятельность швов на матке, перитонит), несмотря на постоянное совершенствование оперативной техники и применения современной антибактериальной терапии [2]. Среди основных факторов риска, увеличивающих как общую, так и послеродовую продолжительность пребывания в стационаре, Yair J с соавт. (2015) называют послеоперационный парез кишечника (ППК), частота возникновения которого сопоставима с развитием послеродового эндометрита. ППК значительно замедляет послеоперационную (п/о) реабилитацию пациентов, тем самым увеличивая сроки пребывания в стационаре и стоимость лечения [3]. Абдоминальное родоразрешение, как одна из наиболее распространенных операций у женщин, часто ассоциируется с ППК, чему способствует выраженный болевой синдром, нарушение отхождения газов, позднее начало перорального приема пищи и грудного вскармливания [4].
В российских акушерских стационарах точной статистики возникновения ППК не ведется, однако, согласно данным МОНИИАГ частота его возникновения как осложнения послеродового периода составила не менее 6% в 2017 г. При этом на долю пареза легкой и средней степени тяжести приходится около 3,5%, парез тяжелой степени имел место в 2,5% от всех оперативных вмешательств в акушерско-гинекологической практике института. Таким образом, целью данного обзора явилось обобщение и систематизация рекомендаций по профилактике и коррекции ППК в акушерско-гинекологической практике на основании данных литературы и собственного опыта.
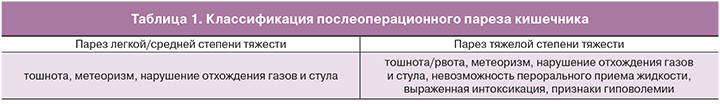
Определение и классификация
Парез кишечника – функциональное торможение двигательной активности кишечника независимо от вызвавших его патогенетических механизмов. Сроки развития ППК различны в зависимости от отдела желудочно-кишечного тракта (ЖКТ): тонкая кишка быстрее восстанавливает свою функцию (0–24 ч), чем желудок (24–48 ч) и толстая кишка (48–72 ч) [5]. Основная трудность диагностики ППК заключается в разграничении «стандартной» продолжительности пареза кишечника как физиологической стресс-реакции и ситуаций, когда это состояние пролонгируется [6]. Для определения степени тяжести ППК после абдоминального родоразрешения в МОНИИАГ применяется классификация с учетом клинических признаков (табл. 1).
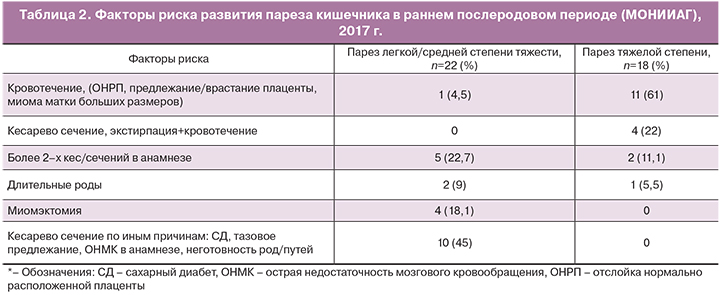
Помимо клинических проявлений возникающие симптомы вызывают психологический дискомфорт у пациентов. Даже парез легкой степени может восприниматься пациентом как отклонение от ожидаемого стандартного течения послеоперационного периода [5]. Анализ данных МОНИИАГ (табл. 2) показал, что основными факторами риска развития пареза легкой/средней степени тяжести являются: абдоминальное родоразрешение у пациенток высокого риска (длительный стаж сахарного диабета с выраженными метаболическими нарушениями, патология центральной и периферической нервной системы); повторные операции кесарева сечения (две и более), а также метропластика в анамнезе. Первопричиной в этих ситуациях является выраженный спаечный процесс в брюшной полости и интраоперационный адгезиолизис.
Согласно нашим данным, ведущим фактором риска развития ППК тяжелой степени является массивная кровопотеря (более 25% от общего объема циркулирующей крови) во время оперативного родоразрешения, а расширение объема операции до экстирпации матки увеличивает частоту развития данного осложнения до 83%. Основным патогенетическим механизмом в этом случае является ишемическо-гипоксическое поражение кишечника даже при условии своевременного возмещения кровопотери и отсутствия эпизодов нестабильной гемодинамики [7]. Повышение частоты развития ППК в последние годы, вероятно, связано с увеличением количества симультанных операций, сопровождающихся патологической кровопотерей. Наиболее частой из них является выполнение абдоминального родоразрешения с последующей миомэктомией, при этом размер и локализация миоматозных узлов играют решающее значение в увеличении объема кровопотери [8].
Основным фактором риска развития вторичного ППК являются гнойно-воспалительные осложнения в послеродовом периоде (эндометрит, несостоятельность швов на матке). Главными причинами в этом случае могут выступать частые влагалищные исследования, хориоамнионит в родах, длительные самопроизвольные роды (свыше 12 часов), закончившиеся кесаревым сечением.
Среди общих факторов риска развития ППК необходимо отметить продолжительность и экстренность оперативного вмешательства. По данным Vather R. и соавт (2013), возраст и снижение пред- и послеоперационного уровня гемоглобина расцениваются как единственные независимые предикторы развития ППК [9]. В тоже время раннее пероральное употребление жидкости не оказывает достоверного влияния на частоту развития желудочно-кишечных осложнений [10].
Вовремя некупированный ППК усугубляет тяжелое течение раннего п/о периода из-за возникновения нарушений гомеостаза вследствие скрытых потерь жидкости, электролитов, белков, что обусловливает развитие гиповолемического шока и выраженной интоксикации [Киркилевский С. И. и соавт., 2003.]. Таким образом, одной из основных задач по предупреждению развития ППК является своевременная профилактика синдрома энтеральной недостаточности, а в случае его возникновения – предотвращение прогрессирования стадии кишечного пареза до стадии динамической кишечной непроходимости, требующей хирургической коррекции. На основании данных литературы и собственного клинического опыта нами разработан алгоритм интенсивной терапии, направленный на коррекцию ППК различной степени тяжести в раннем послеродовом периоде.
Алгоритм интенсивной терапии ППК
Алгоритм интенсивной терапии ППК легкой/средней степени включает два базовых направления:
- коррекция электролитного дисбаланса
- фармакологическая стимуляция моторно-эвакуаторной функции ЖКТ.
Алгоритм интенсивной терапии ППК тяжелой степени:
- инфузионная терапия и коррекция электролитного дисбаланса
- фармакологическая стимуляция моторно-эвакуаторной функции ЖКТ
- адекватное п/о обезболивание
- адекватная антибиотикотерапия
- декомпрессия желудка
- механическая стимуляция толстого кишечника.
Инфузионная терапия
Рестриктивный режим введения жидкости (1–1,25 мл/кг/ч) является наиболее эффективным для уменьшения выраженности симптомов ППК, что связано с ускоренным восстановлением функции ЖКТ [9, 11]. Для базовой инфузии рекомендовано введение сбалансированных изотонических кристаллоидных растворов с обязательным замещением эквивалентным объемом назогастральных потерь или рвоты, отделяемого по дренажам, выделений из половых путей, кожных потерь с учетом температуры. Обязательна коррекция гипоальбуминемии как дополнительного фактора риска ППК, приводящего к нарастанию отека и растяжению кишечной стенки [9].
Коррекция электролитного дисбаланса
Предположение о роли электролитного дисбаланса в патогенезе ППК возникло в результате наблюдений по его влиянию на моторику ЖКТ и увеличения этих нарушений при ППК. Два ретроспективных обзора подтвердили сопричастность послеоперационных электролитных нарушений к потенциальным факторам риска развития ППК. U. Kronberg с соавт (2011) продемонстрировали значительную корреляцию между уровнем послеоперационной гипокалиемии и гипокальциемии и степенью выраженности ППК [12]. R. Vather с соавт. (2013) аналогично обнаружил, что гипонатриемия также является важной составляющей пареза кишечника [9].
С учетом данных литературы рекомендован регулярный контроль и коррекция следующих электролитов: калий, натрий, кальций и магний. Коррекция дефицита калия проводится до достижения целевой концентрации в плазме не менее 4,0 ммоль/л путем в/в введения 4% раствора KCl со скоростью 5 мл/ч под контролем показателей кислотно-основного состояния крови в динамике.
Фармакологическая стимуляция моторно-эвакуаторной функции ЖКТ
При стойких парезах наряду с энтеротерапией проводится фармакологическая стимуляция двигательной функции ЖКТ. Среди наиболее распространенных препаратов в акушерско-гинекологической практике можно выделить: ингибиторы холинэстеразы, метоклопрамид, серотонина адипинат.
Наиболее часто применяемым препаратом из группы ингибиторов холинэстеразы является неостигмина метилсульфат. Несмотря на его широкое применение при терапии парезов, препарат обладает определенными недостатками: действует на гладкую мускулатуру желудка и тонкой кишки кратковременно, не оказывая влияния на толстый кишечник. Неостигмина метилсульфат не координирует нарушенную моторику кишечника в отличие от дистигмина, который значительно повышает электрическую активность всех отделов ЖКТ и улучшает их ритмичность [13]. Необходимо отметить побочные эффекты неостигмина: отрицательное ино- и хронотропное действие на миокард, способность вызывать нарушения ритма и проводимости, что делает его применение небезопасным, особенно у родильниц после массивной кровопотери.
Для коррекции ППК широко применяется метоклопрамид, являющийся антагонистом дофаминовых (D2) рецепторов. Рядом отечественных и зарубежных работ было показано, что метоклопрамид снижает суммарную электрическую активность в основном желудка и тонкой кишки и способствует восстановлению сокращений двенадцатиперстной кишки [13]. Изучение его эффективности для предотвращения ППК после кесарева сечения продемонстрировало отсутствие достоверной разницы между группами как по времени появления перистальтики и начала отхождения газов, так и появления первого стула [14].
В последние годы значительно возрос интерес к применению серотонина адипината для профилактики и терапии ППК в акушерско-гинекологической практике. На основе экспериментальных и клинических исследований была подтверждена концепция о роли серотонина и серотониновых рецепторов в генезе дисфункции гладкой мускулатуры, являющейся составной частью клинического синдрома серотониновой недостаточности при ППК [15]. В клинических наблюдениях описан положительный опыт его применения в раннем п/о периоде для восстановления перистальтики при функциональной кишечной непроходимости. При этом продолжительность терапии препаратом составила от 2 до 5 суток [13]. Введение серотонина в дозе 0,1 мг/кг активирует перистальтическую деятельность желудка и тонкой кишки, а увеличение дозы до 0,2–0,3 мг/кг усиливает электрическую активность тощей кишки и формирует более упорядоченный и стабильный ритм сократительной активности тонкой кишки [13]. Согласно инструкции по медицинскому применению препарата кормление грудью не является противопоказанием для его назначения [16].
Адекватное послеоперационное обезболивание
Лекарственные препараты, традиционно применяемые для п/о обезболивания, оказывают различное действие на моторику ЖКТ в зависимости от их фармакологических свойств и путей введения. Введение адреноблокаторов не ускоряет разрешение пареза. Парентеральное введение наркотических анальгетиков вызывает развитие «запирающего» эффекта, способствуя прогрессированию ППК [17]. С этих позиций применение эпидуральной анальгезии (ЭА) является необходимым условием, направленным на предотвращение развития индуцированных хирургической травмой изменений [17]. Основной механизм, посредством которого достигается положительный эффект ЭА, заключается в прерывании передачи ноцицептивных импульсов по афферентной ветви спинальной рефлекторной дуги. Кроме того, при этом может быть угнетена и эфферентная передача за счет блокады тораколюмбальных симпатических путей. Положительный эффект длительной ЭА на функцию ЖКТ в п/о периоде связан также с системным действием местного анестетика при его абсорбции из эпидурального пространства. Таким образом, при развитии ППК тяжелой степени рекомендовано мультимодальное обезболивание на основе длительной ЭА в сочетании с нестероидными противовоспалительными препаратами (при отсутствии противопоказаний), а также регулярное или по требованию введение трамадола.
Декомпрессия желудочно-кишечного тракта
При присоединении симптомов рвоты застойным желудочным содержимым показана постановка назогастрального зонда (НЗГ). Длительность стояния НЗГ определяется тяжестью ППК и скоростью восстановления перистальтики ЖКТ. На основании собственного опыта, соблюдение алгоритма интенсивной терапии ППК тяжелой степени позволяет ограничить длительность стояния НГЗ до 24 часов.
Эффективность алгоритма интенсивной терапии и серотонина адипината
Проанализированы результаты терапии различных форм ППК у 40 родильниц после абдоминального родоразрешения и осложненных родов. Средний возраст составил 32,5±3,6 лет. У 18 (45%) родильниц в раннем послеродовом периоде развился ППК тяжелой степени, у 22 (55%) – ППК легкой/средней степени тяжести.
Для коррекции ППК тяжелой степени применяли комплекс мероприятий, составляющий указанный алгоритм интенсивной терапии. Четкое соблюдение разработанного алгоритма с соблюдением временных интервалов позволило сделать следующие выводы:
- доза, необходимая для достижения целевых значений К+, составила 7,1±0,9 г в 1 сутки; 4±0 г на 2–3 сутки;
- для фармакологической стимуляции моторно-эвакуаторной функции ЖКТ применялся серотонина адипинат в стартовой дозе 60 мг в/в капельно со скоростью не более 10 мг/час. Увеличение скорости введения сопровождалось появлением гиперемии и болезненности по ходу периферической вены. Другие побочные эффекты (артериальная гипертензия, затруднение дыхания) не зарегистрированы;
- анализ клинических наблюдений показал, что на фоне применения серотонина адипината восстановление двигательной активности кишечника (появление первой перистальтики) отмечалось через 680±71,3 минуты от начала интенсивной терапии, отхождение газов зарегистрировано через 880±66,4 минут;
- устойчивое восстановление моторно-эвакуаторной функции кишечника (появление самостоятельного стула) и разрешение тяжелого ППК наблюдалось к 3 суткам п/о периода, что служило основанием для перевода родильниц в послеродовое отделение;
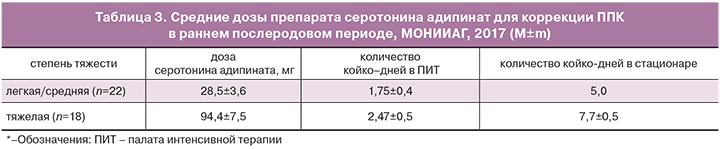
- доза серотонина, необходимая для коррекции тяжелого ППК, составила 94,4±7,5 мг (таб. 3);
- необходимости в хирургической коррекции ППК тяжелой степени не отмечено;
- для достижения адекватного обезболивания применялась ЭА в сочетании с в/м введением трамадола 50–100 мг каждые 8 ч. (3 раза/сут). Уровень катетеризации эпидурального пространства Th6–Th8, проводилась постоянная эпидуральная инфузия 1 мг/мл ропивакаина гидрохлорида//0,625 мг/мл левобупивакаина гидрохлорида со скоростью 4–5 мл/ч в течение 48–72 ч. (до появления первого стула);
- для коррекции ППК тяжелой степени считаем целесообразным проведение механической стимуляции толстого кишечника до 4 раз/сут. (каждые 6 ч.) с обязательной постановкой газоотводной трубки – в течение 2 часов после очистительной клизмы. После появления первого стула количество очистительных клизм пропорционально снижается по мере восстановления моторно-эвакуаторной функции ЖКТ: до 1–2 раз/сут.
Проведение терапии у родильниц с парезом кишечника легкой/средней степени тяжести выявило следующие результаты:
- доза, необходимая для достижения целевых значений К+, составила 4±0 г на 1–2-е сутки;
- коррекция моторно-эвакуаторной функции осуществляется введением серотонина адипината в стартовой дозе 20–30 мг в/в капельно со скоростью введения не более 10 мг/ч. Побочных эффектов при введении препарата не зарегистрировано;
- доза, необходимая для коррекции ППК легкой/средней степени, составила 28,5±3,6мг (табл. 3). Необходимо отметить, что для достижения положительного эффекта при ППК легкой/средней степени достаточно однократного введения серотонина;
- появление первой перистальтики на фоне инфузии серотонина отмечено через 240±23,5 минут; активное отхождение газов через 660±59,5 минут;
- устойчивое восстановление моторно-эвакуаторной функции кишечника (появление самостоятельного стула) наблюдалось на 2 сутки п/о периода, после чего родильницы переводились в послеродовое отделение.
Таким образом, на основании анализа литературы и собственного опыта профилактики и коррекции ППК в акушерско-гинекологической практике можно сделать следующие выводы:
При наличии факторов риска (патологическая кровопотеря, миомэктомия, повторное чревосечение, анамнез) обязательно включение в комплекс профилактических мероприятий ППК инфузии серотонина адипината в дозе 30 мг через 2 часа после оперативного вмешательства.
Эффективная доза серотонина адипината для коррекции ППК легкой/средней степени тяжести в п/о периоде составляет 30 мг. Восстановление моторных функций (первая перистальтика – активное отхождение газов) кишечника на фоне инфузии происходит через 240–660 минут.
Эффективная доза серотонина адипината для лечения тяжелого ППК после акушерско-гинекологических операций составляет 90–100 мг. Восстановление моторных функций кишечника на фоне инфузии происходит через 680–880 минут.
Cоблюдение алгоритма интенсивной терапии тяжелого пареза кишечника с применением современных прокинетиков позволяет добиться регресса клинико-лабораторной симптоматики и избежать формирования кишечной непроходимости.



