Синдром поликистозных яичников (СПКЯ) рассматривают в качестве основной причины гиперандрогении и ановуляторного бесплодия. Его частота среди женщин репродуктивного возраста по разным диагностическим критериям варьирует от 6 до 20% [1].
Несмотря на почти 80-летний период изучения СПКЯ, вопросы этиологии и патогенеза продолжают оставаться предметом научных исследований и дискуссий. Современный этап фундаментального изучения СПКЯ условно можно назвать этапом молекулярной биологии и генетики. Предположения о наличии генетической компоненты в происхождении СПКЯ были высказаны еще в 60-х годах прошлого столетия. В настоящее время активно ведется поиск генов-кандидатов, ассоциированных с различными проявлениями СПКЯ, опубликованы результаты нескольких исследований геномных ассоциаций (GWAS) [2]. Однако взаимосвязь выявленных генетических полиморфизмов с клиническими проявлениями СПКЯ четко не доказана и не всегда прослеживается. Это обосновывает дальнейший поиск возможных предикторов СПКЯ и его модификации в возрастном аспекте.
При изучении функции яичников значительное внимание уделяют гену FMR1, расположенному на длинном плече Х хромосомы в локусе Xq27.3. Он ответственен за синтез трансмембранного белка (fragile X mental retardation protein – FMRP), играющего важную роль в механизмах пролиферации половых клеток и отбора примордиальных фолликулов в растущий пул. Установлена взаимосвязь между изменениями числа CGG повторов в гене FMR1 и процессами фолликулогенеза. N. Gleicher показал, что число 26–34 CGG повторов в различных этнических группах представляет собой диапазон [3], который косвенно позволяет судить о нормальной функции яичников. Экспериментально показано, что аномальное число повторов в гене FMR1 (то есть число повторов вне «условной нормы») может приводить как к нарушению закладки овариального пула, так и к быстрому истощению нормального пула растущих фолликулов [4, 5]. Наиболее изучена взаимосвязь аномального числа CGG повторов гена FMR1 с развитием преждевременной недостаточности яичников (ПНЯ) [6]. СПКЯ, как и ПНЯ, можно рассматривать как состояние, ассоциированное с нарушением фолликулогенеза. Это дает основание для изучения роли полиморфных вариантов гена FMR1 при данной патологии. Следует отметить, что подобные вопросы освещены лишь в единичных научных публикациях. Одни из них касаются оценки роли гена FMR1 в эффективности проведения программ вспомогательных репродуктивных технологий, другие – взаимосвязи гетерозиготного носительства коротких аллелей (менее 24 CGG повторов) гена FMR1 с быстрым истощением овариального резерва у женщин с СПКЯ – подобным фенотипом [7, 8]. Ограниченное число проведенных исследований, выполненных на малых выборках больных, а также неоднозначность полученных результатов не дают четких представлений о взаимосвязи гена FMR1 с нарушениями фолликулогенеза при СПКЯ. Вместе с тем проведение исследований в данном направлении представляется небезынтересным как с научной, так и с практической точки зрения.
 Цель исследования – изучение частот различных аллелей высокополиморфного CGG повтора в гене FMR1 у пациенток с СПКЯ и их взаимосвязи с функциональным состоянием репродуктивной системы.
Цель исследования – изучение частот различных аллелей высокополиморфного CGG повтора в гене FMR1 у пациенток с СПКЯ и их взаимосвязи с функциональным состоянием репродуктивной системы.
Материал и методы исследования
В исследование были включены 115 пациенток с СПКЯ (средний возраст 27,1±4,6 года). Диагностика СПКЯ и репродуктивных фенотипов проводились в соответствии с Роттердамскими критериями [9]. Средний возраст менархе больных составил 13,5±1,5 года. Нарушения менструального цикла отмечены почти у всех больных: у 95 (82%) – олигоменорея (первичная – у 69%, вторичная – у 13%), у 18 (16%) – аменорея (первичная – у 4%, вторичная – у 12%), лишь у 2 пациенток (2%) менструальный цикл был регулярным. Задержки менструации до 1 месяца выявлены у 13,4% больных, от 1 до 3 месяцев – у 35,7%, от 3 до 6 месяцев – у 32,9%. Бесплодие отмечалось у 32 из 48 женщин, заинтересованных в беременности (66,7%). Индекс массы тела (ИМТ) обследованных больных составил – 22,9±4,7кг/м2. Нормальную массу тела имели 65,9% женщин, дефицит – 11,8%, избыток – 14,1%, ожирение I–III степени – 8,2%. Признаки гиперандрогении (ГА) отмечены у 66 (57,4%) пациенток. Распределение пациенток по фенотипам было следующим: фенотип А (олигоменорея+ПКЯ+ГА) был диагностирован у 69 (60%) больных, В (олигоменорея+ГА) – у 5 (4,3%), С (ПКЯ+ГА) – у 1 (0,9%), Д (олигоменорея+ПКЯ) – у 40 (34,8%). Малочисленность группы В, а также ее сходство (за исключением отсутствия эхографических признаков ПКЯ) с группой А стали основанием для объединения этих 2 фенотипов в один классический андрогенный тип. Фенотип Д обозначен как неандрогенный, фенотип С ввиду крайней малочисленности группы в расчеты исследования не включали. Статистическая обработка данных проводилась на 114 пациентках.
Протокол исследования включал оценку гормональных параметров – определение уровней антимюллерова гормона (АМГ), фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), тиреотропного гормона (ТТГ), эстрадиола (Е2), тестостерона общего (Тобщ), тестостерона свободного (Тсв), андростендиона (А), тестостерон-эстрадиол связывающего глобулина (ТЭСГ), дигидротестостерона (ДГТ), 17-оксипрогестерона (17-ОП). Использованы наборы «DPC», «DSL» (США), «Immunotech» (Чехия), «DBC» (Канада). Индекс свободного тестостерона (ИСТ) рассчитывали по формуле Тобщ х 100%/ТЭСГ. Ультразвуковое исследование органов малого таза проводилось трансвагинальным датчиком на аппарате фирмы Aloka-SSD 650 (Япония).
Определение аллелей CGG повтора в гене FMR 1 проводили методом метилспецифической полимеразной цепной реакции (МС-ПЦР) с праймерами: RUF : (FAM)-ttt gag agg tgg gtt gtg ggt gtt tga gg, RUR : aac acc act acc aaa aaa cat aca aca aca caa c RMF : (FAM)-ttt cga gag gtg ggt tgc ggg cgt tcg ag, RMR : ccg cct cta aac gaa cga cga acc gac gac). Последующий фрагментный анализ продуктов ПЦР, конъюгированных с флуоресцентным красителем FAM, выполнялся на генетическом анализаторе ABI 3100 GeneticAnalyzer («AppliedBiosystems», USA).
 Статистический анализ проводили с помощью электронных таблиц Microsoft Exel, пакета прикладных программ Statistica v. 8.0, GraphPadInStat v. 3.06, GraphPadPrism 5, MedCalc.
Статистический анализ проводили с помощью электронных таблиц Microsoft Exel, пакета прикладных программ Statistica v. 8.0, GraphPadInStat v. 3.06, GraphPadPrism 5, MedCalc.
Результаты исследования
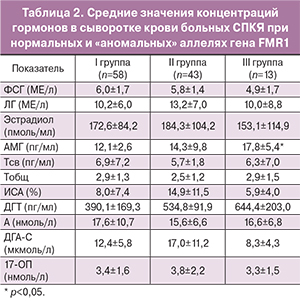
Изучение гормонального профиля больных СПКЯ показало следующие результаты: среднее значение АМГ – 11,8±7,8 пг/мл, ЛГ – 11,3±6,8 МЕ/мл, ФСГ – 5,8±1,6 МЕ/мл, ТЭСГ- 50,0±23,6 нмоль/л, Тобщ – 2,8±1,3 нмоль/л, Тсв – 6,4±5,3 нмоль/л, ИСА – 4,3±6,1%, ДГТ – 486±214,4 пг/мл, А – 19,4±7,7 нмоль/л, ДГА-С – 7,0±1,3 мкмоль/л; 17-ОП – 3,5±1,8 нмоль/л. Повышение уровня Тобщ в сыворотке крови выявлено у 44% больных, Тсв – у 55%, А – у 77,5%; ДГТ – у 59%, ДГА-С – у 4,3%.
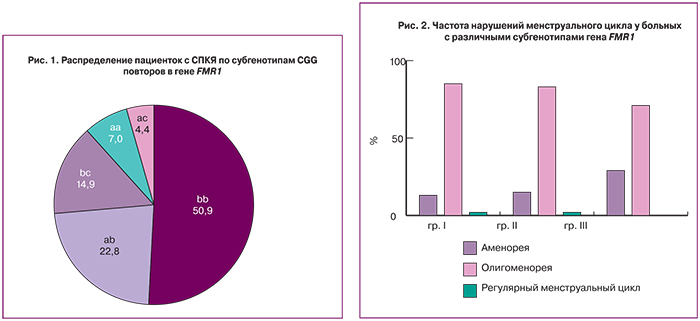
Для генетического исследования были взяты 114 образцов ДНК больных СПКЯ. Длина CGG повтора колебалась от 6 до 46 тринуклеотидов. Максимальная частота отмечена у аллеля длиной 32 повтора (34,6%). Исследование было проведено на выборке больных с СПКЯ, а в качестве референсных значений использовались данные, полученные ранее в работе Н.Н. Шамиловой (2012), согласно которой условной нормой по отношению к овариальному резерву в российской популяции является диапазон 28-36 CGG тринуклеотидных повторов [10], что отличается от традиционного диапазона нормальных значений CGG аллелей 4–50, принятого для диагностики синдрома ломкой Х-хромосомы. В зависимости от длины CGG повтора (относительно условной нормы 28–36) в работе выделены 3 группы аллелей гена FMR1: «короткий» (менее 28) аллель а, «нормальный» (диапазон 28–36) аллель b и «длинный» (более 36) аллель c. С учетом этого диагностированы 5 субгенотипов – aa – носители 2 «коротких» аллелей или гомозигота по «короткому» аллелю (7%), ab – носители одного «короткого» аллеля или гетерозигота по «короткому» аллелю (22,8%), bb – носители 2 нормальных аллелей или гомозигота по «нормальному» аллелю (50,9%), bc – носители «длинного» аллеля или гетерозигота по «длинному» аллелю (14,9%), ac – носители 2 «аномальных» («короткого» и «длинного») аллелей (4,4%), их распределение представлено на рисунке 1. Субгенотипа cc (носитель 2 «длинных» аллелей или гомозигота по «длинному» аллелю) среди больных с СПКЯ в исследовании выявлено не было.
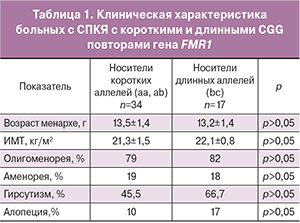
Как видно из рис. 1, лишь у 50,9% больных с СПКЯ длина CGG повторов в гене FMR1 укладывалась в нормативные параметры (bb), соответственно почти половина больных (49,1%) являлась носителями «аномальных» аллелей (а и с). «Короткие» аллели встречались в 2 раза чаще, чем «длинные» (29,8% против 14,8%), доминировали пациенты, несущие 1 «аномальный» аллель (ab, bc) (37,7%) по сравнению с носителями только «аномальных» аллелей (aa, ac) (11,5%). Представленные в табл. 1 данные указывают на отсутствие различий по основным клиническим характеристикам между пациентками с субгенотипами с «короткими» (aa, ab, n=34) и «длинными» (bc, n=17) СGG повторами гена FMR1. Группа носителей 2 «аномальных» аллелей (ас) в виду своей малочисленности и невозможности оценить вклад и «короткого», и «длинного» аллеля в клинические проявления синдрома в таблицу не включена.
В соответствии с основными субгенотипами были выделены 3 основные группы: 58 (50,9%) больных, являющихся гомозиготами по «нормальному» аллелю, отнесены в I группу (bb), 43 (37,7%) – с одним «аномальным» («коротким» или «длинным») аллелем – отнесены во II группу (bc, ab) и 13 (11,4%) – с двумя «аномальными» аллелями – в III группу (ac, aa). Межгрупповой анализ основных клинико-лабораторных данных показал, что средний возраст менархе статистически не различался между группами, соответственно составил 13,5±2,1 г, 13,5±1,5 г и 13,1±0,7 г (р>0,05). Не выявлено также различий по ИМТ, его значения по группам составили 23,4±2,1, 22,4±1,8 и 21,2±1,8 (р>0,05). Ожирение чаще отмечалось среди пациенток I группы по сравнению c II (13,1 против 3,5%, р<0,05) и не встречалось в III группе. Клинические проявления ГА (алопеция и гирсутизм) достоверно не отличались между группами, хотя и встречались несколько чаще среди больных I группы (62% больных), чем во II и III группах (54,8 и 53,8%) соответственно.
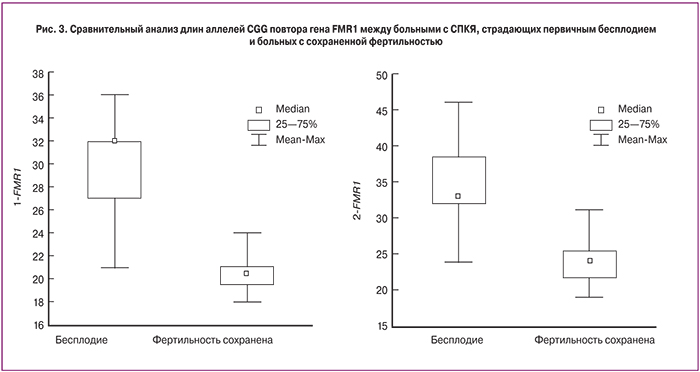
Сравнительный анализ характера нарушений менструального цикла между 3 группами показал двукратное увеличение частоты встречаемости аменореи (как первичной, так и вторичной) у пациенток III группы по сравнению с I и II (29 против 13 и 15% соответственно, р<0,05). Частота нарушения менструального цикла по типу олигоменореи (первичной и вторичной) существенно не различалась между группами и выявлена у 85% женщин в I группе, у 83% – II группы, у 71% – III группы (p>0,05). Регулярный менструальный цикл наблюдался у одной пациентки (1,7%) в I группе и одной (2,3%) – во II группе (рис. 2).
Оценка распределения фенотипов СПКЯ показала двукратное преобладание андрогенного фенотипа над неандрогенным у пациенток в каждой из трех групп c некоторым превалированием в I группе. Так, соотношение фенотипов в I, II, III группах составило 2,36:1,64:1,8.
Анализ гормональных параметров по условно выделенным группам показал, что средний уровень АМГ возрастает при наличии «аномальных» аллелей. Средний уровень АМГ в III группе был достоверно выше, чем в I и II. По остальным гормональным параметрам различий между группами не выявлено (табл. 2). Частота ГА между группами с различными генотипами гена FMR1 существенно не различалась: по уровню Тсв. составила 64% в I группе, 43% – во II, 50% – в III (р>0,05), по уровню А – 78, 75 и 85% соответственно (р≥0,05).
Проведенный сравнительный анализ медиан длин CGG повторов (или просто аллелей) гена FMR1 больных с СПКЯ, страдающих первичным бесплодием и больных с СПКЯ, имеющих в анамнезе беременность, выявил различия между показателями (соответственно, 32±4,08 против 20,5±1,71 (1-CGG) и 33±5,04 против 24±3,57 (2-CGG) (р<0,001 при α=0,05) (рис. 3). У пациенток с первичным бесплодием длина CGG-повторов достоверно отличалась от длины CGG-повторов пациенток с сохраненной фертильностью.
Обсуждение
В настоящее время изучение генеза различных заболеваний, в том числе ассоциированных с нарушениями репродуктивной системы, базируется на молекулярно-генетических исследованиях. На страницах научных журналов обсуждаются вопросы роли нарушений на Х-хромосоме и изменений в гене FMR1, продолжается дискуссия относительно нормальных значений числа CGG повторов в гене FMR1 для адекватной функции яичников. Это важный аспект проблемы, поскольку согласно имеющимся данным, «аномальная» длина CGG повторов ассоциируется с нарушениями фолликулогенеза, старением яичников, женским бесплодием [9]. В работах профессора N. Gleicher нормальный диапазон CGG повторов обозначен как 26–34. Распределение «аномальных» повторов может отличаться в различных этнических группах, особенно среди представительниц азиатской расы [3]. По имеющимся данным, в российской популяции нормальные значения числа CGG-повторов в гене FMR1 укладываются в диапазон 28–36 [10]. Однако полученные нами данные свидетельствуют о том, что у пациенток с СПКЯ с первичным бесплодием длина CGG-повторов укладывалась в рамки условной нормы (рис. 3), несмотря на достоверное различие с длиной CGG-повторов пациенток с сохраненной фертильностью. «Аномальное» значение числа CGG повторов рассматривается в качестве одного из ранних прогностических маркеров развития ПНЯ. СПКЯ, как и ПНЯ, относят к числу заболеваний, связанных с нарушениями фолликулогенеза. Несмотря на известный вклад гена FMR1 в процесс фолликулогенеза и взаимосвязь с овариальным резервом, в литературе отсутствуют четкие данные о различиях длин СGG повторов гена FMR1 между больными СПКЯ и здоровыми женщинами, а также больными с различными фенотипами СПКЯ. Это послужило основанием для проведения сравнительного анализа результатов клинико-лабораторного обследования больных СПКЯ с разными субгенотипами FMR1.
Результаты проведенного исследования показали, что «аномальное» число CGG повторов в гене FMR1 (менее 28 и более 36) встречается у каждой второй больной с СПКЯ и не зависит от фенотипа синдрома. Схожие данные о частоте представленности «аномального» числа CGG повторов в гене FMR1 были ранее получены другими авторами при обследовании пациенток с ПНЯ [10]. Наличие коротких или длинных аллелей гена FMR1 рассматривается в качестве предиктора преждевременного выключения функции яичников. Роль «аномальных» аллелей гена FMR1 в этом аспекте при СПКЯ не изучена, и не ясна взаимосвязь с репродуктивными нарушениями. Результаты проведенного исследования не позволили выявить каких-либо существенных различий по основным клинико-лабораторным показателям (характеру нарушений менструального цикла, частоте ожирения, гирсутизма, алопеции, ГА) между группами пациенток, имеющими «короткие» и «длинные» СGG повторы гена FMR1. Вместе с тем установлено, что наличие «аномальных» аллелей ассоциируется с более тяжелыми нарушениями менструального цикла. Так, присутствие в генотипе 2 «аномальных» аллелей сопряжено с двукратным увеличением частоты встречаемости аменореи (как первичной, так и вторичной). Кроме того, в группе гомозиготных носительниц «аномальных» аллелей отмечено достоверное увеличение уровня АМГ.
В литературе представлено лишь небольшое количество публикаций, в которых анализировалась связь уровня АМГ с числом CGG повторов гена FMR1 у женщин репродуктивного возраста. В одних публикациях показана отрицательная взаимосвязь уровня АМГ и длины СGG повтора гена FMR1 [11, 12], в других – положительная [13] или отсутствие таковой [14–16]. В одной из недавно опубликованных статей представлены данные о более значительном возрастном снижении уровня АМГ у женщин со сниженным овариальным резервом, имеющих длинные повторы гена FMR1 (более 35) по сравнению с более короткими (менее 35) [17]. Однако необходимо отметить, что во всех указанных выше работах не рассматривались женщины с СПКЯ.
Исследования гена FMR1 показали, что женщины с «нормальным» генотипом имеют лучший овариальный резерв по сравнению с носительницами «аномальных» аллелей. Однако после 33 лет у женщин с «нормальным» субгенотипом снижение овариального резерва происходит быстро, тогда как у гетерозигот сокращение пула примордиальных фолликулов – довольно медленный процесс, что способствует сохранению овариального резерва. Гомозиготы по «аномальному» аллелю демонстрируют наиболее низкий фолликулярный запас на всех возрастных этапах и высокую скорость рекрутирования фолликулов [18].
В литературе опубликованы данные пилотного исследования об ассоциации гетерозиготного носительства короткого аллеля (ab) у пациенток с СПКЯ-подобным фенотипом с быстрым истощением овариального резерва [8]. Это проявлялось быстрым снижением высоких уровней АМГ к 32–33 годам. Напротив, гетерозиготное носительство «длинного» аллеля (bc) ассоциировалось с низким рекрутингом фолликулов, что способствовало более продолжительному сохранению овариального резерва после 40 лет. Результаты проведенного нами пилотного одномоментного исследования, к сожалению, не позволяют прогнозировать скорость дальнейшего рекрутинга фолликулов, динамику уровня АМГ и восстановление ритма менструаций. Хотя этот аспект проблемы представляется крайне интересным и важным с практической точки зрения. В этой связи перспективно проведение долгосрочного исследования по изучению взаимосвязи динамики уровня АМГ и полиморфных вариантов тринуклеотидного повтора гена FMR1; перспективно также генетическое обследование женщин с СПКЯ в возрасте старше 35 лет, восстановивших и не восстановивших ритм менструаций.
В работе выявлена достоверная взаимосвязь бесплодия с носительством более длинных СGG повторов по сравнению с пациентками с сохраненной фертильностью. Данные литературы о взаимосвязи бесплодия с полиморфизмом гена FMR1 малочисленны и разноречивы. Согласно работе N. Gleicher (2010) шансы наступления беременности при СПКЯ в программе ЭКО значительно ниже у носительниц «короткого» (менее 26 повторов CGG) аллеля гена FMR1, чем при отсутствии этого аллеля [19]. Напротив, в работе Р.Э. Ванян (2015) у пациенток в программе ЭКО при наличии числа CGG-повторов >34 в 6 раз чаще наблюдался «бедный» ответ на стимуляцию суперовуляции по сравнению с женщинами с «нормальным» числом повторов [20]. В исследовании De Geyter и соавт. (2013) не выявлено различий в распределении длин повторов между пациентками с различными формами бесплодия (n=372) и фертильными женщинами (n=199) [14]. В одной из публикаций, посвященных полиморфизму CGG повтора гена FMR1 при СПКЯ, представлены данные об ассоциации гетерозиготного носительства «короткого» аллеля с наличием аутоантител. Так, при носительстве одного «короткого» аллеля у женщин с СПКЯ-подобным фенотипом чаще выявлены различные аутоантитела (антинуклеарные, антифосфолипидные, антитиреоидные, антиовариальные, аутоантитела к ткани надпочечников), высокие уровни общих иммуноглобулинов G, M, A (83%). Авторы делают заключение, что эта группа больных имеет предрасположенность к более частому развитию аутоиммунных заболеваний, по сравнению с женщинами, гетерозиготами по «длинному» аллелю (10%) (р<0,0001) [7]. Подобная закономерность, по всей вероятности, может лежать в основе выделения группы больных с аутоиммунным генезом формирования СПКЯ. Возможно, углубленное изучение взаимосвязи длины CGG повтора с аутоантителами (антиовариальными, антителами к фосфолипидам, антимитохондриальными и др.) позволит в дальнейшем более доказательно дискутировать о роли аутоиммунных нарушений в генезе СПКЯ.
По результатам впервые проведенного комплексного обследования пациенток с СПКЯ, включающего оценку клинико-гормональных параметров и молекулярно-генетический анализ длины CGG повтора гена FMR1, можно сделать заключение, что у каждой второй пациентки с СПКЯ имеется «аномальное» число CGG повторов гена FMR1, ассоциированное с более тяжелой овуляторной дисфункцией. Необходимо заметить, что данное наблюдение ставит вопрос о тщательном исследовании распределения различных аллелей FMR1 у репродуктивно здоровых женщин. Высокая частота представленности «аномальных» аллелей гена FMR1 среди больных с СПКЯ, сопоставимая с таковой при ПНЯ [10], указывает на роль молекулярно-генетических изменений в генезе этих состояний, которые объединяет нарушение фолликулогенеза. В настоящее время роль выявленных изменений в гене FMR1 при СПКЯ остается неясной. Однако открываются возможности для проведения дальнейших исследований, результаты которых, возможно, позволят выделить группу женщин, являющихся кандидатами на успешное спонтанное восстановление ритма менструаций и фертильности в более позднем репродуктивном возрасте, а также группу женщин, нуждающихся в стимуляции и использовании вспомогательных репродуктивных технологий. Для дальнейшего понимания значения полиморфизма CGG повтора гена FMR1 в формировании СПКЯ, а также понятия репродуктивного будущего данного контингента больных необходимы более масштабные про- и ретроспективные исследования на выборках большего объема. Возможно, комплексное изучение гена FMR1, неслучайной инактивации Х хромосомы, а также новых генов позволят расширить панель молекулярно-генетических маркеров СПКЯ.



