В конце ХХ века злокачественные опухоли женской репродуктивной системы во всем мире стали одним из главных факторов отрицательных демографических тенденций. Наиболее фатальной из них является рак яичников. В России в 2000 году от рака яичника умерли 7,3 тыс. больных (5,5% всех злокачественных новообразований у женщин). Пик смертности (6,7%) пришелся на возраст 40–59 лет [1].
Пятилетняя выживаемость больных варьирует в зависимости от стадии заболевания: около 70% – при I стадии, 45% – при II стадии, 17% – при III стадии, около 5% – при IV стадии. При этом практически у 80% больных рак яичников впервые диагностируются в III–IV стадиях, а пятилетняя выживаемость больных не превышает 30% [1–3].
Основными причинами столь неутешительных статистических тенденций является бессимптомное течение рака яичников на ранних стадиях и, как следствие, крайне низкий уровень его ранней диагностики, малоэффективное лечение, особенно при рецидивах заболевания. Стратегия повышения эффективности ранней диагностики рака яичников предполагает проведение массового и селективного скрининга женского населения, для осуществления которого требуются простые, надежные и доступные скрининговые методы, которые, к сожалению, пока отсутствуют [4, 5].
Большие надежды в 90-х годах прошлого века возлагались на маркер рака яичников СА125. Однако, как оказалось, чувствительность этого биомаркера составляет не более 65%. Кроме СА125 известно большое количество и других сывороточных маркеров рака яичников, однако ни один из них сам по себе не обладает высокой точностью, что, по-видимому, связано с гетерогенной этиологией рака яичников и сложным составом сыворотки крови [6, 7].

Интенсивное развитие протеомных технологий в начале ХXI века открыло новые перспективы для поиска биомаркеров заболеваний. Одной из наиболее перспективных технологий, используемых в этих целях, является масс-спектрометрия белковых чипов SELDI-TOF-MS (surface-enhanced laser desorption/ionization time-of-flight mass spectrometry – усиленная поверхностью времяпролетная лазерная десорбция/ионизация масс-спектрометрия) – экспрессный и высокоселективный метод для анализа белков и пептидов. Благодаря этому методу возникло новое направление – клиническая протеомика, которая занимается инвентаризацией белков человека, кодируемых его генами, дополняя, таким образом, геномные исследования. Именно состав белков определяет функциональное назначение каждой клетки, в том числе и опухолевой, а также отражает реализацию возможностей проявления имеющихся наследственных или приобретенных ею генетических дефектов. Изменение концентрации отдельных белков указывает на появление патологии и может быть использовано в диагностических целях. В настоящее время основной идеологией поиска новых малоинвазивных способов диагностики онкологических заболеваний, в том числе и рака яичников, является разработка диагностических систем на основе протеомного профилирования сыворотки крови для идентификации опухолевых маркеров [8].
Особый интерес вызывает сывороточный амилоид А острой фазы (A-SAA). Несмотря на то что этот белок давно известен как маркер воспаления, он обладает рядом уникальных свойств. Во-первых, его концентрация в сыворотке крови в норме в 10–100 раз ниже, чем концентрация других опухолевых маркеров. Во-вторых, при воспалении его концентрация увеличивается в 100 раз и более, тогда как концентрация большинства других маркеров меняется сравнительно слабо. В-третьих, известно, что A-SAA синтезируется в тканях некоторых злокачественных опухолей [9, 10]. Кроме того, была показана способность амилоида A индуцировать экспрессию транскрипционного фактора NFκB [11], играющего ведущую роль в блокировании апоптоза и матриксных металлопротеиназ MMP1, MMP3 и MMP9, вызывающих деградацию межклеточного матрикса и тем самым способствующих ангиогенезу и метастазированию [12, 13].

Вышеизложенные научные факты побудили нас предпринять клинико-экспериментальное исследование, направленное на поиск новых маркеров рака яичников с использованием как традиционных (иммуноферментный анализ (ИФА)), так и новейших протеомных (масс-спектрометрия SELDI-TOF) технологий.
 Целью исследования стало изучение возможностей повышения эффективности своевременной малоинвазивной диагностики рака яичников на основе использования комбинации сывороточных белков A-SAA и СА125, определяемых методами масс-спектрометрии и ИФА.
Целью исследования стало изучение возможностей повышения эффективности своевременной малоинвазивной диагностики рака яичников на основе использования комбинации сывороточных белков A-SAA и СА125, определяемых методами масс-спектрометрии и ИФА.
Материал и методы исследования
Как известно, выборки, используемые для разработки адекватного метода протеомной диагностики рака, должны соответствовать строгим требованиям [14]: должны отсутствовать статистически значимые отличия между сравниваемыми группами, кроме признака «наличие» или «отсутствие рака» конкретной локализации; вся исследуемая выборка, включающая группы сравнения, должна быть этнически гомогенной; сравниваемые группы должны включать в себя не только здоровых лиц, но и лиц, страдающих доброкачественными опухолями и неонкологическими заболеваниями; не должно быть различий в возрасте пациентов в сравниваемых группах; не должно быть различий в методиках получения и хранения образцов сывороток крови между сравниваемыми группами.
С учетом указанных требований нами была сформирована исследуемая выборка из 91 пациентки, подразделенная на 4 сравниваемые группы. В I группу вошли 34 пациентки больные раком яичников, во II группу – 14 пациенток с доброкачественными опухолями яичников, в III группу – 17 пациенток с миомой матки, в IV группу – 26 практически здоровых женщин (табл. 1).
Все пациентки исследуемой выборки являлись русскими по национальности средний возраст находился в пределах 41–47 лет.
Материалом исследования явились клинико-морфологические данные пациенток исследуемой выборки и сыворотки их крови. Взятие венозной крови у всех пациенток производилось натощак до начала любого вида лечения. Образцы инкубировались при комнатной температуре (18–20°С) в течение 30–40 минут до полного образования сгустка. После ретракции сгустка пробы центрифугировали в течение 10–15 минут, затем сыворотку сливали во вторичные пробирки и маркировали. Полученные пробы замораживали и хранили при температуре -70°С, вплоть до верификации диагноза.
Для определения концентрации A-SAA и CA125 использовали спектрофотометр Labsystems Multiscan PLUS, Финляндия. Для определения концентрации CA125 использовали набор для ИФА СА125 EIA (CanAg, Канада), для определения концентрации A-SAA – набор для ИФА Human SAA (Biosource, США). Анализ проводили в соответствии с протоколами производителя.
Профилирование сывороток крови проводили на масс-спектрометре SELDI-TOF Protein Biology System II (PBS II) (Ciphergen, США). Для оптимизации условий профилирования были использованы различные типы белковых чипов. Анализ пиков масс-спектров проводили в пределах 5500–17500 Да с использованием программы Biomarker Wizard.
Всю статистическую обработку материала проводили с помощью R-языка, находящегося в открытом доступе (www.r-project.org).
Для создания диагностического алгоритма были применены два метода классификации: метод опорных векторов (SVM) и метод логистической регрессии (LR) [15–19].
Для проверки чувствительности и специфичности разработанных диагностических моделей использовали 10-кратную перекрестную проверку достоверности с использованием метода пар с наибольшим счетом (TSP). Для анализа взаимосвязи между интенсивностью масс-спектрометричекого сигнала и концентрации амилоида А в сыворотке, измеренной методом ИФА, использовали ранговый коэффициент корреляции Спирмана.
Результаты исследования
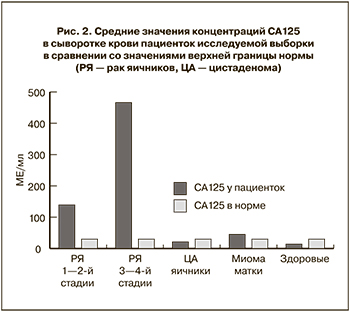
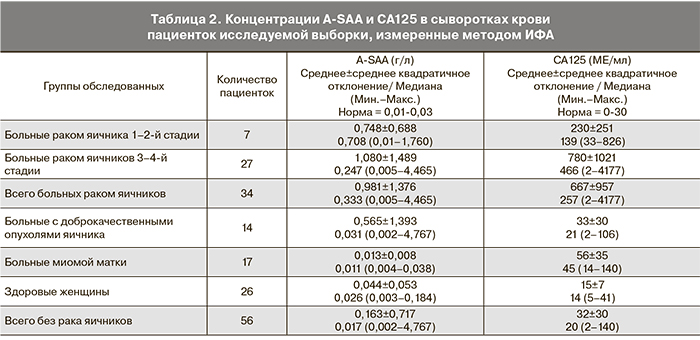
Значения концентраций A-SAA и CA125 в сыворотках крови пациенток исследуемой выборки, измеренные методом ИФА, представлены в табл. 2 и на рис. 1, 2.
Буквами по горизонтальной оси обозначены группы пациенток (субъектов): C – здоровые женщины, U – миома матки, B – доброкачественная опухоль яичника, O – рак яичника. Пунктирной линией показано примерное критическое значение A-SAA, идентифицирующее сыворотки крови больных раком яичников. Конкретные значения концентраций выше 1 г/л не показаны. Столбики, соответствующие ранней стадии рака яичников, выделены черным цветом.
Как можно видеть в табл. 2 и на рис. 1, у большинства больных раком яичников наблюдались значительно повышенные уровни A-SAA в сыворотке крови, вплоть до 3–4 г/л (в норме концентрация A-SAA составляет 0,01–0,03 г/л [20]), не связанные ни со стадией опухолевого процесса, ни с гистологическим типом опухоли. Из 7 пациенток, страдавших раком яичников ранних стадий, у 4 уровень A-SAA был чрезвычайно высоким (рис. 1). Следует отметить, что у некоторых пациенток, не страдающих раком яичников, концентрация A-SAA в сыворотке крови также была существенно выше по сравнению с принятой в литературе нормой, достигая значения 0,180 мг/мл. Так, у 2 из 14 пациенток с доброкачественными опухолями яичника уровень A-SAA в сыворотке крови достигал 3–4 г/л. У обеих пациенток гистологической структурой опухоли была серозная цистаденома яичника.
Полученные результаты показали, что A-SAA как маркер рака яичника обладает чувствительностью 50% (в 17 из 34 определенных случаев) и специфичностью 96,4% (в 54 из 56 определенных случаев) при критическом значении его концентрации 0,3 г/л.
Что же касается концентраций CA125, то у больных раком яичников она была значительно выше референсных значений (0–30 МЕ/мл), а у больных цистаденомой яичников и здоровых женщин не превышала нормативных показателей. У больных миомой матки значения концентраций CA125 незначительно превышали референсные значения. В то же время концентрация A-SAA во всех исследованных случаях миомы была очень низкой (табл. 2, рис. 2).
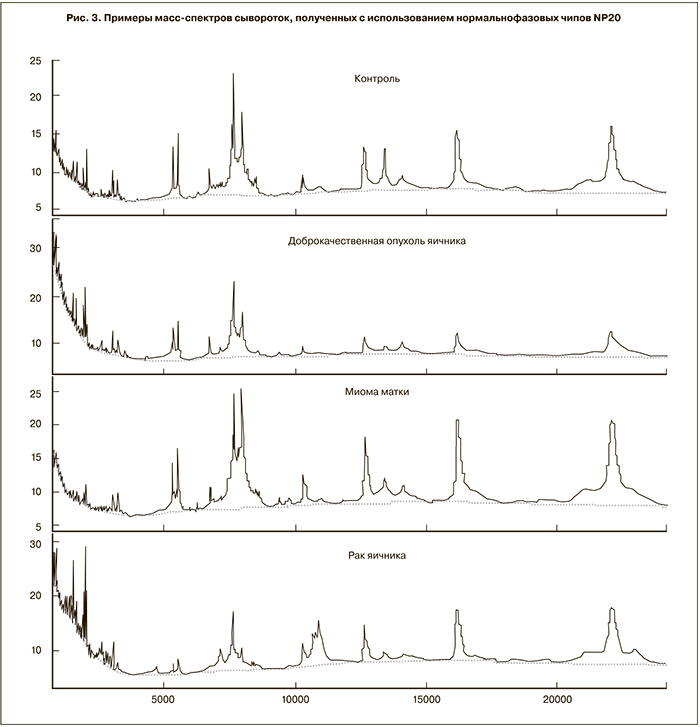
Для наилучшего определения пика, соответствующего A-SAA, был проведен подбор условий профилирования с использованием сывороток крови с известными концентрациями A-SAA (табл. 2). С этой целью были апробированы различные типы чипов (анионообменный, катионообменный, обращеннофазовый, нормальнофазовый). Наилучших результатов удалось добиться при применении нормальнофазовых чипов NP20 и предельно простой и быстрой процедуры профилирования, поэтому было проведено профилирование всех сывороток крови именно на NP20 чипах с помощью протокола снятия спектров, сфокусированное на массах 11,52–11,68 кДа. Примеры масс-спектров, полученные с использованием нормальнофазовых чипов NP20, приведены на рис. 3.
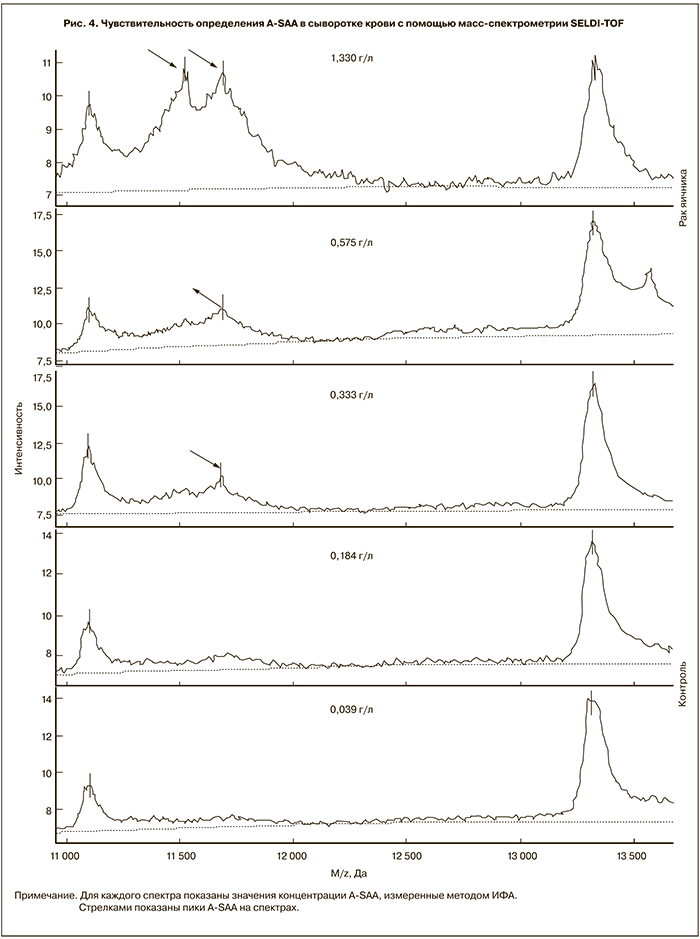
Все пики в спектрах определяли автоматически с помощью программы Ciphergen Protein с базовыми настройками. При этом пик массой 11,68 кДа был определен во всех сыворотках с концентрацией A-SAA 0,333 г/л и более (по данным ИФА). Другими словами, все 19 сывороток с концентрацией A-SAA выше 0,3 г/л имели хорошо выраженный пик в интересующем нас интервале значений m/z (рис. 4). Среди исследованных образцов сывороток крови не было таковых с концентрацией A-SAA в пределах от 0,333 до 0,184 г/л. Это обстоятельство позволяет утверждать, что чувствительность масс-спектрометрического определения A-SAA в сыворотке крови лежит в пределах концентраций 0,2–0,3 г/л (1,7–2,6×10-5 М), что показано пунктирной линией на рис. 1.
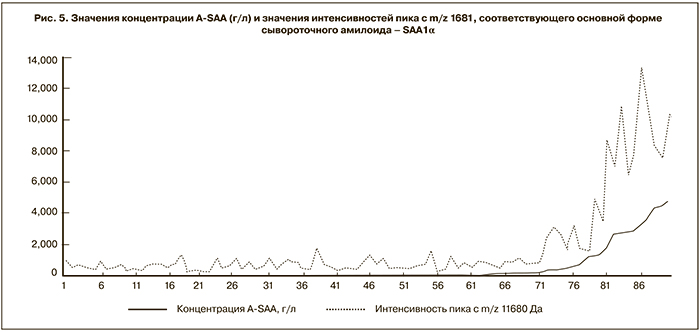
Нами установлена тенденция к увеличению интенсивности масс-спектрометрического сигнала, соответствующего сывороточному амилоиду А1α, с увеличением концентрации последнего, однако это увеличение не является монотонным (рис. 5).
Коэффициент корреляции Спирмана между концентрацией A-SAA в сыворотке и интенсивностью масс-спектрометрического сигнала составил 0,55, что соответствует умеренной корреляции. Невысокое значение коэффициента корреляции обусловлено тем, что в 72 из 91 пробы сывороточный A-SAA содержался в концентрации ниже 0,180 г/л, что находится ниже предела чувствительности определения A-SAA в сыворотке крови. При концентрациях A-SAA выше 1 г/л наступает насыщение и величина масс-спектрометрического сигнала не увеличивается. Кроме того, следует учитывать, что во многих сыворотках крови присутствует несколько пиков разных форм A-SAA, но ИФА позволяет измерить только его суммарное содержание.
Полученные результаты свидетельствуют, что масс-спектрометрическая детекция A-SAA не является количественной, однако она позволяет определять A-SAA в сыворотке крови при его концентрациях 0,3 г/л и выше. Критический уровень 0,2–0,3 г/л соответствует 1,7–2,6×10-5 M.
Следует отметить, что критический уровень A-SAA, определяемый с помощью масс-спектрометрии SELDI-TOF, очень близок к критическому уровню этого белка для ряда воспалительных заболеваний [21, 22] и поэтому дает возможность использовать прямое масс-спектрометрическое профилирование для быстрого определения повышенного уровня A-SAA в сыворотке.
Для каждого спектра показаны значения концентрации A-SAA, измеренные методом ИФА. Стрелками показаны пики A-SAA на спектрах.
Масс-спектрометрическое определение масс методом SELDI-TOF-MS обладает невысокой точностью. Тем не менее, поскольку спектры были откалиброваны с использованием в качестве внешних стандартов белков, близких по массе к A-SAA, погрешность в определении массы A-SAA не превышала 3–5 Да, что позволяет различить различные формы A-SAA в сыворотках с содержанием A-SAA более 0,3 г/л.
Так как данные масс-спектрометрии в целом аналогичны данным ДНК-микрочипов, мы применили TSP-классификацию к спектрам исследуемой выборки, что позволило выявить только одну пару с наибольшим счетом, состоящую из интенсивностей пиков 11681 Да и 13769 Да. В случае если разность интенсивностей указанных пиков положительна, исследуемый образец классифицировали как «рак», если отрицательна, то как «отсутствие рака». Оба пика выбранной пары соответствовали известным маркерам рака яичника. Так, пик с m/z 11681 Да соответствует основной форме A-SAA [14], концентрация которого при раке яичника повышается, а пик с m/z около 13769 Да соответствует нативной форме транстиретина, концентрация которого понижается при раке яичника [23].
Пара маркеров, отобранная в нашем исследовании, – А-SAA-TTR представляет собой новую бинарную переменную (разность интенсивностей, принимающую положительные или отрицательные значения), которую можно комбинировать с данными ИФА для улучшения классификации.
С целью определения оптимального набора протеомных данных, которые могли бы использоваться для диагностики рака яичников, нами был предпринят многофакторный анализ методами опорных векторов (SVM) и логистической регрессии (LR). В качестве исходных данных были апробированы различные варианты комбинаций протеомных данных:
Концентрации Са125, измеренные методом – ИФА – SVM (CA125).
Концентрации CA125 и А-SAA, измеренные методом ИФА – SVM (ИФА).
Значения интенсивностей 48 SELDI-MS m/z пиков, определенные методом масс-спектрометрии – SVM RFE (MS).
Концентрации CA125 и А-SAA, измеренные методом ИФА и данные масс-спектрометрии – SVM (TSP(MS)+ИФА).
Концентрации CA125 и А-SAA, измеренные методом ИФА и формализованные данные масс-спектрометрии (две переменные, отобранные методом пар с наибольшим счетом), – SVM RFE (ИФА+MS).
Эффективность диагностических алгоритмов, полученных на основе указанных комбинаций с помощью классификаторов SVM и LR, проверяли путем перекрестной проверки на достоверность. Доверительный интервал вычисляли для доверительной вероятности, равной 0,05.
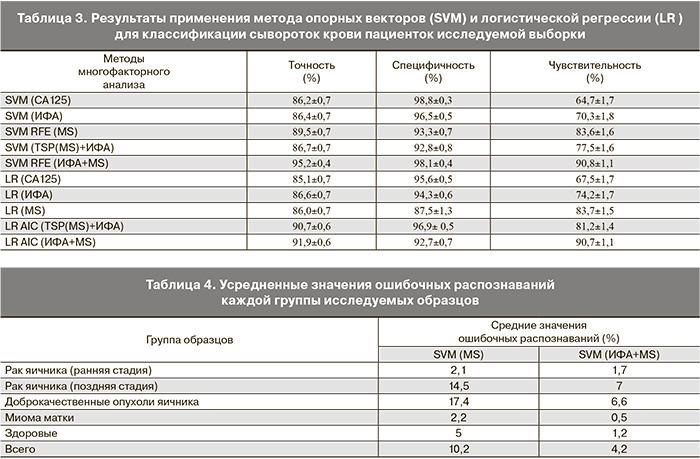
Результаты многофакторного анализа представлены в табл. 3. Значения точности, чувствительности и специфичности полученных диагностических алгоритмов свидетельствуют, что добавление значений концентраций А-SAA к значениям концентраций CA125 не приводит к повышению точности классификации, несмотря на то что у некоторых больных раком яичников уровень А-SAA был существенно повышен на фоне нормального уровня CA125.
Многофакторный анализ данных масс-спектрометрии методом опорных векторов дал лучшие результаты, чем метод логистической регрессии: точность метода опорных векторов (SVM) для данных масс-спектрометрии оказалась значительно выше, чем при использовании только концентрации CA125 (89,5 против 86,1%, соответственно).
LR-классификатор, напротив, дал существенно лучшие результаты, чем SVM при обработке бинарных данных методом пар с наибольшим счетом (TSP) в комбинации с данными ИФА, причем данные TSP существенно повысили точность классификации (90,7% по сравнению с 85–86% только для CA125).
Наилучшей точности распознавания рака яичников и его отсутствия, составившей 95,2%, удалось достичь при использовании метода опорных векторов для анализа комбинированных данных ИФА и масс-спектрометрии.
Для методов классификации, построенных с использованием метода опорных векторов на основе только масс-спектрометрических данных и на основе комбинации масс-спектрометрических данных с данными ИФА, был проведен подробный анализ результатов перекрестной проверки достоверности.
В табл.4 приведен усредненный процент ошибочных диагнозов для каждой исследованной группы. Как можно видеть, наибольшим этот процент оказался в группе сывороток больных доброкачественными опухолями яичника. Следует отметить, что согласно полученным нами данным, рак яичников на ранних стадиях диагностируется не хуже, чем рак на более поздних стадиях. Из 7 исследованных сывороток больных раком на ранней стадии 4 были правильно диагностированы все 100 раз.
Что же касается сывороток крови больных миомой матки, то все они были распознаны правильно, так что средний процент ошибок в группе больных миомой матки оказался ниже такового для группы здоровых женщин.
Обсуждение
Результаты проведенного исследования показали, что используя масс-спектрометрическую технологию SELDI-TOF можно с достаточно высокой эффективностью распознавать сыворотки крови больных раком яичников, здоровых женщин и больных доброкачественными опухолями яичников и миомой матки.
Основой разработанной экспериментальной диагностической системы являются масс-спектрометрические данные, использование которых в отдельности позволило получить точность диагностики около 90%. Добавление к масс-спектрометрическим данным значений концентраций A-SAA и СА125, измеренных ИФА, привело к повышению точности диагностики до 95,2%. Наилучшие результаты были достигнуты при применении метода опорных векторов.
Преимуществом предложенного нами метода профилирования является его простота. Отсутствие стадий префракционирования сыворотки приводит к повышению воспроизводимости результатов и увеличивает шансы на внедрение методики в практическую диагностику.
Полученные результаты могут служить предпосылками для разработки специального аппаратно-программного комплекса.
Заключение
А-SAA определяется методом масс-спектрометрии SELDI-TOF в сыворотке крови при критическом значении его концентрации 0,3 г/л и выше, измеряемой методом ИФА, что соответствует 1,7–2,6×10-5 M.
Как самостоятельный маркер рака яичников А-SAA, определяемый методом масс-спектрометрии SELDI-TOF, обладает чувствительностью 50% и специфичностью 96,4%. Но надо отметить, что добавление к данным масс-спектрометрической детекции А-SAA значений концентраций A-SAA и СА125, измеряемых методом ИФА, позволяет повысить точность диагностики рака яичников до 95%. Именно эти полученные результаты являются научно обоснованной предпосылкой для разработки специального аппаратно-программного комплекса для осуществления как протеомного скрининга, так и ранней и дифференциальной диагностики рака яичников.



