В последнее десятилетие произошли значительные изменения в представлении о патогенезе серозных опухолей яичника. Прежде всего это коснулось серозных карцином яичника высокой степени злокачественности (СКЯВСЗ), в качестве основного предшественника которых в настоящее время рассматривается серозная интраэпителиальная карцинома маточной трубы (СТИК) [1]. В то же время появилось предположение, высказанное R. Kurman и соавт. о том, что папиллярная гиперплазия маточной трубы (ПГМТ) может быть патогенетически связана с серозными пограничными опухолями яичника (СПОЯ). По мнению данных авторов, три механизма могут объяснить связь между ПГМТ и СПОЯ: во-первых, поражения маточной трубы и яичников могут возникать самостоятельно в результате существования так называемого «опухолевого поля» по W. Willis. Во-вторых, поражение яичников при СПОЯ может быть первичным и скопления «отшнурованных» мелких папиллярных структур в просвете маточных труб, таким образом, носят вторичный характер. В-третьих, поражение маточной трубы может быть первичным, а яичников – вторичным в результате отделения патологического участка эндосальпинкса фимбриального отдела маточной трубы и прикрепления его на поверхность яичника [2]. Однако не во всех работах, посвященных гиперплазии эпителия маточной трубы, выявлена четкая взаимосвязь между патологией эпителия маточных труб и развитием СПОЯ [3]. Поэтому вопрос о значении ПГМТ в патогенезе СПОЯ остается открытым. Кроме того, в настоящее время не изучена экспрессия супрессора опухолевого роста р53 при ПГМТ, в то время как появление мутаций гена ТР 53 и изменение синтеза его белкового продукта являются наиболее важными в патогенезе серозных карцином яичника.
В связи с этим целью нашей работы стал анализ изменений эндосальпинкса маточных труб при СПОЯ и СКЯВСЗ и определение молекулярно-биологических особенностей ПГМТ.
Материал и методы исследования
В исследование включили материал от 81 пациентки (105 маточных труб и 33 яичника): 34 пациентки (52 маточные трубы) с гистологически верифицированными СПОЯ, средний возраст 42,7±5,6; 33 пациентки (33 маточных трубы) с СКЯВСЗ (средний возраст 47,6±3,4 года) и 14 пациенток (20 маточных труб) с экстраовариальной патологией (миомой матки и аденомиозом) (средний возраст 49,71±3,53 года). Исследование маточных труб пациенток, включенных в исследование, проводилось в соответствии с протоколом для исследования маточных труб при СПОЯ и серозных раках яичника (SEE-FIM протокол) [4]. Данный протокол регламентирует исследование всей маточной трубы, причем фимбриального отдела – наиболее тщательно. Таким образом, увеличилось число исследуемых фрагментов маточной трубы и доступность фимбриального отдела. Для верификации ПГМТ использовали критерии, предложенные R. Kurman: наличие мелких округлых кластеров из эпителиальных клеток эндосальпинкса и мелких папиллярных структур в просвете маточной трубы (не менее 3 в срезе), которые могут быть ассоциированы с псаммомными тельцами. В работе использовали гистологический и иммуногистохимический (ИГХ) методы исследования. После фиксации в 10% растворе нейтрального формалина в течение 24 часов и стандартного протокола проводки, материал заливали в парафин. Далее проводили окрашивание гематоксилином и эозином. Для ИГХ исследования готовили срезы толщиной 4 мкм, которые наносили на высоко адгезивные стекла и сушили при температуре 37°С в течение 18 часов. После снятия парафина со срезов, их регидратировали в батарее спиртов 95, 80 70, инкубируя в каждом растворе по 2 минуты. Восстановление антигенной активности проводили в PT Link («Dako») при температуре 97°С в течение 20 мин. в 10 мМ цитратном буфере рН 6,0. Остывшие стекла помещали во влажные камеры (для предотвращения высыхания срезов) и инкубировали 15 минут в 3% растворе перекиси водорода для блокирования эндогенной пероксидазы. Реакцию с первичными антителами проводили в течение 30 минут при комнатной температуре. В исследовании использовались моноклональные антитела к p53 (clone D07, Dako Denmark) и к Ki-67 (clone MIB-1, Dako, Denmark). Для визуализации мест связывания антител с антигенами использовали реакцию окисления субстрата 3,3-диаминобензидина (ДАБ) пероксидазой хрена в присутствии перекиси водорода с образованием водонерастворимого конечного продукта коричневого цвета системы «EnVision» («Dako Cytomation»). Для правильной постановки ИГХ реакций ставили положительные и отрицательные контроли. В качестве отрицательных контролей брали образцы исследуемых срезов, которые подвергались стандартной процедуре ИГХ реакции, но без добавления первичных антител. Положительные контроли для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя (препарат миндалины для Ki-67, препарат рака молочной железы для р53). После проведения ИГХ реакций срезы контрастировали гематоксилином и заключали в синтетическую среду «Shandon mount TM» (USA). Оценка результатов ИГХ реакций осуществлялась следующим образом: экспрессия Ki-67 подсчитывалась в % окрашенных ядер клеток на 3000 клеток одного типа [5], при оценке экспрессии р53 подсчитывался процент положительно окрашенных ядер клеток, также учитывалась интенсивность окраски: выделяли слабо окрашенные ядра клеток (предполагают, что в большинстве случаев при данном окрашивании выявляется дикий тип р53) или сильно окрашенные ядра клеток (такая окраска может быть характерна для мутантного типа р53) [6]. Статистический анализ проводился с использованием критерия Манна–Уитни.
Результаты и обсуждение
Морфологическое исследование: Для маточных труб с ПГМТ была характерна следующая макроскопическая картина: длина маточных труб варьировалась от 5 до 8 см, диаметр просвета – от 0,6 до 1 см, в некоторых случаях на наружной поверхности маточной трубы отмечалось формирование спаек, в 35% случаев фимбриальный отдел был гипертрофирован, в 47% – частично запаян. Микроскопическая картина была следующей: под небольшим увеличением (х100) архитектоника складок эндосальпинкса выглядела отличной от неизмененной маточной трубы, складки более плотно лежали друг к другу, образовывали сложный рисунок. Под большим увеличением (х400) были хорошо видны «отшнурованные» мелкие папиллярные структуры, которые свободно лежали в просвете трубы. Они состояли из центральной части, представленной стромой, которая была окружена однослойным эпителием, включающим реснитчатые и секреторные клетки, а также интраэпителиальные лимфоциты. Митотические фигуры встречались редко, признаков, характерных для СТИК не отмечалось. Также визуализировались псаммомные тельца (микроскопические шарообразные слоистые образования, возникающие вследствие выпадения в тканях белково-липидных субстанций, подвергающихся инкрустации солями кальция). Они могли быть отдельно лежащими или окружены эпителиальными клетками (так называемые «сальпинголиты») и локализоваться как в просвете маточной трубы, так и в области эпителиального пласта или lamina propria (рис. 2А см. на вклейке).
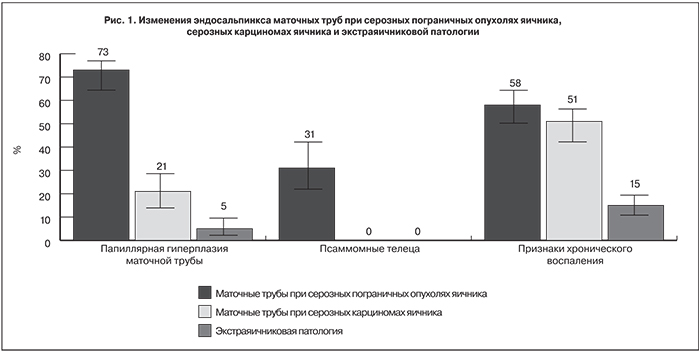
ПГМТ была выявлена в 38 маточных трубах при сопутствующих СПОЯ. При этом наличие «отшнурованных» мелких папиллярных структур обнаруживалось в 38 маточных трубах, псаммомных телец – в 15. При СКЯВСЗ ПГМТ была выявлена в 7 маточных трубах (в сочетании со СТИК), наличие «отшнурованных» мелких папиллярных структур было зафиксировано в 7 маточных трубах, псаммомных телец обнаружено не было (р<0,05). При экстраовариальной патологии ПГМТ была верифицирована в 1 маточной трубе, наличие «отшнурованных» мелких папиллярных структур выявлялось в 1 маточной трубе, псаммомных телец обнаружено не было (р<0,05) (рис. 1).
Согласно литературным данным термин «гиперплазия маточной трубы» (ГМТ) давно применялся отдельными авторами, однако точные критерии для верификации этой патологии предложены не были [3, 7, 8]. Спорным оставался и вопрос о том, действительно ли ГМТ ассоциирована с СПОЯ: так, два крупных исследования, посвященных этой теме, дали противоположные результаты. S. Robey и E. Silva [8] выявили сочетание ГМТ с СПОЯ 68,7% (в группе контроля частота ГМТ была равна 25,9% (р<0,01). Совершенно иные результаты были получены I. Yanai-Inbar и соавт. [3], которые не выявили достоверных различий и четкой ассоциации ГМТ с какой-либо из изученных ими патологий женской репродуктивной системы. Взяв за основу эти два исследования, R. Kurman и соавт. учли все недостатки предыдущих работ и провели собственное исследование патологии маточных труб при сопутствующих СПОЯ. Для того чтобы не упустить связи ГМТ с развитием СПОЯ, ими были разработаны достаточно жесткие критерии для постановки диагноза ГМТ, которые использовались и при проведении нашего исследования. Учитывая первостепенную роль формирования папиллярных структур в развитии ГМТ, авторы предложили термин «папиллярная ГМТ», которая была выявлена R. Kurman в 91% маточных труб при сопутствующих СПОЯ. В результате нашего исследования ПГМТ была диагностирована в 73% случаев маточных труб при СПОЯ. Возможно, более низкий процент ПГМТ по сравнению с исследованием R. Kurman связан с более жестким критерием верификации «отшнурованных» мелких папиллярных структур в нашем исследовании, так как в классификации ВОЗ четкого критерия размеров таких структур не выделено, и нами учитывались лишь отдельно лежащие кластеры, содержащие только эпителиальные клетки или минимальное количество стромы (размер <0,1 мм).
Также нами были выявлены статистически значимые различия в отношении формирования «отшнурованных» мелких папиллярных структур между группой пациенток с СПОЯ, СКЯВСЗ и экстраовариальной патологией (p<0,05). Псаммомные тельца в нашем исследовании выявлялись только в маточных трубах при сопутствующих СПОЯ (в 30%), таким образом статистически значимые различия в отношении наличия данных структур также были выявлены между всеми группами (р<0,05). Существенная роль псаммомных телец подчеркивалась и в других исследованиях, авторы которых, однако, получили более высокие показатели – 50–57% [2, 9, 10]. Кроме того, в маточных трубах при сопутствующей СПОЯ и в маточных трубах с верифицированными СТИК в 58% и в 51% соответственно определялись признаки хронического воспаления, отсутствующие при экстраовариальной патологии (р<0,05) (рис. 1). Схожие результаты были получены и R. Kurman (47–71%) [2]. Эти результаты могут свидетельствовать о наличии патогенетической связи между воспалением и развитием ПГМТ и СТИК, поскольку с одной стороны в зоне воспаления происходит экспрессия нормальными эпителиальными клетками рецепторов к цитокинам, хемокинам, иммунорегуляторным и ростовым факторам, с другой стороны – синтез этими же клетками цитокинов, эйкозаноидов, эндотелинов, дефенсинов, молекул межклеточных взаимодействий, оксида азота, благодаря чему эпителиальные клетки взаимодействуют с индукторами и эффекторами воспаления. В свою очередь медиаторы и продукты воспаления могут способствовать усилению пролиферации и инициации канцерогенеза. На молекулярном уровне реактивные формы кислорода и азота, а также альдегиды, продуцируемые при хронической инфекции эффекторами воспаления, могут индуцировать в эпителиоцитах повреждения ДНК, генные мутации, посттрансляционные модификации ключевых белков, которые «закрепляются» в зоне поражения благодаря пролиферации эпителиальных клеток [11]. В настоящее время не получено достаточно данных о генном профайлинге ПГМТ, хотя W.C. Huang и соавт. не выявили мутаций KRAS и BRAF в области ПГМТ при сопутствующей СПОЯ, в которой мутации в этих генах имели место [12]. Этот факт может свидетельствовать о том, что ПГМТ является более ранним этапом патогенеза СПОЯ и что переход в пограничную опухоль происходит только на этапе закрепления мутаций в генах BRAF, KRAS и др. Однако необходим более подробный генетический анализ ПГМТ, чтобы сделать вывод о том, какие именно мутации и на каком этапе развития происходят при развитии ПГМТ и СПОЯ.
Несмотря на то, что все маточные трубы исследовались с помощью SEE-FIM протокола, доля срезов, в которых была выявлена «отшнуровка» мелких папиллярных структур для маточных труб с сопутствующими СПОЯ, превысила 95%. Данный факт может свидетельствовать о том, что развитие ПГМТ носит диффузный характер, а не ограничивается только фимбриальным (или другим) отделом маточной трубы. Данное положение подтверждается исследованием R. Kurman и соавт., в котором для оценки большинства маточных труб (68%) были доступны лишь 1–4 среза, однако признаки ПГМТ были выявлены в подавляющем большинстве случаев, и в 75% они были диагностированы во всех доступных для исследования срезах [2].
СТИК была верифицирована в соответствии с алгоритмом R. Kurman и соавт. [13] и выявлена в 31,0% маточных труб при СКЯВСЗ, но не выявлялась при СПОЯ и при экстраовариальной патологии (p<0,05). Следует отметить, что зарубежные авторы сообщают о большом разбросе данных по частоте встречаемости СТИК при СКЯВСЗ (от 19 до 75%) [14–16]. Меньшую частоту СТИК в данном случае можно объяснить недоступностью фимбриального отдела для изучения в некоторых случаях, большую – тем, что в ряде работ применялось тотальное ИГХ-исследование маточных труб (а не только фимбриального отдела), а также серийных срезов, которые, как было показано, также позволяют увеличить выявляемость СТИК [17].
Иммуногистохимическое исследование
При ПГМТ слабое окрашивание ядер клеток эпителия маточной трубы на р53 отмечалось в 70% клеток и было выявлено в 85% случаев. При ПГМТ в 90% случаев экспрессия Ki-67 была низкой (менее 5%), в 10% отмечалась сильная экспрессия Ki-67 (65%) (рис. 2 А-В см. на вклейке). При СТИК сильное окрашивание р53 отмечалось в 75% и более атипических клеток, в этих же участках была выявлена высокая экспрессия Ki-67 (>85%) (рис. 2 Г-Е см. на вклейке).
При экстраовариальной патологии слабое окрашивание ядер клеток эпителия маточной трубы р53 было выявлено в 90% случаев, при этом процент окрашенных ядер в среднем составил 20%, экспрессия Ki-67 во всех случаях была низкой (<5%).
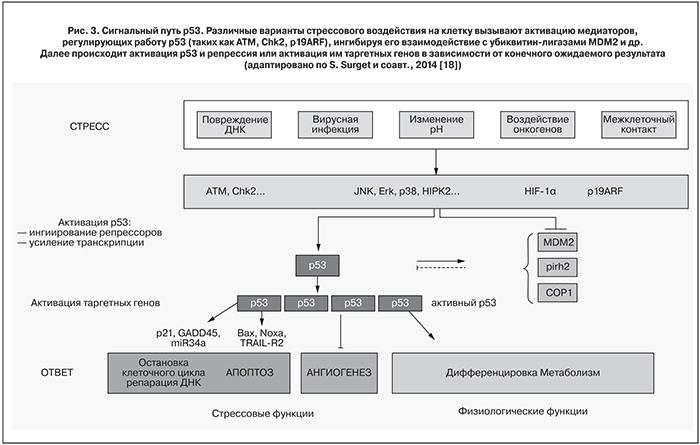
При ИГХ-исследовании маточных труб было выявлено, что экспрессия р53 в ядрах клеток не является абсолютно специфической только для СТИК и может выявляться при ПГМТ. В то же время выявленное нами слабое окрашивание р53 в сочетании с низким пролиферативным индексом по Ki-67 отличается от высокой экспрессии р53 и Ki-67 при СТИК. Это можно объяснить несколькими причинами. Во-первых, различие в экпрессии р53 при ПГМТ и СТИК может свидетельствовать о накоплении различных изоформ белка р53 при данных патологических состояниях. Во-вторых, молекулярные изменения могут опережать изменение фенотипа клеток в зоне поражения. В-третьих, при ПГМТ может происходить накопление дикого типа р53, и это косвенно свидетельствует о повреждении ДНК и репрессии таких регуляторов р53 как MDM2, pirh2, COP1 (рис. 3).
В данном случае накопление р53 при ПГМТ можно рассматривать в качестве предиктора возможной опухолевой трансформации, однако для возникновения опухоли необходим ряд дополнительных молекулярно-биологических событий. Во-первых, для отделения патологически измененного эпителия маточной трубы и прикрепления его к поверхности яичника, на территории которого он может дать начало развитию СПОЯ, необходимо наличие определенных свойств базальной мембраны в области поражения. Данный аспект в настоящее время для ПГМТ не изучен, однако для СТИК было показано характерное усиление продукции эпителиальными клетками laminin-gamma1, который, как полагают, ответственен за прикрепление, предотвращение анаикоза и диссеминацию пораженного трубного эпителия [19]. Во-вторых, для СПОЯ в 60–88% характерно наличие мутаций BRAF и/или KRAS, которые не выявляются в ПГМТ [11, 20, 21]. Следовательно, их возникновение может быть промежуточным звеном между развитием ПГМТ и СПОЯ, а накопление дикого типа р53 при ПГМТ – предиктором возможной опухолевой трансформации.
Таким образом, одним из возможных вариантов развития СПОЯ является следующая последовательность событий: хроническое воспаление индуцирует пролиферацию эпителия маточной трубы, который затем развивается в ПГМТ; у некоторых женщин папиллярные разрастания слущиваются и имплантируются на поверхность яичника, где дают начало СПОЯ. Следует отметить, что ГМТ обнаруживается не во всех случаях СПОЯ (в нашем исследовании – в 27%, а в исследовании R. Kurman – в 9% случаев признаков ГМТ зафиксировано не было). Относительно этих наблюдений можно предположить, что нормальный эпителий маточной трубы также может имплантироваться на поверхность яичника во время овуляции, когда нарушена целостность поверхностного эпителия яичника и фимбрии маточной трубы напрямую контактируют с «оголенной» поверхностью яичника. Аналогичные модели развития СПОЯ обсуждаются и другими авторами [11, 22].
Заключение
В результате полученных нами данных можно заключить, что развитие ПГМТ статистически значимо связано с развитием СПОЯ. Использование SEE-FIM протокола позволяет достоверно выявлять изменения эндосальпинкса, но не играет ключевой роли для постановки диагноза ПГМТ. Также в нашем исследовании в 27% случаев СПОЯ ПГМТ не диагностирована, что дает основание предложить как минимум два пути развития СПОЯ из эпителия маточной трубы – через ПГМТ и из нормального эпителия маточной трубы путем образования инклюзионных кист трубного происхождения в яичнике и дальнейшего развития в них СПОЯ. ИГХ-анализ изученного материала показал, что для ПГМТ характерны низкий пролиферативный индекс и выявление слабого окрашивания р53, что может быть сопряжено с накоплением дикого типа р53, экспрессией изоформ р53, отличных от тех, которые характерны для СТИК и опережением молекулярных перестроек фенотипического изменения эпителия. В то же время для СТИК свойственна высокая экспрессия Ki-67 и сильное окрашивание р53, что может свидетельствовать о накоплении мутантного р53.
Таким образом, результаты нашего исследования косвенно подтверждают гипотезу о том, что может существовать два различных пути патогенеза серозных карцином яичника – формирование СТИК приводит к развитию СКЯВСЗ, формирование ПГМТ – к развитию СПОЯ и далее – серозной карциномы яичника низкой степени злокачественности.



