В последнее десятилетие значительно расширилось представление о патогенезе рака яичников [1, 2], который по-прежнему остается наиболее частой причиной смерти пациенток с новообразованиями органов женской репродуктивной системы [3, 4].
Результатом многочисленных морфологических и молекулярно-генетических исследований стало подразделение овариальной карциномы на два типа, имеющие различные структурные особенности и клиническое течение. К первому типу относят низкоагрессивные серозную, эндометриоидную, муцинозную и светлоклеточную карциномы. Эти опухоли представляют собой кистозные образования, ограниченные яичником, с нечеткой границей, наличием мутаций KRAS, BRAF, PTEN, PIK3CA, CTNNB1, ARID1A и PPP2R1A. Особенностью данной патологии является медленное прогрессирование доброкачественного поражения в пограничное с постепенно возрастающей степенью атипии и в последующем развитие неинвазивной и инвазивной низкоагрессивной карциномы. Ко второму типу злокачественных опухолей яичника относят высокоагрессивные серозную, эндометриоидную, недифференцированную карциномы и злокачественные смешанные мезодермальные опухоли. Им присущ быстрый рост, генетическая гомогенность, диагностирование на поздних стадиях, торпидное течение [5, 6].
В конце 1990-х гг. – начале 2000-х гг. с целью снижения риска развития серозного рака у женщин с наличием BRCA1 и BRCA2 мутаций широкое распространение получила профилактическая сальпингооварэктомия. При морфологическом исследовании материала, полученного в результате этой манипуляции, в 5–15% случаев наряду с неизмененными яичниками была выявлена серозная трубная интраэпителиальная карцинома (англ. Serous tubal intraepithelial carcinoma – STIC), располагавшаяся преимущественно в фимбриальном отделе [7, 8] и характеризующаяся многорядностью эпителия, гиперхромными атипическими ядрами клеток, наличием митозов, повышенной экспрессией маркеров р53 и ki-67 при иммуногистохимическом исследовании [9]. Дальнейшие исследования выявили STIC у 10–15% женщин с BRCA1 и BRCA2 мутациями [10] и у 50–60% женщин с серозной карциномой [11]. Кроме того, в образцах STIC и серозной карциномы была обнаружена идентичная ТР53 мутация, что доказывает их единое происхождение [12].
В литературе имеются сведения о том, что STIC также патогенетически связана с развитием высоко агрессивной первичной серозной перитонеальной карциномы, которая является редкой злокачественной опухолью брюшной полости. Первичная серозная перитонеальная карцинома по клиническим проявлениям, гистологическому строению и генетическому профилю имеет сходство с серозной карциномой яичника [13, 14], однако отличается обширным вовлечением в патологический процесс сальника и менее успешным воздействием химиотерапевтических препаратов [15].
По мнению ряда авторов, возникающая вследствие хронического воспалительного процесса «папиллярная трубная гиперплазия», характеризующаяся кластерами трубного эпителия или мелкими папиллярными структурами, присутствием псаммомных телец, возможно, предшествует низкоагрессивной серозной карциноме яичников. Подтверждение этой гипотезы послужит доказательством развития обоих типов карциномы яичника (низко- и высокоагрессивной) из эпителия маточной трубы, и вторичного вовлечения яичника в процесс канцерогенеза [16, 17].
Учитывая вышесказанное, не вызывает сомнения необходимость тщательного исследования маточных труб у всех пациенток гинекологического профиля и выявления патологических изменений трубного эпителия с целью определения дальнейших адекватных лечебных мероприятий.
Клиническое наблюдение
Вниманию представляется клиническое наблюдение пациентки 50 лет с миомой матки, проявляющейся менометроррагией и вторичной анемией. По поводу вышеуказанного диагноза лапароскопическим доступом были произведены гистерэктомия, правосторонняя аднексэктомия, левосторонняя тубэктомия. При интраоперационном осмотре левый яичник выглядел неизмененным и был сохранен.
При макроскопическом исследовании размеры тела матки составили 8×7,5×6 см, в области правого угла и задней стенки визуализировались два миоматозных узла, деформирующих полость матки. Узлы диаметром 3 и 5 см имели сферическую форму, псевдокапсулу, плотноэластическую консистенцию, на разрезе – белесовато-серый цвет, волокнистое строение. Толщина передней и задней стенки матки вне узлов – 2,4 см, слизистая тела матки равномерной толщины – 0,2 см. Шейка матки 2,5×2,3×2,1 см, на разрезе с присутствием единичных кист диаметром до 0,5 см, заполненных слизью. Правый яичник размерами 4,1×3,2 см, отличался наличием спаек на серозной поверхности, содержал кистозное образование диаметром 3,1 см с гладкой, блестящей внутренней поверхностью. Правая маточная труба длиной 6 см, диаметром 0,5 см, спаяна плоскостными спайками с правым яичником. Левая маточная труба размерами 6,5×0,5 см. Взятие материала на исследование и приготовление гистологических препаратов осуществлялись стандартным способом. Маточные трубы были исследованы полностью.
При микроскопическом исследовании диагностированы лейомиома тела матки с подслизистым расположением одного из узлов, очаговый аденомиоз, эндометрий стадии пролиферации, ретенционные кисты шейки матки, серозная цистаденома правого яичника, правосторонний хронический периоофорит и перисальпингит. В фимбриальном отделе левой маточной трубы обнаружен участок серозной интраэпителиальной карциномы с увеличенными округлыми клетками с полиморфными, гиперхромными ядрами, глыбчатым ядерным хроматином, увеличенным ядерно-цитоплазматическим соотношением, псевдомногорядностью эпителия, потерей полярности, отсутствием ресничек на поверхности клеток, повышенной митотической активностью. Правая маточная труба, включая фимбриальный отдел, имела обычное строение. Вместе с тем, микроскопические фрагменты серозной карциномы были выявлены в спайках на поверхности правого яичника (рисунок А, Г). Образцы левой маточной трубы и правого яичника с очагами опухоли были подвергнуты иммуногистохимическому исследованию с использованием моноклональных антител к p53 (clone D07, Dako Denmark) и к Ki-67 (clone MIB-1, Dako, Denmark). В препарате фимбрий левой маточной трубы в участке карциномы выраженное окрашивание p53 отмечалось в более 75% атипических клеток, высокая экспрессия ki-67 – в более 80% (рисунок Б-В). В образцах очага опухоли в спайках на поверхности правого яичника выявлено более 50% позитивных в отношении р53 и более 75% – ki-67 клеток (рисунок Д-Е).
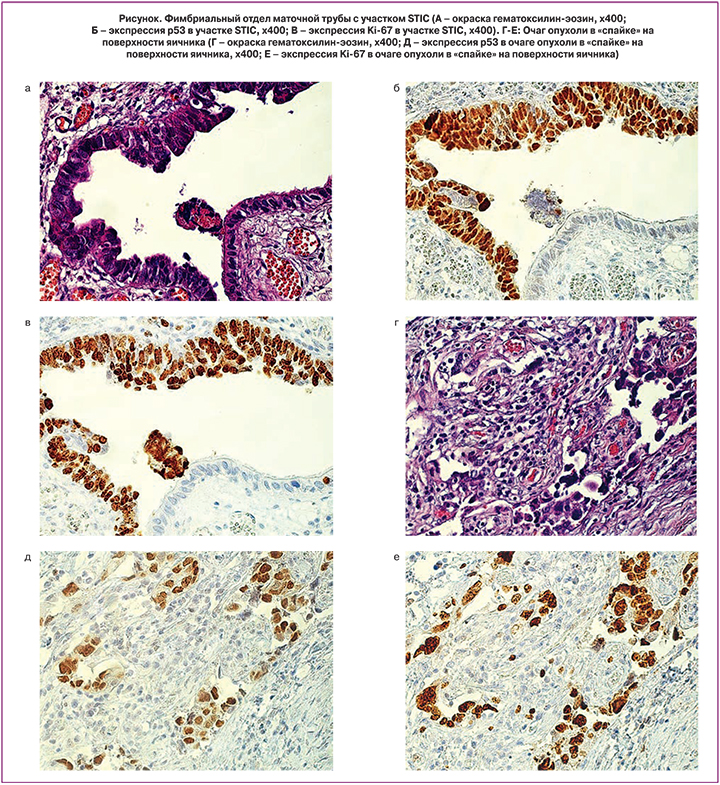
Полученные результаты иммуногистохимического изучения экспрессии маркеров ki-67 и р53 указывают на высокую пролиферативную активность и наличие ТР53 мутации в препаратах серозной карциномы фимбриального отдела левой маточной трубы и в спайках на поверхности правого яичника, что позволяет отнести данное поражение ко второму высоко агрессивному типу, включающему серозную трубную интраэпителиальную карциному и серозный рак яичников или первичную серозную перитонеальную карциному. Взаимосвязь ТР53 мутации с высоко агрессивной серозной карциномой доказали R. Kuhn и соавт. в своей работе по генетическому исследованию 29 образцов серозной карциномы и сосуществующей STIC. Авторы выявили соматические мутации ТР53 во всех 29 фрагментах и идентичные мутации ТР53 в 27 из 29 случаев серозной карциномы и STIC [18].
А. Yemelyanova и соавт. при иммуногистохимическом и генетическом изучении 43 высоко агрессивных серозных карцином яичника и первичных серозных перитонеальных карцином, установили, что иммуногистохимическое исследование экспрессии р53 в опухоли может служить альтернативой генетическому определению мутации ТР53. При этом интенсивное диффузное окрашивание более 60% клеток указывает на наличие миссенс-мутации, а полное отсутствие окрашивания – на нонсенс-мутацию [19]. Согласно данным литературы, отсутствие экспрессии р53, связанное с нонсенс мутацией, обусловливает более неблагоприятное течение заболевания по сравнению со случаями с миссенс-мутацией [20, 21].
Следует отметить, что мутации в гене ТР53 наблюдаются более чем в 95% высокогрессивных серозных карцином и хотя взаимосвязь между ТР53 мутацией и выживаемостью пациентов не установлена, достоверно доказано, что ТР53 мутация является начальным этапом в развитии высокоагрессивной серозной карциномы [22].
Мелкие фрагменты высокоагрессивной серозной карциномы, располагающиеся в спайках на поверхности правого яичника, при отсутствии инвазивного роста в овариальную строму, в сочетании с предположительно интактным или микроскопическим поражением левого яичника, возможно, представляют собой высокоагрессивную первичную серозную перитонеальную карциному. Аналогичные макроскопические особенности яичников описаны С. Przybycin и соавт., которые установили вовлечение яичников у 7 из 8 женщин с первичной серозной перитонеальной карциномой: у двух – одностороннее и у пяти – двустороннее, при этом лишь в одном случае на поверхности яичника визуализировались мелкие узловатые образования, в остальных случаях поверхность яичника была гладкая. При этом 50% первичных серозных перитонеальных карцином ассоциированы со STIC [23]. В литературе имеются сведения об оккультном диагностировании STIC, ассоциированном с первичной серозной перитонеальной карциномой и не пораженными яичниками. Так, S. Nasser и соавт. доложили о 51-летней пациентке, которой в связи с обнаружением в шеечных мазках признаков, подозрительных в отношении аденокарциномы, была проведена гистероскопия, лапароскопия с биопсией брюшины, двусторонняя аднексэктомия и диагностирована правосторонняя STIC. Впоследствии после радикального хирургического вмешательства была выявлена высоко агрессивная первичная серозная перитонеальная карцинома, при этом в обоих яичниках опухолевый рост отсутствовал [24].
Кроме того, J. Seidman и соавт. в своем исследовании маточных труб от 51 женщины с первичной перитонеальной карциномой, II–IV стадии по FIGO, диагностировали STIC у 19 из них, при этом у 53% STIC располагались в фимбриальном отделе, у 20% – в фимбриях и слизистой маточной трубы, у 20% – лишь в слизистой маточной трубы.
В результате этого доказано сосуществование STIC у половины пациенток с первичной серозной перитонеальной карциномой и подтверждена теория возникновения первичной серозной перитонеальной карциномы из оккультной серозной карциномы маточной трубы [25].
Заключение
Таким образом, установленные у данной пациентки STIC и высокоагрессивная первичная серозная перитонеальная карцинома, вероятно, представляют последовательные стадии единого патологического процесса, при котором STIC послужила источником развития высокоагрессивной первичной серозной перитонеальной карциномы. Подробное гистологическое исследование маточных труб у пациентки с доброкачественным гинекологическим заболеванием позволило выявить высокоагрессивный серозный рак на доклинической стадии.



