В настоящее время отсутствует консенсус относительно патогенетических механизмов эндометриоза и выбора наиболее оптимального метода терапии заболевания [1]. Предположительно, имплантация и персистенция клеток эктопического эндометрия, а также клиническая манифестация заболевания являются результатом комплексного действия аномально протекающих биологических механизмов вследствие эпигенетических и полигенетических особенностей [2, 3]. Изучение механизмов развития эндометриоза на молекулярном уровне, прогрессирования и дальнейшего распространения заболевания, причин неэффективности лечения – важная задача современного этапа. В большинстве исследований хронических заболеваний, протекающих с индивидуальными особенностями клинических проявлений и лечения, обнаруживается гетерогенность морфологического субстрата патологического процесса [4]. Именно учет клинико-морфологических параллелей в подавляющем числе наблюдений является залогом результативного ведения пациенток [5, 6]. В связи с этим определение иммуногистохимического (ИГХ) профиля эктопического эндометрия является важным элементом в понимании патогенеза эндометриоза, имеющим практическую значимость в отношении прогнозирования течения заболевания и ответа на проводимую консервативную терапию. Выбор метода противорецидивного лечения в зависимости от рецептивного представительства, степени дисбаланса запрограммированной клеточной гибели и пролиферации в капсуле эндометриоидных кист яичников (КЭКЯ), потенциально позволяет повысить эффективность проводимой терапии и улучшить прогноз относительно реализации репродуктивной функции у пациенток с эндометриозом яичников [7–9].
Цель исследования – на основе представительства молекулярных маркеров в КЭКЯ выделить ИГХ-фенотипы для обоснования дифференцированного подхода к терапии и снижения частоты рецидивов.
Материалы и методы
Исследование включало гистологическую оценку и ИГХ-анализ маркеров в ткани КЭКЯ у 50 пациенток 1-й (основной) группы с подтвержденным диагнозом ЭКЯ. В качестве контроля с 7-го по 10-й дни менструального цикла методом пайпель-биопсии взяты образцы эндометрия у 25 здоровых женщин. Эффективность дифференцированного лечения пациенток 1-й группы, с учетом ИГХ-профиля КЭКЯ, сравнивалась с результатами лечения 80 женщин с ЭКЯ 2-й группы, аналогичной основной группе по возрасту, стадии патологического процесса и проводимой гормональной терапии, назначаемой без учета ИГХ-фенотипа. Для расчета стандартов эффективности противорецидивной гормональной терапии в качестве условной группы контроля была сформирована 3-я группа (сравнения), в которую вошли 40 пациенток, сопоставимых с 1-й и 2-й группами по возрасту и стадии развития эндометриоза яичников, отказавшихся после оперативного лечения от последующей гормональной терапии.
Критерии включения в группы с эндометриозом яичников: подтвержденный гистологически диагноз впервые выявленных ЭКЯ, ранний репродуктивный период, впервые выполненное оперативное лечение эндометриоза яичников, согласие на участие в исследовании и обработку данных. Критерии исключения из исследования: прием гормональных препаратов в течение предшествующих 6 месяцев до оперативного лечения, наличие ожирения и сопутствующей выраженной экстрагенитальной патологии, выявленные при опросе пациенток нарушения выполнения назначенной схемы противорецидивного гормонального лечения.
В 1-й группе с ЭКЯ диагноз был поставлен на основании данных комплексного клинико-лабораторного исследования, включавшего: жалобы, сбор анамнеза, данные физикального и бимануального влагалищного исследования, определение опухолевых маркеров в крови (СА-125), результаты ультразвукового исследования (УЗИ) абдоминальным и влагалищным методами. Пациенткам проводили лапароскопию с диагностической и лечебной целью. Для оценки стадии поражения при ЭКЯ применяли клиническую классификацию для ЭКЯ, представленную в клинических рекомендациях [10]. Хирургический этап лечения проводили в фазу пролиферации с удалением ЭКЯ (резекция кист), адгезиолизисом и коагуляцией очагов эндометриоза на брюшине. После подтверждения диагноза эндометриоидного поражения яичников по данным гистологического исследования, фрагменты КЭКЯ подготавливались для проведения ИГХ-анализа. Оценивали следующие молекулярные маркеры – экспрессию эстрогеновых рецепторов (РЭ), использовали тест-систему и реактивы фирмы Biocare, Германия (клон SP1, IgG изотип); рецепторов прогестерона (РП) (клон PGR 16, IgG1 изотип); определяли экспрессию показателя клеточной пролиферации Ki-67 (клон MM1, IgG1 изотип) и клеточного апоптоза p53 (клон 100/D5, IgG1 изотип). Определение презентации исследуемых параметров в клетках ткани эндометрия и КЭКЯ проводили по ИГХ-методике с использованием моно- и поликлональных антител. При микроскопии регистрировали клетки, осуществляющие экспрессию исследуемых маркеров. Применяли методику подсчета согласно рекомендациям ВОЗ [11]: подсчет количества окрашенных ядер клеток желез или стромы биоптата, рассчитывали процентное соотношение окрашенных и неокрашенных ядер клеток на 100 учтенных клеток в 10 репрезентативных полях зрения при 40-кратном увеличении, указывали средний процент клеток, в которых определяли экспрессию антител к исследуемым показателям. Определение уровней гормонов и онкомаркера СА-125 проводили на тест-системе Architect i2000 (Abbott, США) c использованием реактивов фирмы Abbott (Ирландия) методом хемилюминесцентного иммуноанализа на микрочастицах.
Статистическую обработку осуществляли при помощи программы IBM SPSS Statistics 25 PS IMAGO 5.0, лицензия № 5725-А54. При близком к нормальному распределению проводили вычисление средней арифметической величины (М), среднеквадратического отклонения (SD); при отклонении от нормального закона распределения проводили вычисление медианы (Ме) с межквартильным интервалом [25 квартиль (Q1)–75 квартиль (Q3)]. Статистические различия рассчитывали с применением рангового дисперсионного анализа Краскела–Уоллиса с последующими межгрупповыми сравнениями по критерию U-Манна–Уитни с поправкой Бонферрони. Для исследования взаимосвязей применяли корреляционный анализ Спирмена. Для сравнения частот применяли критерий χ² Пирсона, при размерности таблицы сопряженности 2 на 2 – χ² Пирсона с поправкой Йейтса. Критическое значение уровня значимости принимали равным 0,05. Обоснование размера выборки проводили по номограмме Альтмана, с учетом данных предварительного исследования. При заданных параметрах для обеспечения мощности исследования в 80%, cчитая клинически значимым снижение частоты рецидивов на 35%, достаточная численность групп будет от 36 наблюдений. Оценку эффективности дифференцированного персонифицированного лечения проводили с помощью показателей размера эффекта терапевтического вмешательства: ЧИЛ – частота исходов лечения с учетом ИГХ-профиля или без ИГХ-обследования; ЧИК – частота исходов лечения в 3-й группе сравнения; ОР – относительный риск; СОР – снижение относительного риска; САР – снижение абсолютного риска; ЧБНЛ – число больных, которым необходимо проводить лечение, чтобы предотвратить неблагоприятный исход у одного пациента. Рассчитывали 95% доверительный интервал (95% ДИ) [12].
Результаты и обсуждение
Клинико-демографическая характеристика прооперированных женщин с ЭКЯ групп сравнения представлена в табл. 1.
Согласно полученным результатам сравнения, женщины 1-й, 2-й, 3-й групп по возрасту, социальному статусу, индексу массы тела (ИМТ), клинико-лабораторным и интраоперационным данным, стадии эндометриоза яичников статистически значимо не различались, что позволило считать группы сравнения сопоставимыми. Женщины контрольной группы были сопоставимы с группами пациенток с эндометриозом по возрасту (30,3 (3,7) лет, χ²=1,01, p=0,59), ИМТ (24,6 (1,8) кг/м2, χ²=0,13, p=0,93). Уровни ФСГ на начало цикла (8,7 (1,4) мМЕд/мл), эстрадиола (326,4 (15,8) пмоль/л), антимюллерова гормона в цикле проведения биопсии (2,38 (0,26) нг/мл), прогестерона (42 (5,4) нмоль/л), СА-125 (18 (4,3) МЕ/мл) в контрольной группе соответствовали референсным значениям.
В ходе исследования отмечалась средней силы и сильная корреляция данных ультразвуковой картины с интраоперационными данными: размерами ЭКЯ (r 0,69–0,78, p<0,05), распространенностью процесса (одно/двусторонней локализацией – r 0,81–0,92, p<0,05). После оперативного вмешательства у женщин 1-й группы диагностированы II и III стадии ЭКЯ. Женщины с IV стадией ЭКЯ в исследовании отсутствовали. У пациенток с диагностированной II стадией ЭКЯ поражение яичников в единичных наблюдениях (4/35 – 11,4%) сопровождалось наличием видимых очагов эндометриоза на брюшине. У всех пациенток с III стадией заболевания наибольший диаметр овариальных кист варьировал от 6 до 9 см и сопровождался единичными очагами эндометриоза на брюшине.
Показатели ИГХ-анализа КЭКЯ у женщин 1-й (основной) группы со II и III стадиями процесса и ткани эндометрия у здоровых женщин представлены в табл. 2.
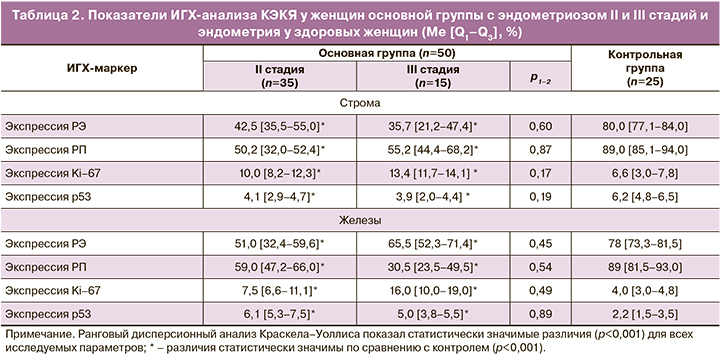
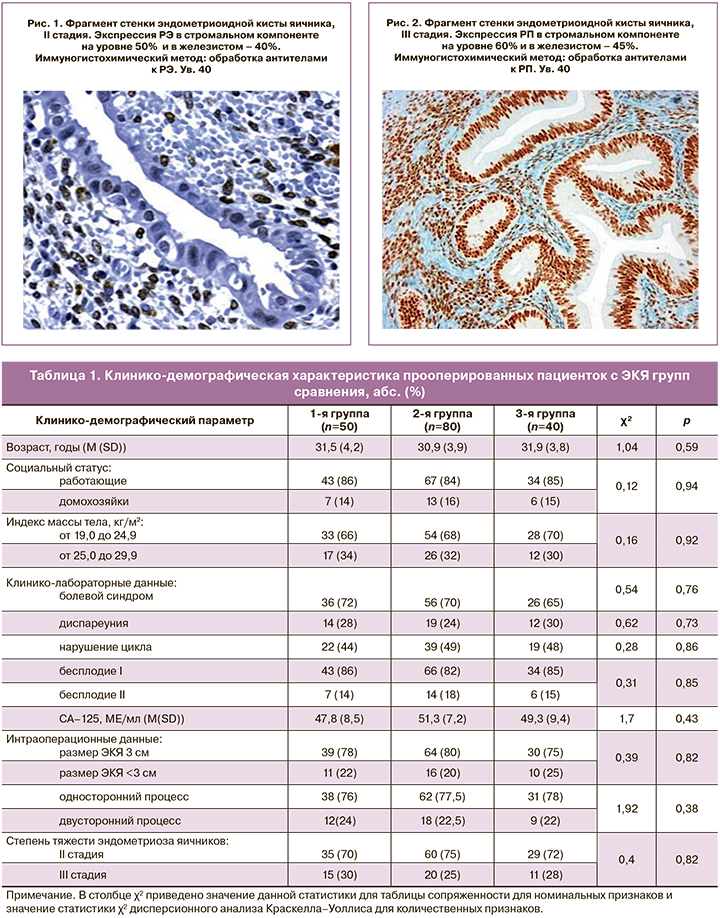
ИГХ-профиль полученных в ходе оперативного вмешательства препаратов сильно варьировал по соотношению анализируемых маркеров (рис. 1, 2).
Согласно полученным данным, в ткани КЭКЯ уровни экспрессии РЭ и РП существенно отличаются от показателей рецептивности в эутопическом эндометрии. Измененная экспрессия РЭ приводит к связыванию предшественников синтеза РП. Описан стероидогенез в очагах эндометриоза с синтезом биологически активных эстрогенов и прогестерона. Количество синтезируемого эстрогена играет существенную роль в распространении и диссеминации эндометриоидных очагов. Клеточная диссеминация и воспаление в очагах являются патологическими субстратами возникновения таких клинических проявлений, как хроническая тазовая боль и бесплодие [13]. Наличие РЭ в ткани КЭКЯ отражает чувствительность этой ткани к эстрогенам. В данном исследовании экспрессия РЭ в биоптатах КЭКЯ составила от 21,2 до 71,4% с более выраженной экспрессией в железистом компоненте. Наличие этих рецепторов в обоих компонентах КЭКЯ свидетельствует о чувствительности эндометриоидной ткани к эстрогеновой стимуляции. В целом экспрессия РЭ и РП в ткани КЭКЯ была ниже их представительства в группе контроля. Сниженная чувствительность к прогестерону в ряде клинических наблюдений объясняется снижением экспрессии РП как в стромальном, так и в железистом компонентах КЭКЯ.
Дисбаланс синтеза белков апоптоза и пролиферации может приводить к ряду патологических процессов, в том числе к распространению и появлению новых очагов, а также к отсутствию должного эффекта от клеточной стимуляции апоптоза [14]. Ki-67 – ядерный белок, тесно связанный с клеточной пролиферацией и рибосомальной транскрипцией РНК. Экспрессия этого маркера, по результатам нашего исследования, увеличивалась с прогрессированием стадии развития эндометриоза. Так, в 3 наблюдениях при увеличении экспрессии Ki-67 в 3-4 раза, по сравнению со значениями контрольной группы, отмечалась III стадия заболевания с ярко выраженным постоянным болевым синдромом, вероятно, обусловленным инфильтративным ростом эндометриоидных очагов на брюшине малого таза. Вариабельность экспрессии маркеров клеточного апоптоза (р53) и клеточной пролиферации (Ki-67) при различном соотношении РЭ и РП подтверждает факт, что эндометриоидные гетеротопии имеют разную способность к диссеминации при различном ответе на проводимую терапию [3]. Сниженная экспрессия РЭ и РП в КЭКЯ является морфологическим субстратом отсутствия чувствительности и сохранения клинической симптоматики, несмотря на проводимую гормональную терапию.
Учитывая, что эндометриоз является эстрогензависимым заболеванием женщин репродуктивного возраста с выраженной воспалительной реакцией как местно, в очагах, так и на системном уровне, клинические проявления патологии проявляются в ходе негативного влияния овуляторных циклов на поддержание и развитие эндометриоидных гетеротопий. Блокирование овуляции с использованием агонистов гонадотропин-рилизинг-гормона (аГнРГ), прогестагенов снижает выраженность хронических тазовых болей, ассоциированных с эндометриозом. Однако эффективность гормональной терапии при эндометриозе яичников до настоящего времени остается проблемой [9, 10, 15].
Интраоперационное стадирование процесса, исходя из локализации и размеров очагов, не позволяет в полной мере оценить активность процесса и потенциальную способность к рецидивированию заболевания. С точки зрения выбора схемы послеоперационной медикаментозной коррекции, с целью предотвращения рецидивирования процесса, нами считается возможным опираться не только на клиническую и патоморфологическую картину заболевания, включающую жалобы пациентки, данные анамнеза и УЗИ, интраоперационные находки, но и учитывать особенности ИГХ-профиля КЭКЯ (табл. 3).
К 1-му ИГХ-фенотипу отнесены пациентки, у которых сохранялся баланс рецепторного статуса половых стероидных гормонов, процессов пролиферации и запрограммированной клеточной гибели. Во всех наблюдениях у женщин с 1-м ИГХ-фенотипом диагностировалась II стадия течения эндометриоза. Ко 2-му и 3-му ИГХ-фенотипам отнесены пациентки как со II, так и с III стадиями эндометриоза яичников, что можно объяснить снижением экспрессии РЭ (больше выраженным при 3-м типе) с сохраненной (2-й тип) или умеренно сниженной (3-й тип) экспрессией РП, дисбалансом маркеров клеточной пролиферации (Ki-67) и апоптоза (p53). При 4-м ИГХ-фенотипе, характерном только для пациенток с III стадией эндометриоза яичников, выявлены разнонаправленные уровни экспрессии рецепторов половых стероидов с резким снижением уровня экспрессии РП и высоким уровнем РЭ при значительном дисбалансе факторов пролиферации и апоптоза в пользу усиления экспрессии Ki-67 с минимальной экспрессией p53.
Исходя из соотношения ИГХ-маркеров, характерных для 1-го ИГХ-фенотипа, риск рецидивирования заболевания расценен как низкий. Планирование беременности возможно в ближайшем послеоперационном периоде. С целью контрацепции рекомендованы препараты, не содержащие эстрогеновый компонент, а только прогестагены (например, препараты дезогестрела в циклическом режиме).
Для пациенток со 2-м ИГХ-фенотипом, где сохранялась умеренная экспрессия РП при высокой пролиферативной способности клеток КЭКЯ, препаратом выбора для противорецидивной терапии стал диеногест (2 мг) в непрерывном режиме длительностью от 6 до 18 месяцев у женщин, не планировавших беременность. Пациенткам, планировавшим беременность, диеногест назначался только на 6 месяцев для коррекции выявленного дисбаланса экспрессии половых стероидов и снижения пролиферативной активности очагов [16]. Пациенткам, не желавшим получать противорецидивную терапию в непрерывном режиме, назначался дидрогестерон в циклическом режиме в дозе 30 мг с 5-го дня по 25-й день цикла.
У пациенток с 3-м ИГХ-фенотипом, где сохранялась умеренная экспрессия РЭ при статистически значимом снижении РП и высоком риске рецидивов на фоне выраженного дисбаланса процессов пролиферации и запрограммированной клеточной гибели, нами рассмотрены два варианта противорецидивной гормональной терапии: диеногест в непрерывном режиме до 18 месяцев либо аГнРГ на 6–12 месяцев применения. У пациенток, не планирующих беременность, в дальнейшем возможно применение пероральных прогестагенов (дезогестрел) в циклическом режиме. В отсутствие репродуктивных планов при приеме диеногеста дополнительно рекомендовалась барьерная контрацепция.
При 4-м ИГХ-фенотипе, с высоким уровнем РЭ и минимально низкой экспрессией РП на фоне максимальной пролиферативной активности и низкой экспрессии маркера апоптоза, в качестве противорецидивной терапии патогенетически обосновано назначение аГнРГ. При выраженных симптомах дефицита эстрогенов в схему терапии после 6 месяцев применения аГнРГ добавлялась «возвратная» терапия с применением комбинации эстрадиола и дидрогестерона 1/5 в стандартных схемах применения. Пациенткам, планирующим беременность, противорецидивная терапия проводилась до 6 месяцев.
Соответственно, в 1-й и 2-й группах применяли следующие виды терапии: диеногест 2 мг перорально ежедневно непрерывно до 6–18 месяцев – 72% (n=36) и 70% (n=56); дидрогестерон в дозе 30 мг/сутки в циклическом режиме с 5-го дня по 25-й день цикла – 6% (n=3) и 5% (n=4); бусерелин 3,75 мг внутримышечно однократно в 28 дней в течение 6–12 месяцев – 12% (n=6) и 12,5% (n=10); бусерелин 3,75 внутримышечно однократно в 28 дней в сочетании с комбинацией эстрадиола и дидрогестерона 1/5 продолжительностью до 6 месяцев – 8% (n=4) и 7,5% (n=6); дезогестрел 75 мкг/сутки ежедневно непрерывно до 6–12 месяцев 26% (n=13) и 24% (n=19); отсутствовала терапия после оперативного лечения в 10% (n=5) и 12,5% (n=10) наблюдений. Межгрупповой анализ показал отсутствие статистически значимой разницы по методам гормонального лечения (χ²=0,21, p=0,90). Частота наступления беременности в течение 18 месяцев наблюдения составила 24% (12/50), 10% (8/80) и 5% (2/40) соответственно 1-й, 2-й и 3-й группам сравнения (χ²1-2=4,63; p1-2=0,03; χ² 1-3=4,75; p1-3=0,03; χ² 2-3=0,34; p2-3=0,56).
Расчет показателей размера эффекта лечебного вмешательства в 1-й и 2-й группах проводился с учетом диагностики рецидива эндометриоза за 18 месяцев после проведенного оперативного вмешательства по данным клинических проявлений и ультразвукового обследования. В целом количество женщин с рецидивами ЭКЯ и без рецидивов составило соответственно: в 1-й группе 4% (2/50) и 96% (48/50), во 2-й группе 26,2% (21/80) и 73,7% (59/80), в 3-й группе 62,5% (25/40) и 37,5% (15/40).
Дифференцированный подход к гормональному лечению с учетом варианта ИГХ-профиля КЭКЯ показал более высокую эффективность по сравнению с противорецидивным лечением без учета ИГХ-профиля (табл. 4).
Ключевые показатели эффекта лечебного вмешательства в 1-й (основной) группе и 2-й группе сравнения соответственно составили: ЧБНЛ 2 [95% ДИ 1–2, при p<0,001] против ЧБНЛ 3 [95% ДИ 2–6, при p<0,001], ОР 0,06 [95% ДИ 0,02–0,25, при p<0,001] против ОР 0,42 [95% ДИ 0,27–0,65, при p<0,001]. Следовательно, эффект от персонифицированных лечебных мероприятий в 1-й группе по сравнению со 2-й группой по показателю ЧБНЛ выше в 1,5 раза, по показателю ОР – в 7 раз.
Заключение
Разная степень выраженности клинических проявлений, трудности лечения и неопределенность прогноза при эндометриозе, несомненно, связаны с неоднородностью тканевой, клеточной, молекулярной структуры очагов эндометриоидных гетеротопий в разные периоды развития заболевания, что требует консенсуса во взглядах на патогенетические механизмы и выбор метода терапии. Структурно-функциональная гетерогенность ЭКЯ диктует необходимость целенаправленной лабораторной диагностики. Многочисленные гормональные методы терапии эндометриоза яичников, направленные на снижение рецидива заболевания после хирургического лечения, обладают недостаточной эффективностью при отсутствии персонифицированного подхода c применением углубленного патогенетически обоснованного обследования. ИГХ-анализ КЭКЯ позволяет оценить риск прогрессирования заболевания и обосновать выбор схемы консервативной терапии.
Несмотря на широкий спектр гормональных средств, не существует универсальной схемы лечения эндометриоза. Многие вопросы врачебной тактики после оперативного лечения ЭКЯ остаются дискуссионными в связи с высоким риском рецидива. Комплексный подход к терапии, включающий хирургический и консервативный этапы, является предпочтительным для пациенток, так как достигается более стойкий контроль над клиническими проявлениями заболевания. Полученные в ходе исследования данные свидетельствуют о том, что выбор консервативной схемы противорецидивного лечения возможен с применением индивидуального подхода, учитывающего ИГХ-фенотип КЭКЯ.
Объективизация результатов лечения при проведении персонифицированной патогенетически обоснованной терапии с учетом ИГХ фенотипа (путем оценки частоты рецидивов ЭКЯ – 4% против 26,2% и расчета показателей размера эффекта лечебного вмешательства) подтверждает более высокую – в 6,5 раза результативность дифференцированного подхода к лечению.



