В настоящее время большое внимание исследователей сосредоточено на изучении процессов окислительного стресса в организме беременных женщин [1, 2]. Свободно-радикальное окисление необходимо для нормального функционирования организма: запуска процессов апоптоза, транспорта электронов в дыхательной цепи, синтеза простагландинов, тромбоксанов, лейкотриенов из арахидоновой кислоты и др. Однако нарушение баланса между активными формами кислорода (АФК) и азота (АФА) и антиоксидантной системой могут приводить к структурному повреждению клеток и тканей организма, индуцируя различные патологические процессы.
Во время беременности, как при нормальном ее течении, так и при патологии, происходит увеличение уровня активности окислительного стресса. АФК и АФА вызывают повреждение нутриентов (протеинов, жирных кислот), образуя высокотоксичные вторичные радикалы, тем самым запуская каскад свободнорадикальных реакций [1]. Образующиеся в результате этих реакций липидные радикалы являются нестабильными, что затрудняет их количественное определение в биологических жидкостях. Поэтому для оценки перекисного окисления липидов (ПОЛ) чаще всего используют определение конечных продуктов перекисного окисления – малонового диальдегида (МДА) и 4-гидроксиноненаля (4-ГН). В результате взаимодействия оксида азота и радикала супероксид аниона образуется пероксинитрит (ONOO-), являющийся одним из сильных окислителей, способным вызывать повреждения широкого спектра клеточных молекул, от липидов клеточной мембраны и белков до ДНК клетки [3]. Не менее значимой является способность ONOO- модифицировать SH-группы в белках и низкомолекулярных тиолах, например, таких как глутатион. Аддукты тиольных групп и пероксинитрита, представляющие собой нитрозильные производные (НП), хорошо выявляются при анализе и служат более объективными показателями окислительного повреждения белков, чем сам ONOO- вследствие нестабильности последнего [4].
Токсическое действие АФК и АФА в организме предотвращается за счет действия системы антиоксидантной защиты. К ней относятся ферментные и неферментные антиоксиданты. Ферментные антиоксиданты включают в себя: каталазу, глутатионпероксидазу, супероксиддисмутазу (СОД). Каталаза является гемопротеином, участвующим в реакции разложения пероксида водорода, образующегося в результате реакции дисмутации супероксидного радикала. СОД – протеин, содержащий в своем составе Zn2+ и Cu2. Глутатионпероксидаза – гомотетрамерный селенопротеин, участвующий в реакции инактивации пероксида водорода и пероксидных радикалов при участии глутатиона. Глутатионредуктаза – еще один фермент, представляющий собой флавопротеин, восстанавливающий окисленный глутатион за счет НАДФ-Н.
К неферментным антиоксидантам относятся: витамин С, витамин Е, витамин А, карнитин, таурин, цистеин, глутатион, белки, содержащие селен, коэнзим Q и др.
Целью настоящего исследования было определение уровня продуктов АФК, АФА и антиоксидантных ферментов в периферической крови беременных женщин в разных триместрах при преждевременных родах (ПР), преэклампсии (ПЭ), синдроме задержке роста плода (СЗРП) и физиологически протекающей беременности (ФБ).
Материал и методы исследования
Проанализировано течение беременности и исходы родов у 131 женщины, вставших на учет в женскую консультацию 1-м триместре. В ходе исследования в зависимости от полученных данных, анализа характера течения беременности и исходов родов сформировано 4 группы: 1-я – женщины с ФБ; 2-я – женщины с ПР; 3-я – женщины с беременностью, осложненной ПЭ; 4-я – женщины с беременностью, осложненной СЗРП.
Общие критерии включения в исследование: постановка на учет по беременности и обследование в 1-м триместре; одноплодная беременность, наступившая самопроизвольно или в результате вспомогательных репродуктивных технологий; родоразрешение через естественные родовые пути или путем операции кесарева сечения; информированное согласие пациентки на вступление в исследование.
В первую группу вошли 105 женщин. Критерии включения в группу с ФБ: отсутствие осложнений беременности (ПР, СЗРП, ПЭ и др.); родоразрешение в сроке от 37 до 40 недель гестации.
Во вторую группу вошли 11 женщин. Критерии включения в группу с ПР: родоразрешение в сроке от 22 до 37 недель гестации. У всех женщин, взятых в группу, роды произошли в сроке от 33 до 37 недель гестации.
В третью группу вошли 11 женщин. Критерии включения в группу с ПЭ: беременность, осложненная ПЭ согласно критериям ВОЗ (развитие ПЭ на сроке гестации >20 недель; повышение диастолического артериального давление >110 как один из эпизодов, или повышение диастолического давления >90, зарегистрированное два или большее число раз с перерывом не менее 4 ч между измерениями; протеинурия >300 мг за 24 часа, или установленная в результате анализа двух чистых проб средней порции мочи или собранной через катетер с перерывом не менее 4 часов при следующих параметрах: 1 г/л, или >2 + по индикаторной полоске, или 0,3 г/л или >1 + по индикаторной полоске, если pH<8 или если ее удельный вес <1030).
Четвертую группу составили 11 женщин. Критерии включения в группу с СЗРП: отставание размеров плода от гестационного срока, масса плода при рождении ниже десятого процентиля для данного срока гестации.
Критерии исключения из исследования: отсутствие согласия на вступление в исследование; женщины, вставшие на учет по беременности во 2-м или 3-м триместре, и соответственно не обследованные в 1-м триместре; многоплодная беременность; самопроизвольный выкидыш или неразвивающаяся беременность; наличие ВИЧ инфекции; беременность, закончившаяся антенатальной гибелью плода.
Проведена количественная оценка уровня активности окислительного стресса с помощью определения продуктов ПОЛ: МДА и 4-ГН, и перекисного окисления оксида азота (NO)- аддуктов ONOO- с цистеинами белков (НП) в 1-м, 2-м и 3-м триместрах беременности при физиологически протекающей беременности и при патологии (ПР, ПЭ, СЗРП). Для оценки антиоксидантной системы проведено определения уровня активности ферментов каталазы, глутатионпероксидазы, СОД при ФБ и патологической беременности.
Для анализа результатов исследования использовались статистические компьютерные программы SPSS Statistic (версия 22) и Microsoft Excel 2010. Анализ уровня МДА и НП в разных триместрах беременности проведен с использованием t-теста для связанных выборок. Для сравнительной оценки уровня продуктов ПОЛ (МДА, 4-ГН), аддуктов ONOO- (НП) и антиоксидантных ферментов (каталазы, глутатионпероксидазы, СОД) в разных группах использовались методы: однофакторный дисперсионный анализ, t-теста для сравнения средних, критерий U Манна–Уитни для независимых выборок. Различия между группами считались достоверными при p<0,05.

Результаты и обсуждение
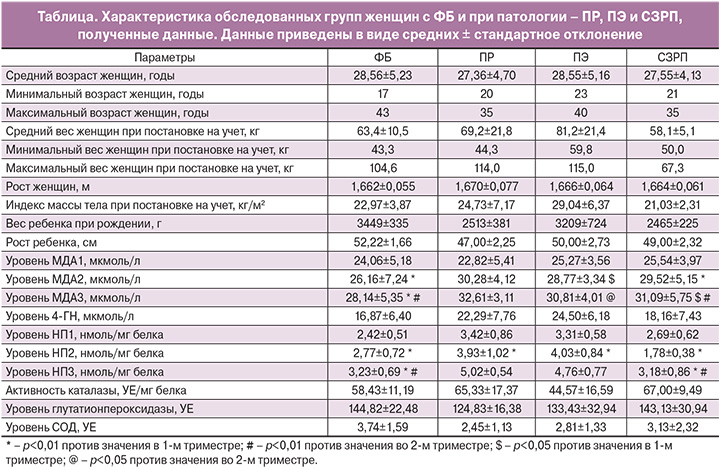
Возраст беременных варьировал от 17 до 43 лет (средний возраст 28,37±5,00 года). Средний возраст женщин группы ФБ составил 28,56±5,22 года, группы ПР – 27,36±4,70 года, группы ПЭ – 28,55±5,16 года, группы СЗРП – 27,55±4,13 года.
Вес пациенток в 1-й группе с ФБ был от 43,3 до 104,6 кг (средний вес 63,4±10,5 кг), во 2-й группе с ПР – от 44,3 до 114,0 кг (средний вес 69,2±2,8 кг), в 3-й группе с ПЭ – от 59,8 до 115,0 кг (средний вес 81,2±21,4 кг), в 4-й группе с СЗРП – от 50,0 до 67,3 кг (58,1±5,1 кг). Данные приведены в таблице.
При ФБ среднее значение МДА в первом триместре (МДА1) составило 24,06±5,18 мкмоль/л, во втором триместре (МДА2) – 26,16±7,24 мкмоль/л, в третьем триместре (МДА3) – 28,14±5,35 мкмоль/л. Значения МДА во втором и третьем триместре достоверно выше, чем в первом триместре (p<0,01; p<0,01 соответственно). При этом уровень МДА в третьем триместре был также достоверно выше, чем во втором (p<0,01). Таким образом, можно заключить, что концентрация МДА в сыворотке крови увеличивается при прогрессировании беременности.
Средний уровень аддуктов ONOO-, а именно НП, в первом триместре (НП1) составил 2,42±0,51 нмоль/мг белка, во втором триместре (НП2) – 2,77±0,72 нмоль/мг белка, в третьем триместре (НП3) – 3,23±0,69 нмоль/мг белка. Отмечено достоверное увеличение уровня НП в третьем и втором триместрах по сравнению с первым триместром (p<0,01; p<0,01 соответственно), а также увеличение содержания НП в третьем триместре по сравнению со вторым (р<0,01). Таким образом, уровень аддуктов ONOO- (НП), также как и МДА, увеличивается с увеличением срока гестации (рис. 1). Наши данные схожи с зарубежными исследованиями [5].
Во 2-й группе беременных с ПР среднее значение уровня МДА в первом триместре равно 22,82±5,41 мкмоль/л, во втором триместре – 30,28±4,12 мкмоль/л, в третьем триместре – 32,61±3,11 мкмоль/л. При этом, несмотря на увеличение средней концентрации МДА с увеличением срока гестации, различия в его содержании в разных триместрах были статистически недостоверны (р>0,05), что, вероятно, может быть связано с малым количеством женщин, вошедших в данную группу, и возможно при увеличении числа пациенток различия могут стать достоверными.
Средний уровень НП в первом триместре составил 3,42±0,86 нмоль/мг белка, во втором триместре – 3,93±1,02 нмоль/мг белка, в третьем триместре – 5,02±0,54 нмоль/мг белка. Отмечается достоверное увеличение уровня НП во втором триместре по сравнению с первым триместром (р<0,01). При этом содержание НП в крови пациенток в третьем триместре беременности значимо не отличалось от первого и второго триместров (p>0,05).

В 3-й группе беременных с ПЭ среднее значение уровня МДА в первом триместре равно 25,27±3,56 мкмоль/л, МДА во втором триместре – 28,77±3,34 мкмоль/л, МДА в третьем триместре – 30,81±4,01 мкмоль/л. Отмечается достоверное увеличение МДА во втором триместре по сравнению с первым (р<0,05) и в третьем по сравнению со вторым (р<0,05). Выявлена тенденция к увеличению уровня МДА в третьем триместре по сравнению с уровнем МДА в первом триместре (р=0,052). Следовательно, отмечается увеличение уровня МДА при прогрессировании беременности.
Средний уровень НП в первом триместре составил 3,31±0,58 нмоль/мг белка, во втором триместре – 4,03±0,84 нмоль/мг белка, в третьем триместре – 4,76±0,77 нмоль/мг белка. Отмечается достоверное увеличение уровня НП во втором триместре по сравнению с первым (р<0,01). Выявлена тенденция к увеличению НП в третьем триместре по сравнению с первым (р=0,51). Не выявлено достоверного различия уровня НП между вторым и третьим триместром.
В 4-й группе с беременных СЗРП среднее значение МДА в первом триместре составило 25,54±3,97 мкмоль/л, МДА во втором триместре – 29,52±5,75 мкмоль/л, МДА в третьем триместре – 31,09±5,75 мкмоль/л. Отмечается достоверное увеличение уровня МДА во втором и третьем триместре по сравнению с первым (р<0,01; p<0,05 соответственно), а также увеличение концентрации МДА в третьем триместре по сравнению со вторым (р<0,01). Таким образом, у женщин с беременностью, осложненной СЗРП, выявлено достоверное увеличение уровня МДА при прогрессировании беременности.
Средний уровень аддукторов ONOO-, а именно НП в первом триместре равен 2,69±0,62 нмоль/мг белка, во втором триместре –1,78±0,38 нмоль/мг белка, в третьем триместре –3,18±0,86 нмоль/мг белка. Отмечается достоверное уменьшение уровня НП во втором триместре по сравнению с первым (р<0,01), однако в третьем триместре уровень НП увеличивается по сравнению с первым (р<0,01) и вторым (р<0,01) триместрами. Таким образом, с увеличением срока гестации в группе с СЗРП отмечается достоверное увеличение уровня МДА, и хотя уровень НП во втором триместре снижается по сравнению с первым, в третьем триместре он резко возрастает, что может свидетельствовать об усилении окислительного стресса по мере приближения к родам.
Методом однофакторного дисперсионного анализа проводилось сравнение средних значений содержания продуктов ПОЛ (МДА1, МДА2, МДА3, 4-ГН), АФА (НП1, НП2, НП3), уровня активности антиоксидантных ферментов (каталазы, глутатионпероксидазы, СОД). При сравнении групп с ФБ и ПР (1-я и 2-я группы соответственно) выявлено достоверное повышение уровня НП в белках во всех трех триместрах (р<0,01) и 4-ГН (р<0,05), на фоне снижения уровня глутатионпероксидазы (р<0,05) в группе с ПР (рис. 2). Сравнение групп ФБ и ПЭ (1-я и 3-я группы соответственно) выявило похожую тенденцию – достоверное увеличение уровня НП в первом, втором, третьем триместрах (р<0,01) и уровня 4-ГН (р<0,05), но на фоне снижения уровня активности каталазы (р<0,05) в группе беременных с ПЭ (рис. 2, 3). Тем же методом однофакторного дисперсионного анализа получены данные между группами с ФБ и СЗРП (1-я и 4-я группы соответственно), отмечено достоверное увеличение уровня активности каталазы (р<0,05) у беременных с СЗРП (рис. 3). Достоверных различий по другим показателям между этими двумя группами не наблюдалось. Также стоит отметить, что не выявлено достоверных различий уровня МДА и СОД в группах с патологией по сравнению с группой с ФБ.
Заключение
Проведенные исследования подтвердили полученные ранее зарубежные данные об увеличении уровня окислительного стресса при прогрессировании беременности при ФБ.
Сравнение групп с ФБ и групп с осложненной беременностью выявило ряд существенных отличий. У женщин, беременность которых закончилась ПР, и у женщин с беременностью, осложненной ПЭ, наблюдалось повышение содержания в крови продуктов окислительного стресса на фоне ослабления антиоксидантных систем, проявляющихся в снижении содержания и уровня активности ключевых защитных ферментов – глутатионпероксидазы и каталазы соответственно.
Во время беременности интенсивность работы митохондриального аппарата повышается, так как к функции обеспечения энергией организма матери добавляется функция трансплацентарного переноса от матери к развивающемуся плоду питательных веществ и продуктов метаболизма обратно. Одновременно с повышением продукции энергии митохондриями повышается продукция АФК и АФА, которые необходимы в небольших концентрациях для поддержания нормальной жизнедеятельности и реализации клеточного сигналинга, а при повышении концентрации вызывают окислительный стресс и оказывают повреждающее действие на клетки организма, как следствие, нарушая работу целых систем.
Система продукции и утилизации АФК и АФА является тонко регулируемой, однако при значительном повышении уровня активных радикалов, которое происходит во время беременности, антиоксидантная система организма не успевает перестраиваться, а возникающий дисбаланс приводит к накоплению продуктов окислительного стресса в организме матери. Такие изменения, по нашему мнению, являются нормальными и присутствуют при физиологически протекающей, неосложненной беременности. Однако нами показано, что у женщин, беременность которых была осложнена ПЭ, а также у женщин, беременность которых закончилась ПР, ожидаемое постепенное повышение содержания продуктов окислительного стресса в крови наблюдается в сочетании со снижением уровня и, возможно, активности антиоксидантных ферментов.
В то же время у женщин, беременность которых была осложнена СЗРП, напротив, наблюдалось повышение уровня активности антиоксидантного фермента каталазы, на фоне снижения уровня НП во втором триместре, хотя и его резким повышением в третьем триместре, что может свидетельствовать об увеличении окислительного стресса к родам. Можно предположить, что в данном случае наблюдавшаяся патология являлась следствием транзиторного окислительного стресса, произошедшего на критическом для развития плода этапе. В дальнейшем в ответ на повышение уровня АФК и АФА и продуктов окислительного стресса активировалась антиоксидантная система, что привело к кажущейся нормализации уровня АФК и АФА, однако, не исправило последствий действия окислительного стресса на плод.
Полученные данные свидетельствуют о необходимости продолжить изучение окислительного стресса и активности антиоксидантных ферментов, как у женщин с ФБ для создания общего представления о норме реакции, так и при патологии. Исследования в данном направлении позволят разработать ранний прогностический подход для количественного анализа параметров окислительных маркеров с целью ранней предикции развития патологии и выбора адекватного объема профилактики и лечения подобных осложнений.



