На сегодняшний день установлено, что такое распространенное осложнение беременности, как преэклампсия (ПЭ), наблюдающееся у 5–7% беременных во всем мире [1], оказывает неблагоприятные долгосрочные эффекты на здоровье матери, а также увеличивает риск заболеваний ребенка во взрослом возрасте. Несмотря на то что на сегодняшний день изучены многочисленные патофизиологические механизмы, по отдельности или в сочетании, нет точного способа ее прогнозирования. Вместе с тем раннее выявление беременных высокого риска развития ПЭ является приоритетным направлением для разработки комплекса профилактических мер.
Метаболомика, представляющая собой относительно новую область исследований, основанную на систематическом изучении полного набора метаболитов (метаболома) в биологических образцах [2], направлена на обнаружение, идентификацию и количественную оценку сотен или даже тысяч низкомолекулярных метаболитов, промежуточных или конечных продуктов метаболизма в клетках, тканях или биологических жидкостях. Биологические образцы обладают уникальными и характерными биохимическими составами, которые изменяются в ответ на физиологические или патофизиологические раздражители, образуя уникальный метаболический «отпечаток пальца». Таким образом, метаболомика дает картину реакций живых систем на болезни [3], токсикологические [4] или пищевые [5] стимулы, тем самым облегчая понимание механизмов протекания биологических и биохимических процессов в сложных системах. Метаболомный подход включает комбинированное использование спектрометрических, спектроскопических методов и компьютерных программ. Анализ и интерпретация данных предполагают многовариантные методы создания классификационных моделей для проверки прогностической способности определенных биомаркеров [6].
Несколько проведенных исследований метаболомного профилирования свидетельствуют о большом потенциале этого подхода для понимания ПЭ и разработки пренатальной идентификации биомаркеров [7–10]. К сожалению, на сегодняшний день отсутствуют адекватные способы прогнозирования данного осложнения беременности, поэтому очевидна необходимость разработки неинвазивных и объективных методов пренатальной диагностики и мониторинга.
Целью исследования являлся поиск маркеров прогнозирования развития ПЭ, основанный на метаболомном анализе методами масс-спектрометрии и биоинформатики.
Материалы и методы
Для решения поставленной цели было проведено проспективное исследование «случай–контроль». Объект исследования: 1-я группа (основная) – 13 беременных женщин с ПЭ, диагностированной на основе клинического обследования и результатов функциональных методов исследования, 2-я группа (сравнения) – 21 беременная женщина без ПЭ по данным клинического обследования, результатам функциональных методов исследования и данным, полученным после рождения ребенка. Группы были сопоставимы по исходной клинической характеристике. Отбор пациенток проводился по обращаемости. Диагностика ПЭ основывалась на Международной статистической классификации болезней (МКБ) и соответствовала критериям, разработанным Европейским обществом по изучению артериальной гипертензии (АГ) – существовавшая ранее АГ; гестационная АГ; ПЭ; существовавшая ранее АГ с гестационной гипертензией и протеинурией; не поддающаяся классификации АГ. ПЭ – гипертензия (давление ≥140/90 мм рт.ст.) и протеинурия (содержание белка выше 0,3 г в суточной моче). Степень тяжести ПЭ оценивали на основании объективных показателей и клинического состояния пациентки.
Все пациентки подписали информированное согласие на участие в исследовании. Проведение исследования было одобрено комитетом по этике медицинских исследований НМИЦ «АГП им. В.И. Кулакова» Минздрава России.
Критерии включения беременных в группы исследования: срок беременности 22–40 недель; возраст беременных от 18 до 45 лет; одноплодная беременность; информированное согласие на участие в исследовании.
Критерии исключения: тяжелая экстрагенитальная патология; многоплодная беременность; использование донорской яйцеклетки; пороки развития плода; генетические заболевания матери; острые инфекционные заболевания матери; миома матки (ММ) больших размеров.
В работе были использованы стандартный набор и масс-спектрометрический протокол компании JASEM (Турция) для пробоподготовки образцов плазмы и последующего анализа 44 аминокислот (в том числе алло-изолейцина, который не вошел в данное исследование). Набор содержит две различные калибровочные смеси лиофилизированных аминокислот, смесь внутренних стандартов, лиофилизированную смесь для контроля качества анализа, подвижные фазы A и B, так называемый Реагент-1 (кат. № JSM-CL-503), используемый при пробоподготовке образцов плазмы, а также колонку для высокоэффективной жидкостной хроматографии (ВЭЖХ) аминокислот JASEM (кат. № JSM-CL-575).
Для приготовления образцов плазмы к исследованию к 50 мкл плазмы добавляли 50 мкл раствора смеси внутренних стандартов, перемешивали на вортексе в течение 5 с, добавляли 700 мкл Реагента-1, перемешивали повторно 15 с, центрифугировали 3 мин со скоростью 3000 об./мин, после чего переносили надосадочную жидкость в виалу. Подготовка и хранение анализируемых образцов и вспомогательных растворов производились в соответствии с руководством JASEM.
Анализ образцов осуществляли с помощью ВЭЖХ (Agilent 1290 Infinity II) с масс-спектрометрическим детектированием (ЖХ/МС) (Agilent 6470 А). Транзитные переходы между родительскими ионами и дочерними фрагментами для мониторируемых аминокислот, соответствующие им хроматографические времена удержания, концентрации внутренних стандартов, а также сведения о чувствительности и воспроизводимости анализа приведены в руководстве JASEM.
Статистическую обработку полученных экспериментальных данных проводили с помощью скриптов, написанных на языке R [R Core Team (2018). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/] в RStudio [RStudio Team (2016). RStudio: Integrated Development for R. RStudio, Inc., Boston, MA URL http://www.rstudio.com/]]. Статистическую значимость отличия концентраций исследуемых метаболитов между группами оценивали по значению p-value теста Манна–Уитни. При величине p-value ≤0,05 отличие принимали за статистически значимое, при p-value ≤0,01 – за очень значимое, при p-value ≤0,001 – за максимально значимое.
Результаты и обсуждение
Анализ клинической характеристики обследованных беременных подтвердил их сопоставимость. Возраст беременных, включенных в исследование, варьировал от 25 до 35 лет и составил в среднем 31,4±0,5 и 28,4±0,5 года соответственно по группам. Однако следует отметить, что у пациенток основной группы имело место статистически значимое увеличение частоты хронических заболеваний сердечно-сосудистой системы (7,7%) (р<0,05), хронической венозной недостаточности (23,1%) (р<0,01), нарушения жирового обмена (30,8%) (р<0,05).
При анализе акушерско-гинекологического анамнеза было отмечено статистически значимое увеличение в 1-й группе доброкачественных новообразований яичников (7,7%) и ММ (23,1%) (p<0,05). Анализ акушерских и перинатальных исходов установил, что течение настоящей беременности в I триместре у пациенток основной группы (1-й) статистически значимо чаще осложнялось угрозой прерывания беременности (38,5%) (p<0,01), ретрохориальной гематомой (по данным УЗИ) (15,4%) (p< 0,05). Во II триместре у пациенток 1-й группы также чаще отмечались угроза прерывания беременности (38,5%) и анемия (46,2%) (p<0,05).
Из особенностей течения III триместра беременности следует отметить преобладание в 1-й группе анемии беременных – 61,5%, патологии околоплодных вод в виде маловодия – 15,4%) (р<0,05) и задержки роста плода (ЗРП) – 15,4%) (р<0,05).
В 1-й группе 69,2% пациенток были родоразрешены путем операции кесарева сечения (КС) (р<0,01), при этом средний гестационный срок составил 35 недель, во 2-й группе – 39 недель. У новорожденных в основной группе чаще отмечались такие осложнения, как асфиксия (7,7%) и респираторный дистресс-синдром (РДС) (15,4%).
На следующем этапе работы был проведен количественный хромато-масс-спектрометрический анализ 43 аминокислот. Регистрировали хроматограммы ионного тока образцов сыворотки крови и рассчитывали концентрации аминокислот, исходя из площадей соответствующих хроматографических пиков. Статистический анализ полученных экспериментальных данных позволил выявить 22 аминокислоты, концентрации которых статистически значимо отличались при ПЭ (табл. 1, рис. 1): 3-метилгистидин, аланин, ансерин, аргинин, аспартат, карнозин, цистин, этаноламин, глутамат, глутамин, глицин, гистидин, гомоцитруллин, лизин, метионин, норвалин, O-фосфорилэтаноламин, орнитин, фенилаланин, серин, треонин, тирозин.
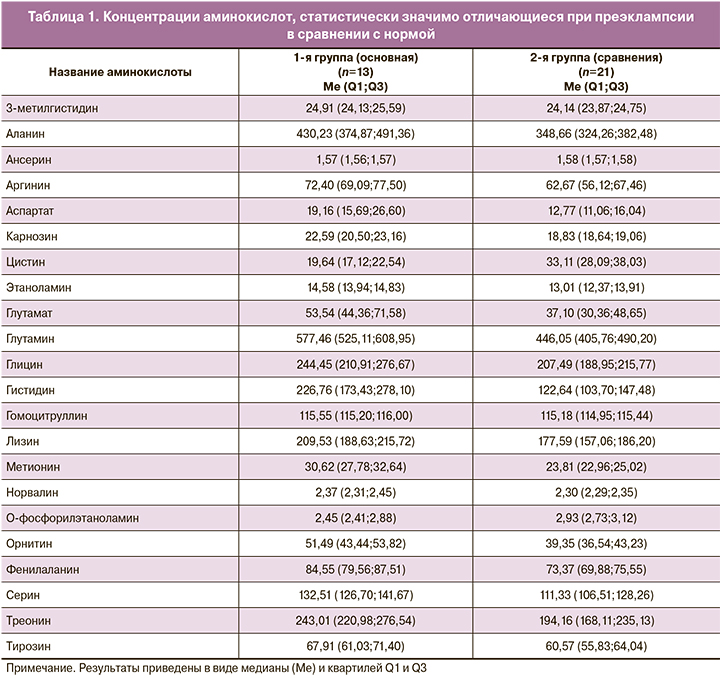
Учитывая полученные результаты количественной хромато-масс-спектрометрии, особый интерес представляло проведение корреляционного анализа с выявлением значимой зависимости между определяемыми метаболитами и ПЭ, а также клинико-анамнестическими данными. Слабая корреляционная связь была выявлена с 8 аминокислотами (ансерин, глутамин, глицин, гистидин, метионин, норвалин, фенилаланин, серин), а умеренная – с 3 аминокислотами: карнозин (rs=0,526; р=0,001), аргинин (rs=0,437; р=0,001), этаноламин (rs=0,403; р=0,003).
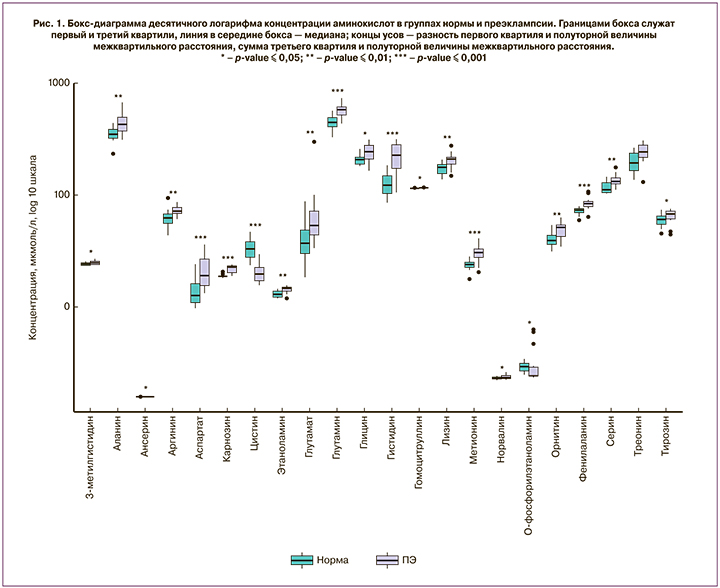
Анализ ROC-кривых показал, что карнозин, аргинин и этаноламин являются потенциально чувствительными и специфическими биомаркерами для диагностики и прогнозирования ПЭ (для карнозина: AUC=0,85 (95% ДИ 0,72–0,97), чувствительность 62%, специфичность 97%; аргинина: AUC=0,79 (95% ДИ 0,65–0,93), чувствительность 77%, специфичность 82%; этаноламина: AUC=0,77 (95% ДИ 0,61–0,93), чувствительность 85%, специфичность 68%) (рис. 2).
 Кроме того, выявлена корреляционная связь карнозина с такими клинико-анамнестическими факторами в основной группе, как гипертензия (средн.) (rs=0,375; р=0,038), протеинурия (rs=0,543; p-value≤0,001), нарушение маточно-плацентарного и фето-плацентарного кровотоков (rs=0,535; p-value ≤0,001 и rs=0,495; p-value ≤0,001 соответственно) и нарушение кровотока в средней мозговой артерии по данным допплерометрии плода (rs=0,548; p-value ≤0,001). Аргинин и этаноламин коррелировали с гипертензией (средн.) (rs=0,462; р= 0,009 и rs=0,428; р=0,002) и протеинурией (rs=0,428; р=0,002 и rs =0,431; р=0,002).
Кроме того, выявлена корреляционная связь карнозина с такими клинико-анамнестическими факторами в основной группе, как гипертензия (средн.) (rs=0,375; р=0,038), протеинурия (rs=0,543; p-value≤0,001), нарушение маточно-плацентарного и фето-плацентарного кровотоков (rs=0,535; p-value ≤0,001 и rs=0,495; p-value ≤0,001 соответственно) и нарушение кровотока в средней мозговой артерии по данным допплерометрии плода (rs=0,548; p-value ≤0,001). Аргинин и этаноламин коррелировали с гипертензией (средн.) (rs=0,462; р= 0,009 и rs=0,428; р=0,002) и протеинурией (rs=0,428; р=0,002 и rs =0,431; р=0,002).
Обсуждение
Выявленные в работе метаболиты принимают участие в регуляции ряда физиологических процессов, обеспечивающих нормальное течение беременности. Интерес представляют установленные их изменения, что подтверждает то, что к основным механизмам, обусловливающим развитие ПЭ, относятся эндотелиальная дисфункция, метаболические аномалии и усиление оксидативного стресса.
В исследовании Kenny L.C. и соавт. [11] в 2005 г. впервые была выделена группа из 8 низкомолекулярных метаболитов (среди них мочевая кислота, 2-оксоглутарат, глутамат и аланин), которая позволяет диагностировать ПЭ. В 2010 г. группа Kenny L.C. [12] подтвердила данные, ранее полученные на системе сверхвысокоэффективной жидкостной хроматографии (СВЖХ) с гибридным масс-спектрометром высокого разрешения LTQ–Orbitrap. В двухстадийном исследовании (поиск/валидация) образцов плазмы женщин на 15±1 неделе гестации была построена классификационная модель методом PLS-DA на основе концентрации в крови 14 метаболитов (включая 5-гидрокситриптофан, деканоилкарнитин, олеиновую кислоту, ацетоуксусную кислоту, сфингозин-1-фосфат) и ROC-анализ (площадь под кривой – 0,92), а также был подтвержден высокий прогностический потенциал разработанной модели.
Гипотеза о том, что метаболические биомаркеры в I триместре обусловливают уникальный профиль у женщин с ПЭ во второй половине беременности, была проверена Odibo A.O. и соавт. [13] с помощью жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ-МС/МС). Обнаружено, что при ПЭ концентрация 7 метаболитов значительно выше по сравнению с контролем: два гидроксилированных эфира карнитина и пять аминокислот (фенилаланин, глутамат, аланин, аргинин, гидроксипролин).
Уровни нескольких аминокислот изменяются при развитии ПЭ. Например, сообщалось о более высоких концентрациях продуктов деградации аминокислот с разветвленной цепью (BCAA), 3-метил-2-оксовалериановой кислоты, 3-гидроксиизобутирата и 3-гидроксиизовалерата в крови/моче [12, 14–16].
Другой важной аминокислотой, которая снижена при ранней ПЭ по сравнению с поздней ПЭ, является аргинин [17]. Аргинин оказывает сосудорасширяющее действие, повышая выработку оксида азота (NO) через Arg-NO путь. Исследования показали, что добавки аргинина могут снижать артериальное давление и тяжесть ПЭ [18]. Этот факт свидетельствует о том, что аргинин может играть важную роль в патогенезе данного осложнения. Необходимы дальнейшие исследования, чтобы понять, являются ли эти изменения причиной или следствием ПЭ. В нашем исследовании также установлена корреляция между аргинином и АГ при ПЭ.
Особый интерес представляет метаболит карнозин, показавший наибольшую корреляционную зависимость с ПЭ и клинико-анамнестическими факторами в нашей работе. Карнозин и близкие к нему дипептиды – гомокарнозин, анзерин, их М-ацетилированные производные – широко распространены в животном мире и встречаются в мышечной ткани и нервной системе. В многочисленных исследованиях выявлены антиоксидантные свойства карнозина и гистидин-содержащих дипептидов, которые предотвращают перекисное окисление в модельных мембранных системах, что позволяет считать их водорастворимым компонентом защитной системы клетки наравне с жирорастворимыми мембраносвязанными антиоксидантами [19]. Известна роль карнозина как «мусорщика» активных форм кислорода (АФК), а также а-Р-ненасыщенных альдегидов, образуемых при окислительном стрессе в реакциях пероксидации жирных кислот, входящих в состав мембран. Карнозин в концентрации, которая стимулирует пролиферацию, присутствует в организме человека лишь в мышечной и нервной ткани – его пролиферативное действие реализуется, скорее всего, только в этих тканях, для которых характерен самый сильный окислительный метаболизм [20]. Можно предположить, что вдобавок к известным активностям по отношению к мышечной ткани карнозин может способствовать регенераторному ответу. Карнозин стимулирует пролиферацию нормальных (неопухолевых) клеток человека. Высокие концентрации карнозина в мышечной ткани необходимы не только для обеспечения физиологических процессов (роль буфера), но и для регенерации мышц после чрезмерных нагрузок. Полученные результаты могут стать базой для исследования вышеуказанных аминокислот в прикладных целях.
Таким образом, определение метаболического профиля при ПЭ уточняет механизмы ее формирования, возникающие во время беременности и приводящие к кратковременным и долгосрочным осложнениям как у матери, так и у ребенка. Установленный в исследовании профиль, включающий карнозин, аргинин и этаноламин, позволяет верифицировать ПЭ и обосновывает перспективность его применения для ранней диагностики и прогнозирования. Применение метаболомного подхода представляется потенциальным инструментом также для мониторинга и профилактики.
Заключение
Несмотря на десятилетия исследований, прогностических биомаркеров ПЭ, которые могли бы значительно снизить частоту неблагоприятных исходов для матери и новорожденного, в настоящее время нет. Учитывая полиэтиологичность и сложность диагностики ПЭ, маловероятно, что найдется универсальный биомаркер, который мог бы диагностировать и прогнозировать ПЭ. До настоящего времени было предложено множество прогностических маркеров, но ни один из них не был успешно внедрен в клиническую практику. В связи с чем необходимы дальнейшие исследования с целью поиска комбинации прогностических и диагностических биомаркеров с использованием омикс- технологий, таких как метаболомика и протеомика. В данном исследовании выявлены 22 аминокислоты со статистически достоверно различающимися концентрациями: 3-метилгистидин, аланин, ансерин, аргинин, аспартат, карнозин, цистин, этаноламин, глутамат, глутамин, глицин, гистидин, гомоцитруллин, лизин, метионин, норвалин, O-фосфорилэтаноламин, орнитин, фенилаланин, серин, треонин, тирозин.
При этом потенциально чувствительными и специфическими биомаркерами для диагностики и прогнозирования ПЭ являлись карнозин, аргинин и этаноламин, что позволяет предложить их использование в качестве неинвазивных предикторов.
Принимая во внимание участие данных биомаркеров в таких процессах, как воспаление, окислительный стресс, ангиогенез, обоснованным является изучение их роли в реализации сигнальных путей при ПЭ, что позволит не только уточнить роль эпигенетических механизмов в формировании данной патологии, но и разработать профилактические мероприятия.



