Недифференцированная дисплазия соединительной ткани (нДСТ) – это гетерогенная группа заболеваний соединительной ткани, при которой набор клинических признаков не укладывается ни в одно из наследственных моногенных заболеваний [1], характеризующаяся структурными и функциональными изменениями соединительной ткани, что вызывает нарушения морфологического строения и функционирования тканей и органов и, в свою очередь, может приводить к различным хроническим болезням [2–4]. Учитывая системность поражения, нДСТ может оказывать отрицательное влияние на течение беременности и перинатальную заболеваемость. В свою очередь, беременность может усиливать фенотипические проявления признаков нДСТ [5].
Данные ряда исследований указывают на роль хронического дефицита ионов магния в патогенезе нарушения формирования соединительнотканных структур, что приводит к хаотичному расположению коллагеновых волокон, характерному для нДСТ. В условиях магниевой недостаточности нарушается способность фибробластов продуцировать коллаген. Кроме того, катионы (Mg2±) регулируют активность ферментов и белков экстрацеллюлярного матрикса (ЭЦМ) [6, 7]. При этом повышается активность матриксных металлопротеиназ (ММP), которые усиливают деградацию коллагеновых и эластиновых волокон, что в свою очередь приводит к увеличению экспрессии тканевых ингибиторов ММР (TIMP) [8, 9].
Транспорт магния в организме регулируется рядом каналов, среди которых наиболее важны TRPM-6 и TRPM-7. Белок TRPM-6 является ионным каналом, транспортирующим двухвалентные катионы, специфически взаимодействующим с другим Mg2±-проницаемым каналом TRPM-7, что приводит к сборке функциональных TRPM-6/TRPM-7 комплексов на поверхности клетки [10, 11]. В связи с вышесказанным изучение содержания магниевых каналов, обеспечивающих биодоступность магния, который регулирует активность ММР, может раскрыть механизмы нарушения баланса метаболических процессов, происходящих в ЭЦМ при нДСТ.
Цель исследования: изучить экспрессию магниевых каналов в рубце на матке после операции кесарева сечения у пациенток с нДСТ.
Материал и методы исследования
В исследование были включены 80 пациенток с рубцом на матке после операции кесарева сечения, которые были разделены на 2 группы: I (основная группа) – 40 пациенток с нДСТ и II (группа сравнения) – 40 беременных без признаков нДСТ.
Критериями включения пациенток являлись: наличие признаков нДСТ (для основной группы); возраст женщин от 18 до 45 лет; доношенная одноплодная беременность; наличие рубца на матке после операции кесарева сечения. Определение степени выраженности нДСТ проводилось по классификации Т.И. Кадуриной [12].
Критерии исключения: дифференцированные формы ДСТ; тяжелая экстрагенитальная патология; многоплодная беременность.
В исследовании использовались клинические, лабораторные, ультразвуковые, морфологические, иммуногистохимические методы. Проводилась гистологическая и гистохимическая окраска гематоксилин-эозиноном и пикрофуксином по Ван Гизон серийных срезов рубца и прилежащего миометрия. Иммуногистохимические реакции проводились на депарафинированных срезах толщиной 4–5 мкм с первичными антителам к TRPM-7 (ABCAM, 1:200), а также ММP-9 и TIMP-1 (Lab Vision, 1:100). Результаты иммуногистохимической реакции оценивались полуколичественным методом в баллах.
Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 [13]. Для определения статистической значимости различий применялись критерий Фишера, Манна–Уитни для малых выборок. Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Результаты исследования и обсуждение
Возраст беременных колебался от 22 до 45 лет и составил в среднем 32,8±1,2 и 31,2±0,9 года соответственно по группам. При анализе массо-ростовых отношений у обследованных беременных отклонений от популяционных норм не выявлено, средняя масса тела составила 76,9±2,1 кг и 79,6±2,1 кг, средний рост 166,5±4,6 см и 165,3±3,2 см соответственно по группам.
В соматическом анамнезе у пациенток основной группы превалировали заболевания сердечно-сосудистой системы (пролапс митрального клапана, вегето-сосудистая дистония, артериальная гипертензия) у 12 (30,0%) пациенток (OR=1,2; CI=0,8-2,1) и миопия у 11 (27,5%) пациенток (OR=0,4; CI=0,2-0,9), что, по-видимому, обусловлено критериями включения в исследование. Вышеуказанное согласуется с данными, полученными О.В. Козиновой и соавт. [14] и С.Л. Рочевой [15], указывающими, что пролапсу митрального клапана и миопии принадлежит одно из ведущих мест в фенотипических проявлениях нДСТ. Среди заболеваний мочевыделительной системы у пациенток основной группы чаще отмечались хронический пиелонефрит – 7 (17,5%) (OR=2,4; CI=0,9-7,5) и цистит – у 4 (10,0%) (OR=2,1; CI=0,5-5,8).
При изучении структуры гинекологической заболеваемости была отмечена высокая частота цервицита (практически у каждой 3-й пациентки) в основной группе – 13 (32,5%) (OR=1,7; CI=0,3-2,8) и хронического сальпингоофорита – 5 (12,5%) (OR=2,2; CI=0,6-4,5). Вместе с тем дисфункция яичников встречалась только у пациенток основной группы – 4 (10,0%) (OR=2,4; CI=1,9-3,7). Данные согласуются с Г.И. Нечаевой [16], указывающей на высокую частоту нарушения становления репродуктивной функции у девочек с нДСТ. В основной группе в 4 раза чаще отмечались ранние – 6 (15,0%) (OR=1,7; CI=1,2-2,8) и поздние самопроизвольные выкидыши – 3 (7,5%) (OR=1,5; CI=1,1-2,6).
Течение настоящей беременности у женщин основной группы чаще осложнялось в I триместре ранним токсикозом – 18 (45,0%) (OR=1,6; CI=1,1-2,8), во II триместре – угрозой прерывания – 14 (35,0%) (OR=1,8; CI=1,3-3,3) и истмико-цервикальной недостаточностью – 6 (15,0%) (OR=3,1; CI=2,1-8,6), в связи с чем проводилась ее хирургическая коррекция; в III триместре – угрозой преждевременных родов – 9 (22,5%) (OR=1,4; CI=1,2-3,9), плацентарной недостаточностью, сопровождающейся задержкой роста плода – 8 (20,0%) (OR=3,7; CI=1,6-9,0). Следует отметить более высокую частоту уменьшения толщины рубца на матке, по данным ультразвукового исследования в основной группе, в отличие от группы сравнения (OR=1,6; CI=1,2-6,2) – 17 (42,5%) и 11 (27,5%) по группам соответственно.
Все пациентки были родоразрешены абдоминальным путем. При этом в основной группе превалировала частота экстренной операции кесарева сечения – 26 (65,0%) наблюдений. Следует отметить, что основными показаниями к родоразрешению являлись: начало родовой деятельности (6–15,0% и 3–7,5%) и подозрение на несостоятельность рубца на матке (3–7,5% и 1–2,5%), а также преждевременное излитие околоплодных вод (4–10,0% и 1–2,5%).
Средняя кровопотеря при родоразрешении составила 768,4±43,2 мл и 684,5±38,1 мл (по группам соответственно). Обращала на себя внимание высокая частота спаечного процесса в малом тазу – 8 (20,0%) и варикозного расширения вен нижнего маточного сегмента – 5 (12,5%) в основной группе (OR=1,7; CI=1,2-4,6 и OR=1,5; CI=1,1-3,7). Анализ особенностей течения послеродового периода не выявил статистически значимых различий у родильниц обеих групп.
Изучение исхода родов для плода и течение раннего неонатального периода у новорожденных установило, что в основной группе чаще диагностировали неонатальную желтуху – 8 (20,0%) (OR=1,8; CI=1,3-3,7), кожно-геморрагический синдром – 7 (17,5%) (OR=3,4; CI=2,2-8,7) и синдром гипервозбудимости центральной нервной системы – 3 (7,5%) (OR=1,4; CI=0,2-3,7).
Учитывая изменения, претерпеваемые маткой во время беременности (максимальная гиперплазия и гипертрофия миометрия, гиперплазия и набухание соединительной ткани), системность поражения при нДСТ [1, 8], нами проведено морфологическое и иммуногистохимическое исследование рубца на матке после кесарева сечения с определением TRPM-7, ММP-9 и ТIМP-1 ткани рубца.
Определение полноценности рубца на матке проводилось на основании морфологического исследования. К критериям неполноценности рубца относили: наличие очагов дезорганизации соединительной ткани в виде мукоидного и фибриноидного набухания и фибриноидного некроза, некроз лейомиоцитов, интрамуральные гематомы и множественные петехиальные кровоизлияния, воспалительную инфильтрацию (лимфогистиоцитарная с примесью лейкоцитов), неоангиогенез.
У пациенток обеих групп выявлялись как полноценные, так и неполноценные рубцы на матке.
При иммуногистохимическом исследовании содержания TRPM-7 маркер выявлялся в виде коричневого окрашивания в цитоплазме гладкомышечных клеток, прилежащих к рубцовой ткани, и в фибробластах в обеих группах. В основной группе выявлено достоверное снижение (р<0,05) содержания магниевых каналов в гладкомышечных клетках до 2,9 балла, по сравнению с группой без нДСТ, где аналогичный показатель составил 5,6 балла (рис. 1 см. на вклейке).
Ряд исследователей указывают на хронический дефицит ионов магния как причину возможных механизмов неправильного формирования соединительнотканных структур с хаотическим расположением коллагеновых волокон, являющихся основным морфологическим признаком клинических проявлений ДСТ [1, 5, 10, 12]. В работах О.А. Громовой и И.Ю. Торшина [10] описаны возможные механизмы магниевой недостаточности при нДСТ.
Как известно, снижение экспрессии магниевых каналов приводит к дефициту магния, и как следствие, увеличению активности ММP, усиливающих деградацию коллагенов ЭЦМ и приводящих к дезорганизации соединительной ткани при нДСТ [6–8].
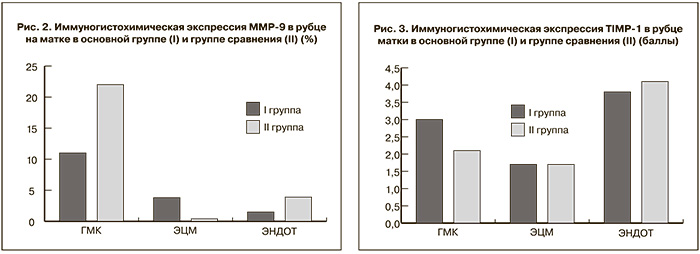
В связи с вышеуказанным на следующем этапе был проведен анализ экспрессии ММP-9 в цитоплазме гладкомышечных и эндотелиальных клеток, а также в фибробластах ЭЦМ. Выявлено увеличение экспрессии ММP-9 как в ЭЦМ, так и в гладкомышечных клетках при нДСТ. При этом в I группе максимальная экспрессия маркера в фибробластах ЭЦМ была значительно выше, чем в группе сравнения. Результаты иммуногистогимического исследования экспрессии ММP-9 в рубце на матке представлены на рис. 2.
Учитывая влияние ТIМP на активность ММP, была определена экспрессия ТIМP-1 в цитоплазме гладкомышечных и эндотелиальных клеток, а также в фибробластах ЭЦМ. При этом выявлено увеличение экспрессии ТIМP-1 в гладкомышечных клетках как в основной группе, так и в группе сравнения (рис. 3).
В ряде работ указывается на снижение содержания магния при нДСТ, регулирующего активность ММР [6, 8, 11]. В нашем исследовании установлено снижение содержания магниевых каналов в основной группе обеспечивающих, как известно, биодоступность магния. Дефицит магния в свою очередь приводит к повышению активности ММР, и как следствие, усилению процессов деградации ЭЦМ. В то же время следует отметить сбалансировнное повышение экспрессии ТIМP-1. Нарушение баланса процессов синтеза и распалда белков ЭЦМ предопределяет нарушение течения процессов репарации и может являться основой для формирования неполноценного рубца на матке. Вышеизложенное объясняет более высокую частоту формирования неполноценного рубца на матке после кесарева сечения при нДСТ. В группе сравнения имеет место сбалансированное и однонаправленное увеличение ММP-9 и ТIМP-1 приводящее к более полноценному течению процессов репарации и, как следствие, меньшей частоте формирования неполноценного рубца.
Таким образом, полученные результаты с одной стороны раскрывают некоторые звенья патогенеза формирования неполноценного рубца на матке при нДСT, а с другой – обосновывают целеообразность включения беременных с нДСТ в группу риска по формированию неполноценного рубца и применения препаратов магния.
Заключение
Установлено снижение экспрессии магниевых каналов при нДСТ, приводящее к дефициту магния, регулирующего активность ММР. Увеличение содержания последних обусловливает нарушение течения процессов метаболизма ЭЦМ. Морфологическим отражением вышеуказанных процессов являются признаки дезорганизации соединительной ткани, что приводит к формированию неполноценного рубца на матке.



