Первоначально понятие «привычный выкидыш» ассоциировали либо с хромосомной патологией плода, либо с материнскими причинами, среди которых обозначались генетические, анатомические, гормональные, тромбофилические, инфекционно-воспалительные и аутоиммунные факторы. При исключении вышеперечисленных этиологических факторов потери беременности определялись как привычные выкидыши неясного генеза. В настоящее время на основании многочисленных исследований в области иммунологии репродукции стало очевидно, что в развитии привычного выкидыша неясного генеза ключевую роль играют аллоиммунные нарушения.
При аллоиммунном генезе привычного выкидыша материнская иммунная система агрессивно реагирует на антигены эмбриона и трофобласта отцовского происхождения. При этом механизм реализации выкидыша напоминает реакции, приводящие к отторжению чужеродного трансплантата. Считается, что вероятность иммунологических нарушений в генезе привычного выкидыша увеличивается при многократных потерях беременности [1]. Множество исследований было проведено с целью определения иммунологических маркеров, свидетельствующих о качестве ответа иммунной системы матери на антигены эмбриона отцовского происхождения [2]. Было установлено, что если в многократные ранние потери беременности вовлечены иммунные механизмы, то шанс доносить беременность без терапии после трех выкидышей составляет 30%, после четырех – 25%, после пяти 5% [3, 4]. Поэтому выявление аллоиммунных причин выкидыша рассматривается как необходимая предпосылка для обоснования патогенетической иммунотерапии. Этим обусловлена и актуальность исследований по поиску маркеров иммунологических нарушений при привычном выкидыше неясной этиологии.
Одним из направлений поиска иммунологических критериев прогноза развития беременности является оценка клеточных субпопуляций периферической крови [5]. Основное внимание привлекают маркеры, цитотоксической функции клеток. Клетки с естественной киллерной активностью (НК-клетки) и фенотипом CD56+, CD16+, CD3-CD56,16+, CD3-CD8+ являются клетками врожденного иммунитета. Цитотоксические клетки, появляющиеся в эффекторной фазе иммунного ответа и имеющие фенотип CD3+CD8+ и CD3+CD56,16+, относят к клеткам адаптивного иммунитета.
Предполагается, что в генезе привычного выкидыша большую роль играет нарушение взаимодействий НК-клеток (CD56+, CD16+) и клеток адаптивного иммунитета. Однако, несмотря на довольно продолжительный период изучения НК-клеток периферической крови в генезе привычного выкидыша, значимость их оценки для прогноза ранней беременности остается невыясненной [6].
В основе реализации механизмов толерантности рассматривалось участие различных типов клеток, однако ведущая роль, по всей видимости, принадлежит Т-клеткам с фенотипом CD4+CD25+ и внутриклеточной экспрессией фактора Foхр3+ Т-регуляторным клеткам (Трег) [7, 8]. Многие авторы дефицит именно Трег-клеток связывают с развитием привычного выкидыша [9].
Считается, что в формировании адекватного ответа иммунной системы матери на антигены плода отцовского происхождения важная роль принадлежит толерогенной молекуле СD200. В результате взаимодействия CD200 с рецепторами как дендритных клеток, так и НК-клеток в них индуцируется секреция индоламиндиоксигеназы, и они приобретают способность посредством продукции ТФР-β (трансформирующего фактора роста-β) стимулировать генерацию Т-регуляторных клеток и, соответственно, индуцировать формирование специфической периферической толерантности [10–13].
В последнее время в иммунологии репродукции активно исследуются механизмы функционирования естественных Трег-клеток. В качестве основы иммунорегуляции беременности рассматривают уже не парадигму Th1/Th2-ответа (Т-хелперов 1-го и 2-го классов), а парадигму Th1/Th2/Th17/Tрег-клеток [14].
Однако до сих пор особенности фенотипа лимфоцитов периферической крови у женщин с привычным выкидышем неясного генеза остаются неизученными, отсутствуют данные о маркерах формирования толерантности в раннем гестационном периоде.
Целью настоящей работы явилось исследование субпопуляций лимфоцитов периферической крови женщин с привычным выкидышем аллоиммунного генеза, включающее оценку содержания киллерных клеток с различным фенотипом, молекулы CD200 и естественных Трег-клеток.
Материал и методы исследования
Группу исследования составили 70 женщин с двумя и более ранними потерями беременности в анамнезе, произошедшими в первом триместре.
В контрольной группе было обследовано вне беременности 15 фертильных женщин без соматических заболеваний с неотягощенным акушерским анамнезом в возрасте от 25 до 38 лет, имеющих последнего ребенка не старше 2 лет.
Отбор пациенток в основную группу проводился вне беременности на стадии предгестационного обследования и подготовки. Всего полное клинико-лабораторное обследование прошли 320 супружеских пар по схеме, разработанной и принятой в отделении профилактики и терапии невынашивания беременности для пар с привычным выкидышем.
Обследование включало: кариотипирование супругов, HLA-типирование, исследование полиморфизмов генов ферментов фолатного цикла и тромбофилий, исключение анатомических причин привычного выкидыша (ультразвуковое исследование органов малого таза в I и во II фазы цикла, гистероскопия по показаниям, соногистерография, гистеросальпингография), диагностика антифосфолипидного синдрома (проба на волчаночный антикоагулянт, антитела к β2-гликопротеину, аннексину, протромбину, фосфатидилсерину и кардиолипину), гормональное обследование, гемостазиологическое обследование, бактериологическое обследование и количественная полимеразная цепная реакция («фемофлор 16», «фемофлор комплекс»), микроскопия вагинального отделяемого, исследование спермограммы партнера.
По результатам проведенного обследования было установлено, что сбалансированные хромосомные перестройки родителей были причиной привычного выкидыша в 3,6% случаев, тромбофилии высокого риска в 6,3%, анатомические факторы (пороки развития матки, синехии, субмукозные узлы миомы матки, полипы эндометрия) в 14,4% случаев. Гормональные нарушения (гиперпролактинемия, поликистозные яичники, недостаточность лютеиновой фазы, сахарный диабет, гипотиреоз) послужили причиной привычных потерь беременностей в 20,0% наблюдений, антифосфолипидный синдром диагностирован в 19,7% случаев, из них в 3,8% – вторичный на фоне системных заболеваний соединительной ткани. У 15 пациенток (4,7%) диагностирована тяжелая экстрагенитальная патология (хронические заболевания печени, почек, артериальная гипертония), в 10 случаях (3,1%) определен мужской фактор привычных выкидышей, рекомендованы вспомогательные репродуктивные технологии, и в 20 наблюдениях (6,3%) диагностированы воспалительные заболевания органов малого таза – сальпингит, сактосальпингс, оофорит, тубоовариальное образование, потребовавшие как консервативного, так и хирургического лечения.
После исключения вышеуказанных причин в группу исследования отобраны 70 супружеских пар с привычным выкидышем, у которых генез потерь беременности оставался неясным и, по-видимому, был обусловлен аллоиммунными причинами. Супружеские пары с аллоиммунным генезом привычных выкидышей составили 21,9% всех пар с привычными потерями беременностей.
Таким образом, критериями включения в группу исследования стали: подписание формы информированного согласия на участие в исследовании, наличие не менее 2 выкидышей ранних сроков от одного и того же партнера (если в каждом случае был подтвержден нормальный кариотип абортуса), возраст женщины от 20 до 40 лет, нормальный кариотип партнеров, нормозооспермия партнера, самопроизвольное наступление беременностей, отсутствие анатомических, генетически обусловленных, аутоиммунных, гормональных нарушений, тяжелых экстрагенитальных заболеваний.
Критериями включения в контрольную группу были: подписанная форма информированного согласия на проведение исследования, наличие как минимум одних родов в анамнезе от данного партнера, возраст женщины от 20 до 40 лет, неотягощенный акушерский и гинекологический анамнез, отсутствие гормональных нарушений, сопровождающихся изменениями менструального цикла, нормальный кариотип партнеров, нормозооспермия.
В связи с наличием ультразвуковых признаков хронических воспалительных заболеваний органов малого таза (хронический эндометрит) и выявленными изменениями по данным изучения влагалищного биотопа (хронический цервицит, вульвовагинит, хламидийная инфекция, выраженный дисбиоз влагалища) противовоспалительная терапия была проведена 40 (57,1%) супружеским парам с привычным выкидышем препаратами с антианаэробной активностью (метронидазол, орнидазол) и при наличии показаний антибактериальными препаратами широкого спектра действия (фторхинолоны).
После проведения противовоспалительной терапии взяты контрольные анализы: все показатели в пределах нормы.
Через 2–3 месяца после проведенного лечения у пациенток исследовали иммунный статус лимфоцитов периферической крови. Кровь для анализа забирали натощак из локтевой вены на 18–22-й день менструального цикла.
Поверхностный фенотип клеток периферической крови определяли с помощью стандартного набора моноклональных антител (мАт), меченных флуоресцеин-изотиоцианатом (ФИТЦ) или фикоэритрином, против антигенов CD3, CD4, CD5, CD8, CD16, CD19, CD16, CD56, CD200 (Becton Dickinson и eBioscience, США). Оценивали содержание основных субпопуляций иммунокомпетентных T-клеток (СD3+, CD4+, CD8+), В-клеток (CD19+), B1-клеток (CD19+CD5+), NK-клеток (СD56+, СD16+), а также содержание Трег (СD4+CD25highCD127low/-). Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45, меченных перидинин-хлорофилл протеином (Per-CP), (Dako, Дания). Для оценки процентного содержания Трег использовали набор, содержащий моноклональные антитела к антигенам CD4, меченые Per-CP (eBioscience, США), CD25, меченые ФИТЦ (Becton Dickinson, США) и СD127, меченые фикоэритрином (eBioscience, США). Моноклональные антитела добавляли непосредственно к цельной крови, затем лизировали с помощью раствора FACS Lysing Solution (Becton Dickinson, США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США).
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее±ошибка среднего. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием пакета Statistica 6 для Windows XP. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007.
Результаты исследования
Было проанализировано содержание лимфоцитов различных фенотипов в периферической крови женщин с привычным выкидышем и фертильных пациенток на 18–20-й день менструального цикла. Результаты исследования представлены в таблице.
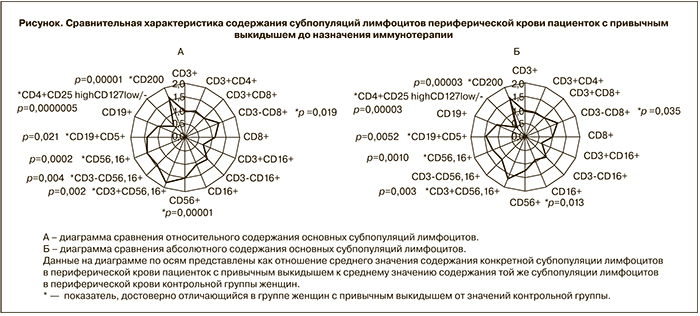
Направления изменений в фенотипе лимфоцитов периферической крови женщин с привычным выкидышем иллюстрируется диаграммами на рисунке.
Как следует из представленных данных, содержание субпопуляций лимфоцитов с фенотипом СD3+, CD4+, CD8+, СD19+, СD16+ в периферической крови женщин с привычным выкидышем не отличается от содержания лимфоцитов с таким же фенотипом женщин контрольной группы. Также не обнаружено отличий по общему содержанию лимфоцитов.
Полученный результат позволяет положительно оценивать последствия проведенного лечения сопутствующих хронических воспалительных заболеваний у обследованных пациенток с привычным выкидышем.
Однако при детальном анализе установлено, что содержание субпопуляций клеток врожденного иммунитета с естественной киллерной активностью и фенотипом CD56+ достоверно превышает аналогичный показатель у женщин контрольной группы (16,4±0,8 и 11,0±0,9 соответственно, p=0,00001), уровень CD3-CD56,16+ также был значимо выше, чем в контроле (11,9±0,7 и 8,5±1,0 соответственно, p=0,004).
Установлено, что достоверно выше, чем в контроле, было содержание субпопуляции клеток адаптивного иммунитета с цитотоксической функцией CD3+CD56,16+ и субпопуляции B1-клеток с фенотипом CD5+CD19+, функцией которой, как считается, является продукция аутоантител.
В то же время существенно ниже, чем в контроле, было содержание Трег-клеток у женщин с привычным выкидышем, а содержание клеток с фенотипом CD200+ достоверно превышало значения у фертильных женщин. При этом соотношение клеток с фенотипом CD200+ и клеток с фенотипом CD4+CD25highCD127low- было значимо выше у женщин с привычным выкидышем по сравнению с контролем (4,70±2,71 и 1,80±0,33, соответственно, р=0,00000003).
Обсуждение
Агрессивные реакции материнской иммунной системы, направленные против фетальных тканей, сопряжены с нарушением формирования толерантности к аллоантигенам плода [15]. Поэтому обширные дискуссии вызывают вопросы механизмов развития толерантности к антигенам плода отцовского происхождения и определения факторов, способствующих нарушениям этого процесса [5, 16]. В качестве одной из подобных причин долгое время рассматривали слабый ответ на отцовские антигены вследствие совместимости супругов по системе НLА, что, по мнению некоторых исследователей, приводило к развитию привычных выкидышей [17–19].
Выявленное в нашем исследовании преобладание среди лимфоцитов субпопуляций клеток с киллерной активностью является отражением тенденции к провоспалительному ответу, которое, по-видимому, способствует наступлению беременности, но не ее прогрессированию. В основе реализации механизмов толерантности рассматривалось участие различных типов клеток, однако ведущая роль, по всей видимости, принадлежит Т-клеткам с фенотипом CD4+CD25+ и внутриклеточной экспрессией фактора Foхр3+ Трег-клетками [20, 21]. Это уникальная субпопуляция клеток, обладающих специфической супрессорной активностью. Трег-клетки играют критическую роль в периферической толерантности, в подавлении аутоиммунитета и реакции отторжения трансплантанта [5, 15]. Показано, что во время беременности доля Tрег-клеток среди CD4+-клеток периферической крови и децидуальной оболочки матки увеличивается в течение раннего периода и во втором триместре и уменьшается в послеродовом периоде [22, 23].
Многие авторы дефицит Трег-клеток связывают с развитием привычного выкидыша [9]. Согласно полученным нами результатам, уже вне беременности в дни предполагаемой, потенциально возможной имплантации у женщин с привычным выкидышем происходит достоверно значимое снижение уровня Трег-клеток по отношению к фертильным женщинам. Этот результат позволяет предположить нарушение процесса толерантности, которое может быть диагностировано вне беременности с последующей возможностью коррекции. В свете последних данных по исследованию роли естественных регуляторных клеток высказано мнение, что иммунотерапия невынашивания скорее должна иметь целью не иммуносупрессию, а повышение толерантности [7]. Полученные нами данные о низком содержании Трег-клеток у женщин с привычным выкидышем позволяют согласиться с высказанным мнением.
Неожиданным результатом исследования явилось значимое увеличение содержания лимфоцитов с фенотипом CD200+ у женщин с привычным выкидышем по сравнению с контрольной группой. Является ли этот феномен компенсаторным механизмом в условиях нарушенной толерантности, предстоит исследовать с помощью динамического наблюдения пациенток в течение первого триместра беременности и на фоне проведения иммунотерапии.
Заключение
Супружеские пары с привычными потерями аллоиммунного генеза составляют 21,9% всех пациентов с привычным выкидышем. Для пациенток с привычным выкидышем аллоиммунного генеза вне беременности характерны достоверные изменения субпопуляций лимфоцитов киллерных клеток с различным фенотипом, содержания естественных Трег-клеток и лимфоцитов с фенотипом CD200+ по сравнению с фертильными женщинами. Для выяснения потенциальной роли данных изменений в диагностике и контроле за эффективностью проводимой терапии требуются дальнейшие исследования.



