Аденомиоз – гетеротопию эндометрия в миометрии – достаточно редко диагностируют до гистерэктомии, проводимой по поводу маточных кровотечений и анемии в связи с лейомиоматозом [1]. Однако при гистологическом изучении операционного материала в 30–50% клинических наблюдений находят очаги аденомиоза различной степени, характеризующиеся миграцией (или инвазией) эпителия и цитогенной стромы в миометрий [2, 3]. Способность к инвазии определяется пролиферативным и миграционным потенциалом патологических пролифератов эндометрия, а также свойствами микроокружения – клеток соединительной ткани миометрия и экстрацеллюлярного матрикса, компоненты которого ответственны за поддержание межклеточных контактов. Изменение этих двух параметров приводит к возможности инвазии ткани эндометрия за пределы эутопической локализации с развитием аденомиоза, сопровождающегося патологическими изменениями миоцитов и фибробластов, характеризующими также лейомиоматоз [4, 5]. В миоматозных узлах и перифокальном миометрии повышена активность металлопротеиназ-2 и 9 [6], что приводит к ослаблению межклеточных контактов.
Наряду с металлопротеиназами, в экстрацеллюлярном матриксе большинства тканей существует еще один значимый фермент, разрушающий межклеточные контакты, – гепараназа-1 (HPSE-1), которая является эндогликозидазой, расщепляющей углеводные молекулы гепарансульфатов (HSP) [7]. HSP протеогликаны являются базовыми компонентами внеклеточного матрикса, в котором они взаимодействуют с рядом физиологически важных макромолекул; при этом характер сульфатирования цепей HSP определяет потенциал взаимодействия протеогликанов и поддержание межклеточных контактов. Таким образом, ферментная деградация HSP с помощью HPSE-1 приводит к ослаблению межклеточных контактов и способствует миграционной активности клеточных элементов.
В связи с этим HPSE-1 как фермент деградации HSP является важным регулятором широкого спектра физиологических и патологических процессов, в том числе эмбрионального развития, тканевого гомеостаза, а также опухолевой трансформации и прогрессирования неопластических процессов [8, 9].
Высокая активность HPSE-1 установлена в клинических опухолевых образцах при аденокарциноме предстательной железы [10–12] и других злокачественных опухолях [13, 14]. Очень высокий уровень активности HPSE-1 был обнаружен в метастазах рака молочной железы в головном мозге; при этом ингибирование опосредованных HPSE-1 сигнальных путей способствовало повышению эффективности химиотерапии. Эти данные в совокупности с результатами других работ позволили рассматривать эндогликозидазу как одну из перспективных мишеней в комплексной противоопухолевой терапии [15, 16].
Таким образом, наличие гормонозависимого и спонтанного пролиферативного и проонкогенного потенциала эндо- и миометрия при аденомиозе и миоматозе [17, 18] обращает внимание к дальнейшему поиску регулирующих их формирование и развитие патогенетических факторов и прогностических биомаркеров.
Цель исследования – изучить характер экспрессии HPSE-1 и ее субстратов HSP в эутопическом и гетеротопическом эндометрии у пациенток репродуктивного возраста с аденомиозом и лейомиоматозом с учетом медленного и прогрессирующего развития миомы, оцениваемого по объему тела матки.
Материал и методы исследования
Проведено клинико-морфологическое исследование случай-контроль с акцентом на иммуногистохимическом изучении эндогликозидазной активности (по экспрессии HPSE-1) в эутопическом и гетеротопическом эндометрии 48 пациенток в возрасте от 25 до 45 лет (38,90±5,87 года) с клиническим диагнозом «симптомная миома тела матки». Диагноз установлен по данным ультразвукового исследования (УЗИ), предоперационной гистероскопии с раздельным лечебно-диагностическим выскабливанием, объективного обследования и интраоперационной картины. Аденомиоз верифицирован по результатам гистологического исследования операционного материала; во всех случаях установлена диффузная форма аденомиоза. Исследование одобрено комитетом по этике Новосибирской областной клинической больницы – клинической базы кафедры акушерства и гинекологии Новосибирского государственного медицинского университета.
Критериями включения в исследование были пациентки с диагностированными с помощью УЗИ миоматозными узлами и клиническими показаниями к хирургическому лечению, уровень ФСГ в крови менее 30 mМЕ/мл, а также информированное согласие пациентки. Среди клинических наблюдений были случаи с одной крупной лейомиомой или одной доминирующей и несколькими сравнительно меньшими опухолевыми узлами. Критерии исключения: терапия гормональными препаратами (по крайней мере, за 3 месяца до исследования) и неопластические процессы.
Пациентки разделены на 2 репрезентативные по возрасту группы, в зависимости от объема матки: 24 женщины – до 12 недель беременности (объем тела матки по УЗИ (226±92 мм3) и 24 – более 12 недель (1024±130 мм3) с быстро растущей миомой при динамическом наблюдении (увеличение объема на 4 недели в течение года) [19]. Опухолевые узлы были представлены I и II типом субсерозных, II типом субмукозных узлов и интерстициальной локализацией [20]. Оперативное лечение выполняли в плановом порядке на 7–12-й день (в течение фолликулярной фазы) менструального цикла.
Образцы операционного материала – эутопического эндометрия с миометрием, лейомиоматозных узлов и аденомиоза – фиксировали в 4% параформальдегиде, приготовленном на фосфатном буфере Миллонига (pH 7,2–7,4); парафиновые срезы окрашивали гематоксилином и эозином и по ван Гизону с докраской эластических волокон резорцин-фуксином Вейгерта. Экспрессию HPSE-1 и HSP исследовали на парафиновых срезах толщиной 5 мкм с помощью двухшагового стрептавидин-биотинового иммуногистохимического метода, в качестве первичных антител использовали моноклональные антитела к HPSE-1 («Abnova») в разведении 1:200 и к HSP («Serotec») в разведении 1:100; продукты реакции визуализировали с помощью диаминобензидина (DAB), срезы докрашивали гематоксилином. Для негативного контроля вместо первичных антител использовали 5% бычью сыворотку, в качестве позитивного контроля – препараты аденокарциномы предстательной железы. Площадь интра- и экстрацеллюлярных продуктов иммуногистохимической реакции оценивали с помощью микроскопа Axio Scope.A1 с фотокамерой AxioCam MRc5 и программного обеспечения ZEN blue (С.Zeiss), для каждого параметра оценивали по 30 изображений с увеличением 63×12.
Статистическую обработку результатов осуществляли с помощью пакета прикладных статистических программ Statistica v.6.0. Для оценки равенства дисперсий между независимыми выборками применяли критерий Фишера; для сравнения клинических показателей – парный критерий Вилкоксона; для сравнительной оценки DAB-позитивных продуктов иммуногистохимической реакции между группами – критерий Манна–Уитни. Различия считали достоверными при уровне значимости р<0,05.
Результаты исследования
Объем тела матки, косвенно свидетельствующий о скорости прогрессирования патологического процесса, лег в основу деления пациенток на 2 группы, имеющие различия и в особенностях клинической картины (табл. 1). При отсутствии различий в возрасте пациенток и параметрах менструального цикла, у женщин 2-й группы объем матки достоверно превышал показатель 1-й группы (р=0,0008), и было снижено содержание гемоглобина в крови перед операцией (р=0,0235). Обращала на себя внимание тенденция более высокого индекса массы тела (ИМТ) и толщины М-эхо.
При клиническом обследовании пациенток с большим объемом матки (2-я группа, пролиферирующая миома, или прогрессирующий рост) чаще имел место болевой синдром, в анамнезе в 3 раза чаще – воспалительные заболевания органов малого таза (ВЗОМТ), обусловленные, в том числе более частыми искусственными прерываниями беременности. В отличие от 2-й группы, при объеме матки до 12 недель (1-я группа) выявлено в 4 раза больше случаев с патологией шейки матки (табл. 2).
Особенности клинической картины, характер поражения матки и репродуктивные планы пациенток обусловили выбор и объем хирургического вмешательства. В 1-й группе (объем матки до 12 недель) преобладали миомэктомии – 15 (62,5%) случаев, надвлагалищная ампутация матки – 6 (25%) и экстирпация матки – 3 (12,5%). В отличие от 1-й группы, во 2-й группе с интраоперационным объемом матки более 12 недель доминировала надвлагалищная ампутация матки – 18 (75%) наблюдений, и лишь 6 (25%) женщинам выполнены миомэктомии.
При светооптическом исследовании операционного материала пациенток 1-й группы с медленным ростом объема матки в большинстве случаев диагностирован аденомиоз 1-й степени (21 из 24 случаев), в 3 остальных – 2-й степени. У пациенток 2-й группы степень аденомиоза чаще была более выраженной: 1 степень – 15 женщин, 2-я – 6 и 3-я – 3 пациентки.
Во всех клинических наблюдениях обеих групп эутопический эндометрий соответствовал морфологии пролиферативной фазы цикла, из них в 25% случаев отмечены признаки хронического эндометрита; при этом у пациенток 2-й группы в некоторых наблюдениях структурные особенности расценивали как проявления железисто-кистозной гиперплазии эндометрия.
 В отличие от эутопического эндометрия, для гистологии гетеротопий эндометрия, или очагов аденомиоза, в пролиферативную фазу цикла характерен выраженный полиморфизм эпителиального и стромального компартментов: плотность цитогенной стромы, форма и диаметр просветов желез резко варьировали; отмечена кистозная трансформация с атрофией эпителия.
В отличие от эутопического эндометрия, для гистологии гетеротопий эндометрия, или очагов аденомиоза, в пролиферативную фазу цикла характерен выраженный полиморфизм эпителиального и стромального компартментов: плотность цитогенной стромы, форма и диаметр просветов желез резко варьировали; отмечена кистозная трансформация с атрофией эпителия.
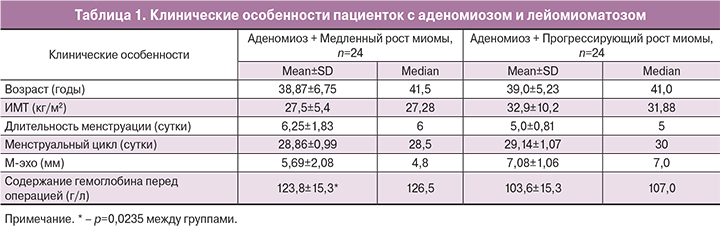
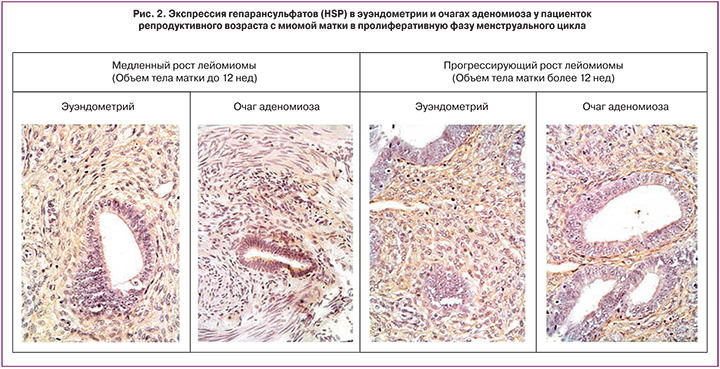
По данным иммуногистохимического исследования парафиновых срезов, экспрессия HPSE-1 в эутопическом эндометрии в обеих группах пациенток в раннюю и среднюю стадии фазы пролиферации менструального цикла была очень слабой – практически отсутствовала в эпителии желез и отмечалась в единичных стромальных клетках (рис. 1). Интра- и экстрацеллюлярные продукты иммуногистохимической реакции на HPSE-1 составили 0,33±0,07% площади в эутопическом эндометрии женщин 1-й группы и 0,44±0,16% – 2-й группы; и соответственно, в очагах аденомиоза двух групп пациенток – 0,24±0,05% и 2,28±0,9% (p<0,001).
Это согласуется с результатами X. Xu и соавт. [21], которые показали, что у пациенток с генитальным эндометриозом положительная реакция на HPSE-1 имела место в железистых и стромальных клетках образцов эутопического эндометрия, полученных в позднюю стадию фазы пролиферации, а также в раннюю, среднюю и позднюю стадии фазы секреции. С помощью методов статистического анализа (критерий Фишера) авторами установлено, что экспрессия HPSE-1 в секреторную фазу была достоверно выше, чем в раннюю и среднюю фазы стадии пролиферации, но недостоверно выше, чем в позднюю фазу пролиферации. В наших наблюдениях в очагах аденомиоза при медленном росте объема матки (до 12 недель) в 1-й группе экспрессия HPSE-1 также была минимальной, но при прогрессирующем росте миомы (2-я группа) – повышена в несколько раз.
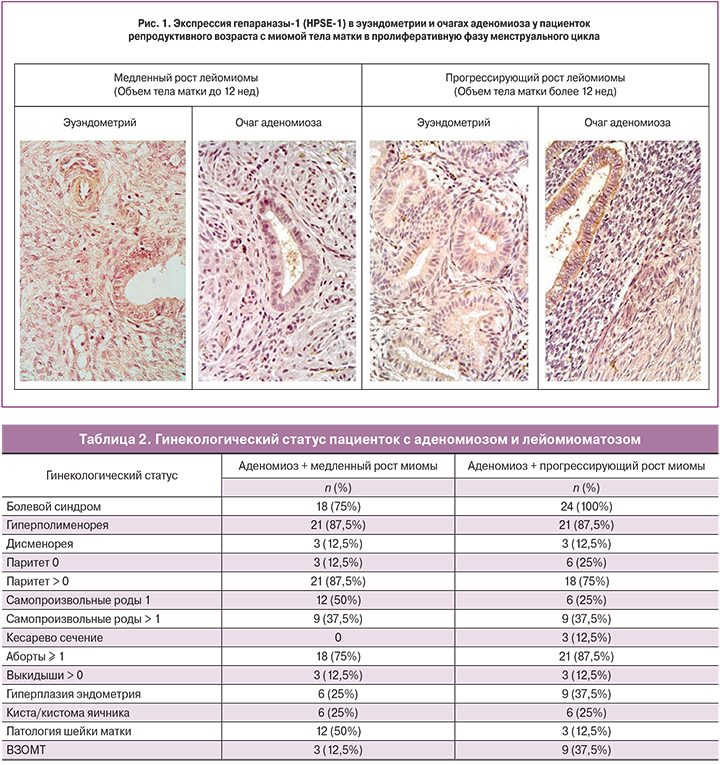
При анализе результатов иммуногистохимического исследования экспрессии HPSE-1 в эутопическом эндометрии и очагах аденомиоза возникает вопрос, как эти различия согласуются с содержанием HSP – субстрата фермента HPSE-1. При изучении срезов с помощью специфических антител на углеводные цепи HSP установлено, что содержание DAB-позитивных продуктов реакции на HSP обратно пропорционально экспрессии HPSE-1 (рис. 2) и характеризуется минимальными показателями в очагах аденомиоза во 2-й группе – при прогрессирующем росте миом с большим объемом матки. Так, % площади экспрессии HSP в ткани эутопического эндометрия пациенток 1-й группы составил 7,92±2,8 и у пациенток 2-й группы – 8,64±3,88; в очагах аденомиоза обеих групп – 3,76±1,29% и 2,02±0,9% соответственно.
Таким образом, в очагах аденомиоза HPSE-1 экспрессируется в эпителии и субэпителиальных микрососудах, и при пролиферирующем характере роста миомы с объемом тела матки до 12 недель экспрессия HPSE-1 достоверно превышает уровень 2-й группы (p<0,001), что характеризуется негативной корреляцией экспрессии HSP (рис. 3). Это подтверждает важную роль HPSE-1 в деградации HSP и изменении микроокружения, в том числе свойств экстрацеллюлярного матрикса. Одновременно с этим, обращают на себя внимание аналогичные пролиферативные свойства и клеточных популяций миометрия в этой группе пациенток.
При объеме матки до 12 недель (1-я группа) при гистологическом исследовании операционного материала обнаружены лейомиомы различного диаметра, хорошо ограниченные, соответствующие по классификациям [2, 19] простым миомам. Опухолевые узлы представлены переплетающимися пучками цитологически монотонных гладкомышечных клеток с умеренно эозинофильной цитоплазмой и удлиненными ядрами без атипии и митотической активности, окруженных прослойками стромы с сосудами, матрикс-продуцирующими клетками и коллагеновыми волокнами. На поперечных срезах в небольшом числе случаев отмечена перинуклеарная оптическая прозрачность цитоплазмы опухолевых миоцитов. В 5 субмукозных лейомиомах выявлены фокусы некроза, организующегося с участием грануляционной ткани с большим числом сидерофагов.
У пациенток 2-й группы доминирующий и более многочисленные мелкие узлы характеризовались типичной структурой, однако у 17 из 24 пациенток отмечена повышенная «клеточность» лейомиоматозных узлов по сравнению с нормальным миометрием и с простыми миомами, что соответствовало гистологии пролиферирующей миомы. Клетки с эухромными овальными или удлиненными ядрами и скудной цитоплазмой формировали плотные пучки и были ассоциированы с крупными толстостенными сосудами, а также сосудами типа синусоидов и плотной периваскулярной мононуклеарной клеточной инфильтрацией. На периферии узлов опухолевые клетки незаметно интегрировались с окружающим миометрием.
Заключение
В очагах аденомиоза пациенток репродуктивного возраста с прогрессирующим ростом миоматозных узлов и объемом тела матки более 12 недель экспрессия HPSE-1 достоверно превышает соответствующие показатели пациенток с медленным ростом миомы и объемом матки до 12 недель. Сравнительный иммуногистохимический анализ эутопического и гетеротопического эндометрия демонстрирует отрицательную корреляцию между экспрессией HPSE-1 и ее субстратов HSP и свидетельствует о важной роли эндогликозидазной активности в изменениях экстрацеллюлярного матрикса миометрия при прогрессировании сочетанной патологии матки – адено- и лейомиоматоза.



