Считается, что дефицит питательных микроэлементов затрагивает примерно два миллиарда человек во всем мире, причем беременные женщины подвергаются особому риску из-за их высоких метаболических потребностей [1]. В Российской Федерации практически все категории населения и особенно беременные женщины испытывают значительный дефицит в обеспеченности как витаминами, так и микроэлементами. Данные института питания РАМН свидетельствуют о том, что дефицит микронутриентов имеет от 50 до 70% беременных женщин. Дефицит витаминов группы В выявляется у 20–100% обследованных, аскорбиновой кислоты – у 13–50%, каротиноидов у 25–94% на фоне относительно удовлетворительной обеспеченности витаминами А и Е.
 При этом менее половины женщин России в период беременности принимает поливитаминные препараты с какой-либо регулярностью. В то же время физиологическая значимость отдельных витаминов и минералов для организма беременных женщин более весома, чем для других контингентов лиц [2].
При этом менее половины женщин России в период беременности принимает поливитаминные препараты с какой-либо регулярностью. В то же время физиологическая значимость отдельных витаминов и минералов для организма беременных женщин более весома, чем для других контингентов лиц [2].
Адекватность пищевого обеспечения беременной женщины, а затем и новорожденного ребенка, вскармливаемого грудным молоком, лежит в основе не только выживаемости ребенка, но и возможности сформировать у него высокий уровень здоровья. Нормирование пищевых веществ для беременных и кормящих женщин — труднорешаемая проблема нутрициологии. Рекомендации по потреблению, принятые в разных странах, могут иметь существенные различия (табл. 1).
Во время беременности потребности в питательных веществах увеличиваются, что необходимо для поддержания роста и развития плода, а также его адаптации к материнскому метаболизму [3]. Недоедание матерей вызывает недостаточное потребление макронутриентов и/или микроэлементов, обычно существующее у женщин из развивающихся стран, оказывает отрицательное влияние на организм матери и ребенка [4]. Нехватка питательных веществ у матерей повышает риск преждевременных родов, послеродового кровотечения и анемии, пороков развития плода, а также материнской и младенческой смертности [5]. Модификация питательной среды матери и плода также может оказать значительное влияние на долгосрочную траекторию здоровья ребенка. Это явление, известное как «раннее программирование жизни», относится к процессу, при котором изменения внутриматочной среды в любое критическое время развития плода определяет патологию во взрослой жизни [6]. Экспериментальные модели программирования на животных показали ряд изменений в питании во время беременности или в раннем послеродовом периоде, что привело к динамическим изменениям в эпигеноме потомства и экспрессии генов, участвующих в энергетических гомеостатических путях. Так, чрезмерное потребление пищи с высоким содержанием жиров во время беременности у крыс связано с постоянными изменениями в центральных гомеостатических (то есть гипоталамических) системах, которые позже приводят к ожирению потомства [7].
Всемирная организация здравоохранения (ВОЗ) считает, что дефицит питательных микроэлементов вызывает особую озабоченность в странах с низким уровнем дохода, где питание женщин, вероятно, является недостаточными как по количеству, так и по качеству. Важность питательных микроэлементов становится все более очевидной, особенно в условиях их нехватки, в которых женщины могут вступать в беременность с множественными недостатками питательных микроэлементов [8]. Например, у 38% беременных женщин есть дефицит железа, приводящий к анемии, 15% имеют дефицит витамина А, вызывающего ночную слепоту [9]. Нарушение антенатального питания может повлиять на развитие и рост плода в краткосрочной перспективе, последующий рост и когнитивное развитие в среднесрочной перспективе и риск хронического заболевания в долгосрочной перспективе [8]. Введение микронутриентов снижает распространенность преждевременных родов [10]. Однако основным обоснованием недавних рекомендаций по внедрению микронутриентов для беременных женщин в развивающихся странах стало другое: данные о роли микронутриентов в снижении задержки роста и развития плода и смертности новорожденных [11, 12].
Гипотеза о происхождении развития здоровья и болезни предполагает критические или чувствительные периоды в раннем развитии, в которых воздействие окружающей среды может иметь продолжительное влияние на рост и физиологию [13].
У людей эти критические периоды, как полагают, происходят преимущественно в пренатальной жизни и распространяются на раннее детство. Предлагаемые механизмы включают взаимодействие между окружающей средой (включая материнское питание), генами и гормонами, в котором эпигенетическая регуляция играет значимую роль [14]. Доказательства гипотезы основываются главным образом на наблюдательных исследованиях, показывающих ассоциации между низким весом при рождении и неблагоприятными результатами для здоровья во взрослом периоде жизни [15], исторических событиях, таких как голландская голодная зима [16], а также исследованиях на животных [17].
В последнее время все чаще стали появляться работы, направленные на изучение изменений состояния материнских микроэлементов и их влияния на программирование развития потомства. Этот интерес вполне оправдан, поскольку сразу несколько микронутриентов тесно связаны с метаболической системой, регулирующей эпигенетические механизмы, такие как метилирование ДНК и последующие изменения в экспрессии генов [18]. Таким образом, пренатальные добавки широко рекомендуются до и во время беременности, потому что они сбалансированы специально для удовлетворения потребностей в питательных веществах матери и развивающегося плода, с особым акцентом на фолиевую кислоту [19].
Как известно, состояние микроэлементов во время беременности оказывает влияние на развитие и обмен веществ плода. Наиболее существенно увеличивается потребность в водорастворимом витамине B (витамин B9). Витамины метильной группы такие, как фолиевая кислота, являются активными регуляторами в метаболизме с одним углеродом. Повышенное потребление этих микроэлементов оказалось эффективной стратегией снижения неблагоприятных результатов беременности таких, как дефекты нервной трубки у потомства [20]. В 1931 L. Wills в своей работе показал успешное применения фолиевой кислоты во время беременности для лечения мегалобластной анемии [21]. Имеются веские доказательства того, что фолиевая кислота во время беременности снижает дефекты нервной трубки и смертность от них [22]. Применение фолиевой кислоты в период до зачатия (за 1 месяц до и после зачатия) и употребление ее на протяжении всей беременности резко уменьшило заболеваемость дефектами нервной трубки. Кроме того, обязательное обогащение фолиевой кислотой зерновых продуктов с 1998 года также способствовало уменьшению распространенности дефектов нервной трубки на 50% [21]. Для создания и сохранения материнских запасов, которые впоследствии смогут удовлетворить потребности быстрорастущих тканей, специалисты общественного здравоохранения рекомендуют всем женщинам детородного возраста ежедневно употреблять не менее 400 мг синтетической фолиевой кислоты в дополнение к диетическим фолатам (естественно встречающиеся фолаты) [20]. Содержание фолиевой кислоты в пренатальных добавках составляет от 400 до 2000 мг. Согласно канадскому обществу акушеров-гинекологов, женщины с высоким риском дефицита должны потреблять в 12,5 раз (5000 мг/сут) выше фолиевой кислоты для оптимальной защиты от дефектов нервной трубки [23]. Эти рекомендации могут быть достигнуты путем увеличения потребления обогащенных продуктов и/или приема поливитаминов или пищевых добавок [24]. В дополнение к фолиевой кислоте другие витамины группы В такие как витамин B12 (кобаламин) и B6 (пиридоксин), играют важную роль в поддержании здоровья матери и плода во время беременности. Поскольку комбинация витаминов группы В играет большую роль в снижении частоты врожденных дефектов, витамины В12 и В6 как комплексные или однокомпонентные добавки также рекомендуются в более высоких количествах во время беременности [25].
Дефицит витамина D широко распространен во всем мире [26]. Все еще обсуждается вопрос о том, какими должны быть нормальные уровни витамина D: равно или больше 20 нг/мл, 30 нг/мл или даже еще выше [27]. J. Cannell предположил, что дефицит витамина D во время беременности может способствовать развитию аутизма у детей [28]. Во-первых, витамин D способствует репарации генов ДНК. Во-вторых, его дефицит, по-видимому, может вносить вклад в мутации генов de novo, способствующие развитию аутизма. Реактивные формы кислорода являются частью нормальной метаболической функции клеток организма. Кислород нестабилен, его реактивные формы способствует повреждению ДНК на регулярной основе. В связи с этим человеческий геном нуждается в постоянной репарации. В случае отсутствия восстановления генома резко увеличивается число случаев рака. Витамин D обладает репаративными функциями по отношению к геному. Его недостаточность способствует развитию злокачественных и аутоиммунных заболеваний [29].
Витамин D играет важную роль в иммунной системе [30], повышая синтез и секрецию глутатиона, супероксиддисмутазы и тиоредоксинредуктазы [31], а также в индуцировании Т-регуляторных клеток, снижая риск аутоиммунных состояний [32].
Витамин D важен для развития мозга плода во время беременности [33]. Дефицит витамина D во время беременности может приводить к развитию преэклампсии, преждевременных родов, иммунодефициту новорожденных, гестационному диабету [34] и риску аутизма [35]. Помимо вышесказанного, дефицит витамина D у беременных ухудшает регулирующую функцию Т-клеток [36].
Дефицит железа является ведущим дефицитом питательных веществ в мире. Около 1,2 млрд человек во всем мире имеют дефицит железа, распространенность же скрытого дефицита, в котором отсутствуют явные признаки анемии, несомненно, выше [37]. Всемирные показатели распространенности анемии у беременных женщин по различным оценкам составляют 38,3%. 22% женщин, проживающих в развитых странах, страдают от анемии, что подчеркивает важность оценки статуса железа независимо от географического положения [9].
Во время беременности низкий уровень гемоглобина встречается как физиологическое явление, особенно во втором триместре. Потребность в железе возрастает в период роста плода и формирования плаценты. Анемия во время беременность может привести к неблагоприятным результатам ее течения, а иногда и к материнской смертности [38]. Дефицит железа во время эмбрионального и постнатального развития является важной проблемой для здоровья, которая может иметь долгосрочные последствия для потомства. Во время беременности и послеродовом периоде развитие анемии связан с долгосрочным когнитивным метаболическими дисфункциями и сердечно-сосудистыми нарушениями [39]. Интересно, что добавление железа с целью воспаления запасов железа у детей, матери которых страдали дефицитом железа во время беременности, не уменьшает осложнения со здоровьем. Это говорит о крайне необходимом адекватном снабжении железом плода на протяжении всей беременности [40].
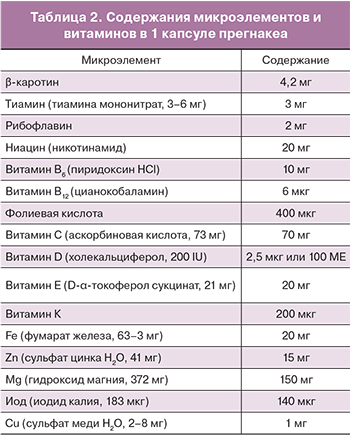 В связи c вышеизложенным, становится очевидной актуальность проблемы оптимизации питания беременной и кормящей женщины. Для этой цели необходим прием поливитаминных комплексов, включающих макро- и микроэлементы. Лекарственный препарат прегнакеа, разработанный учеными английской компании Vitabiotics Ltd. UK, имеет сбалансированную формулу необходимых витаминов и микроэлементов для поддержания здоровья матери и плода. Его состав содержит оптимальные суточные дозировки самых важных нутриентов с учетом их синергетического взаимодействия и высокой биологической доступности (табл. 2).
В связи c вышеизложенным, становится очевидной актуальность проблемы оптимизации питания беременной и кормящей женщины. Для этой цели необходим прием поливитаминных комплексов, включающих макро- и микроэлементы. Лекарственный препарат прегнакеа, разработанный учеными английской компании Vitabiotics Ltd. UK, имеет сбалансированную формулу необходимых витаминов и микроэлементов для поддержания здоровья матери и плода. Его состав содержит оптимальные суточные дозировки самых важных нутриентов с учетом их синергетического взаимодействия и высокой биологической доступности (табл. 2).
Профилактическое применение комплекса микроэлементов прегнакеа с первого триместра улучшает питательную среду по содержанию Fe, фолиевой кислоты, витамина D и тиамина. Это подтверждает аргумент, что прием профилактических низкодозированных добавок Fe предпочтительнее использования высоких доз для улучшения состояния Fe во время беременности. Результаты проведенного исследования по применению поливитаминного комплекса прегнакеа показали, что удалось снизить риски острых инфекционных заболеваний и развитие хронической внутриутробной гипоксии плода в 5 раз, патологических родов в 4 раза, нарушения неонатальной адаптации в 6 раз, развития гестоза в 3 раза. Выявлена тесная взаимосвязь снижения рисков опасных осложнений беременности и родов с профилактикой и ранним лечением полигиповитаминозов и гипомикроэлементозов. Преимуществом комбинации комплекса прегнакеа для беременных по сравнению с другими мультивитаминными препаратами, содержащими более высокие дозировки активных веществ, можно считать сбалансированную формулу, позволяющую подобрать индивидуальный режим и необходимые дозы. Это дает возможность точно корректировать необходимую потребность в витаминах и минералах в процессе развития беременности. Например, в случаях необходимости лечебных, а не профилактических дозировок пациентка может принимать не одну капсулу в сутки, а две или три с последующим снижением дозы. Оптимальный количественный состав капсул прегнакеа способствует хорошей переносимости препарата, отсутствию тошноты и дискомфорта после приема, что часто наблюдается при лечении лекарственными формами с большим содержанием активных веществ [41].
Включение в состав препарата жирорастворимого витамина К способствует профилактике кровотечений, нормализации свертываемости крови как у матери, так и у новорожденного первые дни жизни. Нарушения свертываемости крови у беременных женщин и кровотечения у новорожденных в результате недостаточности витамина К описаны при использовании карбамазепина, фенитоина, примидона, фенобарбитала, гексамидина, этосуксимида, вальпроата, топирамата (в дозе более 200 мг/сут) и окскарбазепина. В отсутствие профилактики кровотечение развивается у 10% детей и сопряжено с 30% риском летальности. Крайне опасны внутричерепные геморрагии у плода, которые могут вызывать перманентные неврологические поражения. Несмотря на низкую проницаемость плаценты для витамина К, беременным женщинам, которые получают вызывающие гипопротромбинемию лекарства, для профилактики нарушений свертываемости у новорожденных рекомендуется прием прегнакеа как единственного минерально-витаминного комплекса, содержащего витамин К [42].
Несомненным преимуществом прегнакеа является содержание β-каротина и полное отсутствие в его составе витамина А (ретинола). Согласно нормам суточного потребления витаминов, принятым в Российской Федерации, беременная женщина должна потреблять не более 1200–1400 мкг витамина А, что соответствует 3960–4620 МЕ. Потребление витамина А в неоправданно высоких дозировках (более 10 000 МЕ/сут) для беременных опасно, так как оказывает эмбриотоксическое действие на плод. Учитывая риск развития вышеуказанных состояний, целесообразно использовать в качестве источника витамина А его предшественник – β-каротин. β-каротин превращается в организме в витамин А в количествах, необходимых организму, и не обладает токсическим действием, возникающим при переизбытке или передозировке витамина А [43].
Рациональное питание кормящей матери является одним из важнейших условий, обеспечивающих гармоничный рост, адекватное морфологическое и функциональное созревание различных органов и тканей, оптимальные параметры психомоторного и интеллектуального развития, устойчивость ребенка к действию инфекционных и других неблагоприятных внешних факторов, что в значительной степени определяет благополучие организма в течение всей последующей жизни. Ребенок первого года жизни испытывает особую потребность в полноценном пищевом рационе в связи с интенсивным ростом и психомоторным развитием, формированием всех органов и систем. Наиболее физиологичным для вскармливания ребенка как по количественному так и по качественному составу, является грудное молоко, которое оптимально обеспечивает все потребности ребенка в белках, жирах, углеводах, витаминах, минеральных солях. В связи с этим важность оптимального состава материнского питания сложно переоценить. Беременные и кормящие женщины имеют достаточно мощную поддержку своего питания, предусмотренную эволюционными механизмами. Однако все еще требуется изменять отжившие стереотипы питания, шире внедрять самые современные обогащающие и коррегирующие продукты и препараты. Только такими комплексными усилиями можно довести до максимума профилактический эффект материнского и детского питания.



