Вопросы терапии урогенитального кандидоза продолжают оставаться актуальными в связи с широкой распространенностью заболевания и ростом числа штаммов грибов рода Candida, устойчивых к антимикотическим препаратам.
Согласно отечественным и зарубежным руководствам по ведению пациенток с вульвовагинальным кандидозом, приоритетным в терапии заболевания является применение топических форм антимикотических средств азолового ряда. Так, в Европейских клинических рекомендациях (European International Union against sexually transmitted infections guideline on the management of vaginal discharge, 2018) для лечения острых форм вульвовагинального кандидоза рекомендуются клотримазол, миконазол и эконазол. Несмотря на упоминание в тексте рекомендаций полиеновых макролидов (нистатин), группа европейских экспертов считает, что преимущество в терапии острых форм урогенитального кандидоза должно отдаваться назначению азолов, как наиболее эффективных и безопасных лекарственных средств [1, 2]. Американские и канадские эксперты (CDC, Sexually Transmitted Diseases Treatment Guidelines, 2015 и Canadian Guidelines on Sexually Transmitted Infections, 2016) при острых формах заболевания также рекомендуют однократные или непродолжительные (2–3-дневные) схемы терапии препаратами азолового ряда, считая их более эффективными, чем полиеновые макролиды (нистатин) [3, 4].
В Клинических рекомендациях Российского общества дерматовенерологов и косметологов и Российского общества акушеров-гинекологов в терапии острого вульвовагинального кандидоза предлагается применять как однократные, так и курсовые схемы терапии такими топическими антимикотическими препаратами, как клотримазол, миконазол, бутоконазол, тиоконазол, терконазол, итраконазол и натамицин с увеличением продолжительности их применения при рецидивирующих формах заболевания [5, 6].
Согласно действующим клиническим руководствам, одним из препаратов выбора в терапии вульвовагинального кандидоза является клотримазол – антимикотическое средство с широким спектром действия, демонстрирующее терапевтическую эффективность не только в отношении патогенных форм дрожжеподобных грибов, но и воздействующее на бактериальные аэробные и анаэробные микроорганизмы (Streptococcus spp., Staphylococcus spp., Bacteroides spp., G. vaginalis, Corynebacteria и др.) при отсутствии влияния на лактобациллярную микрофлору.
При анализе вышеупомянутых отечественных клинических рекомендаций обращает на себя внимание, что клотримазол предлагается применять как в форме вагинальных таблеток, так и в форме 1% (с продолжительностью терапии 7–14 дней) и 2% крема (в течение 3 дней). Стоит отметить, что таблетированные интравагинальные формы препарата не всегда оказывают должный терапевтический эффект при кандидозном поражении вульвы, а 1% крем является формой для наружного применения, что при отсутствии аппликаторов затрудняет его интравагинальное введение. Согласно же инструкции по применению клотримазола 2%, рекомендованная длительность терапии составляет 6 дней, при этом сравнительного изучения эффективности 3- и 6-дневных режимов терапии не проводилось.
Цель исследования: представить результаты применения различных форм препарата клотримазол (2%, крем и вагинальные таблетки 100 мг) и схем его назначения (в течение 3 и 6 дней) у пациенток с вульвовагинальным кандидозом.
Материалы и методы
Под наблюдением находились 60 женщин (в возрасте от 18 до 50 лет) с вульвовагинальным кандидозом, которые были разделены на 3 равные по количественному составу группы: 1-я группа применяла в качестве терапии клотримазол 2%, крем, ежедневно интравагинально и наружно (при поражении вульвы) в течение 3 дней; 2-я группа – клотримазол 2%, крем, интравагинально и наружно (при поражении вульвы) в течение 6 дней; 3-я группа – клотримазол, 100 мг вагинальные таблетки, в течение 6 дней.
При микроскопическом исследовании оценивалось наличие вегетирующих форм грибов (бластоспор и псевдомицелия). Для выделения и оценки морфологических особенностей колоний грибов рода Candida использовали агар Сабуро. Идентификация выделенных образцов осуществлялась на основе наблюдаемого роста на субстрате CHROMagar Candida. В сомнительных случаях в качестве подтверждающего теста применяли метод полимеразной цепной реакции в режиме реального времени (ЦНИИ Эпидемиологии). Культуральным методом также изучалась динамика количественных показателей условно-патогенной и лактобациллярной микрофлоры до и после проведенной терапии. Оценка эффективности лечения проводилась после завершения терапии, а также через 14 и 30 дней.
Статистический анализ
Статистический анализ полученных результатов проводили на персональном компьютере с Microsoft Windows 10 с использованием непараметрических методов в программе STATISTICA 8 и Microsoft Exсel 365. Сравнение двух рядов данных по их средним величинам и величинам стандартных отклонений проводилось с использованием t-критерия Стьюдента. При уровне значимости p<0,05 различия считались статистически значимыми.
Результаты
При оценке субъективных клинических проявлений вульвовагинального кандидоза было установлено, что зуд, жжение в области половых органов и патологические вагинальные выделения, отмечавшиеся у всех пациенток до лечения, на момент окончания терапии сохранялись только у 3/20 (15%) пациенток 1-й группы и 5/20 (25%) пациенток 3-й группы. При этом все женщины 1-й группы наблюдали снижение интенсивности данных симптомов по сравнению с исходными показателями, а 2/20 (10%) пациентки 3-й группы свидетельствовали об отсутствии динамики со стороны клинических проявлений. Во 2-й группе на момент окончания терапии все женщины отмечали отсутствие симптомов вульвовагинального кандидоза (зуда, жжения, творожистых вагинальных выделений). Через 14 и 30 дней после лечения отсутствие симптомов заболевания регистрировалось у 18/20 (90%) пациенток 1-й группы и 20/20 (100%) пациенток 2-й группы, а в 3-й группе у 4/20 (20%) женщин сохранялись субъективные симптомы заболевания в течение всего периода наблюдения (рис. 1).
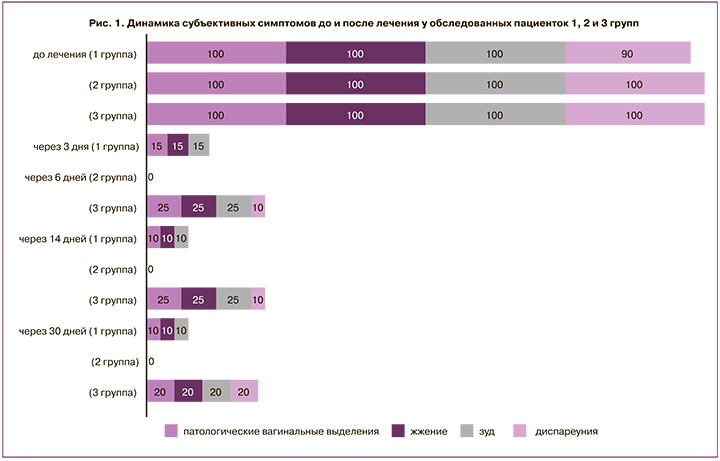
Снижение интенсивности клинических признаков заболевания наблюдалось у большинства пациенток 1-й и 2-й групп (30/40 (75%)) в первые 3 дня терапии, а у пациенток 3-й группы – на 4–6-й день терапии.
Отсутствие объективных признаков вульвовагинального кандидоза (гиперемии, отечности, вагинальных выделений творожистого характера в заднем своде влагалища) у 85% пациенток 1-й группы регистрировалось сразу после окончания терапии и сохранялось на протяжении всего периода наблюдения, у 3/20 (15%) женщин – через 14 дней и у 1/20 (5%) – через 30 дней наблюдались умеренно выраженные творожистые вагинальные выделения на фоне слабой гиперемии слизистой оболочки влагалища. Анализ анамнестических данных показал, что все пациентки с отсутствием терапевтического эффекта имели в анамнезе более 2 эпизодов заболевания в течение последнего года. У пациенток 2-й группы через 14 и 30 дней после терапии не было зарегистрировано субъективных и объективных симптомов вульвовагинального кандидоза, а в 3-й группе гиперемия, отечность слизистой оболочки вульвы и влагалища, а также патологические вагинальные выделения выявлялись у 4/20 (20%) женщин.
Микроскопические признаки вульвовагинального кандидоза (псевдомицелий дрожжеподобных грибов и бластоспоры) отсутствовали через 14 дней после терапии у 17/20 (85%) пациенток 1-й группы, 20/20 (100%) пациенток 2-й группы и 16/20 (80%) пациенток 3-й группы, через 30 дней – у 18/20 (90%), 20/20 (100%) и 15/20 (75%) пациенток соответственно. Повышенное количество лейкоцитов (более 20 в поле зрения) в вагинальном отделяемом до проведения терапии регистрировалось у 13/20 (65%) пациенток 1-й и 3-й групп и у 14/20 (70%) пациенток 2-й группы, а через 14 и 30 дней после лечения сохранялось только у 2/20 (10%) пациенток 3-й группы.
По результатам культурального исследования в этиологической структуре заболевания у обследованных женщин преобладала C. albicans, которая выявлялась у 16/20 (80%) пациенток 1-й группы и 18/20 (90%) пациенток 2-й и 3-й групп. C. glabrata была обнаружена у 2/20 (10%) пациенток 1-й и 2-й групп и 1/20 (5%) пациентки 3-й группы, C. krusei – у 1/20 (5%) пациентки 1-й группы, C. parapsilosis и С. tropicalis – у 1/20 (5%) пациентки 1-й группы и 1/20 (5%) пациентки 3-й группы. После проведенного лечения дрожжеподобные грибы были обнаружены только у пациенток 1-й и 3-й групп: C. albicans в количестве менее 102 КОЕ/мл – у 2/20 (10%) пациенток 1-й группы и в количестве более 103 КОЕ/мл – у 3/20 (15%) пациенток 3-й группы, C. glabrata в количестве менее 102 КОЕ/мл – у 1/20 (5%) пациентки 3-й группы (рис. 2).
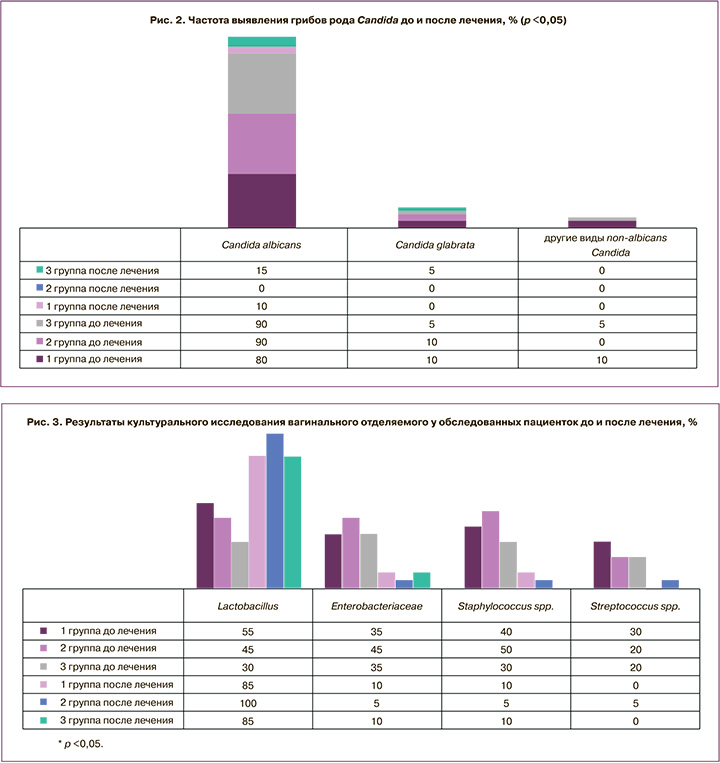
До начала терапии у большинства пациенток исследуемых групп при культуральном исследовании также наблюдались повышенные количественные показатели (более 104 КОЕ/мл) условно-патогенных микроорганизмов (Staphylococcus spp.,
Streptococcus spp., Enterobacteriaceae) и сниженное количество или отсутствие лактобациллярной микрофлоры. Через 30 дней после проведенной терапии было установлено достоверное снижение частоты выделения условно-патогенных микроорганизмов в клинически значимом количестве, а также нормализация показателей вагинального микроценоза у большинства обследованных пациенток (рис. 3).
Обсуждение
По мнению большинства исследователей, составляющими успешной терапии вульвовагинального кандидоза являются: применение топических лекарственных препаратов с целью максимально быстрого устранения симптомов заболевания; назначение антимикотических средств, характеризующихся низким уровнем резистентности к ним возбудителя инфекционного процесса и высокой активностью в отношении как Candida albicans, так и non-albicans видов, а также удобство применения для пациентов и низкая частота побочных эффектов, обеспечивающие оптимальную приверженность терапии.
Клотримазол является препаратом для местного воздействия в очаге инфекционного процесса и, по данным современных исследований, характеризуется низким уровнем устойчивости к нему различных видов дрожжеподобных грибов: за десятилетний период (с 2010 по 2020 гг.) уровень чувствительности Candida albicans к клотримазолу варьировал в пределах 92,7–100%, а Candida non-albicans – в пределах 83,3–100% [7]. Возможность топического применения препарата обеспечивает минимальное количество побочных эффектов и в связи с отсутствием системного воздействия на организм приоритетна для пациенток с экстрагенитальной патологией, а наличие одноразовых аппликаторов делает возможным максимально точное дозирование и удобное введение препарата.
В процессе наблюдательного исследования нами был установлен не только быстрый, но и стойкий терапевтический эффект применения клотримазола в форме 2% вагинального крема: нормализация клинических и лабораторных показателей в течение 30 дней наблюдения была установлена у 90% пациенток, применявших препарат в течение 3 дней, и у 100% пациенток, проводивших 6-дневный курс терапии, что значимо превышало показатели излеченности пациенток 3-й группы, применявших вагинальные таблетки клотримазола (75%). По нашему мнению, этому способствовало локальное нанесение препарата не только на слизистую оболочку влагалища, но и вульвы, возможное при применении лекарственного средства в форме крема. Также по результатам настоящего исследования можно предполагать, что для пациенток с рецидивирующим вульвовагинальным кандидозом предпочтительным будет являться 6-дневный курс терапии клотримазолом 2%, в результате проведения которого была установлена клиническая и лабораторная эффективность в 100% наблюдений.
Известно, что доминирование в составе вагинальной микрофлоры Lactobacillus spp. (более 70%), продуцирующих молочную кислоту, перекись водорода (Н2О2) и антимикробные вещества – бактериоцины, является одним из ведущих факторов колонизационной резистентности вагинального биотопа [8, 9]. Научно доказано, что повышение количества Lactobacillus spp. оказывает противовоспалительное действие и приводит к снижению вирулентности Candida albicans за счет ингибирования образования гиф [10]. В свою очередь, снижение количества лактобактерий потенцирует размножение условно-патогенных микроорганизмов, а также является фактором риска развития вульвовагинального кандидоза [11]. Избыточный рост Staphylococcus spp., Streptococcus spp., Enterobacteriaceae также нередко способствует повышению pH вагинального содержимого, изменению химического состава и иммунологических свойств вагинального секрета, что повышает риск развития кандидозной инфекции [12].
В настоящем исследовании было установлено положительное влияние клотримазола на состояние вагинального микроценоза. У обследованных пациенток до начала лечения лактобациллярная микрофлора определялась у 11/20 (55%) женщин 1-й группы, 9/20 (45%) женщин 2-й группы и 6/20 (30%) женщин 3-й группы, а высокие количественные показатели условно-патогенных микроорганизмов (Enterobacteriaceae, Staphylococcus spp., Streptococcus spp.) регистрировались более чем у половины обследованных пациенток. В результате проведенного лечения условно-патогенные микроорганизмы в клинически значимых значениях определялись только у 5/20 (8,3%) пациенток, а увеличение количественных показателей лактобациллярной микрофлоры через 30 дней наблюдалось у 90% женщин.
Таким образом, комбинированное (интравагинальное и наружное) применение клотримазола в форме 2% крема привело к достоверному уменьшению клинических признаков воспаления и нормализации лабораторных показателей у 17 (85%) пациенток в течение 3 дней, что превысило аналогичные показатели при более длительном курсе терапии клотримазолом 100 мг в форме вагинальных таблеток. Наибольшая эффективность применения клотримазола 2%, крем – 100% была установлена при 6-дневном курсе терапии.
Заключение
Применение клотримазола в форме 2% крема обеспечивает быстрое и стойкое купирование клинических и лабораторных проявлений вульвовагинального кандидоза, а также нормализацию показателей вагинальной микрофлоры. Оптимальный профиль антимикотической и противомикробной эффективности клотримазола 2% для интравагинального и наружного применения, превосходящий таковой при применении данного лекарственного средства в форме вагинальных таблеток, позволяет рекомендовать его в качестве одного из препаратов выбора в терапии вульвовагинального кандидоза.



