К современным практикующим гинекологам в 80% наблюдений, обращаются пациентки с жалобами на наличие патологических выделений из нижних отделов урогенитального тракта. После проведения клинико-лабораторного и инструментального методов обследования бактериальный вагиноз (БВ) диагностируют в 40–60% наблюдений, вульвовагинальный кандидоз (ВВК) в 20–30% наблюдений, а наличие смешанной инфекции в 20% наблюдений [1–4].
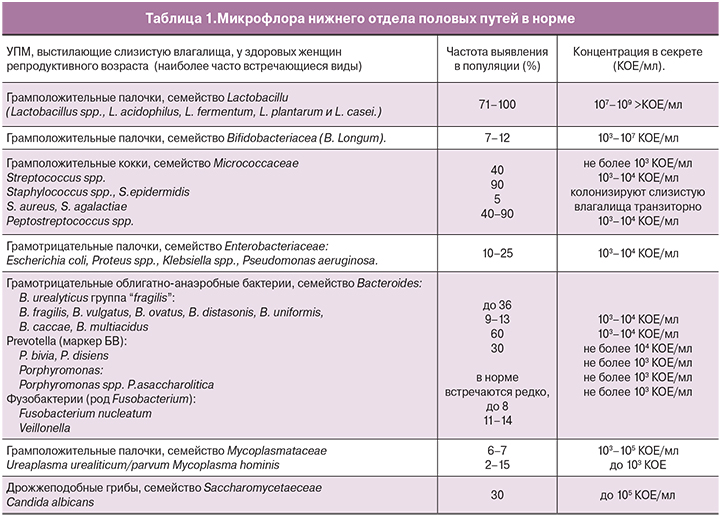
Для осуществления качественной диагностики нарушений микробиоценоза влагалища и своевременного подбора лечения необходимо иметь четкое представление о его состоянии в норме и при патологии. Микрофлора нижнего отдела половых путей у здоровых женщин представлена широким спектром сапрофитных и условно-патогенных микроорганизмов (УПМ) (табл. 1). Они содержатся в небольшом количестве, не превышающем для каждого 103–104 КОЕ в 1 мл выделений.
При отсутствии патологии доминирующее положение во влагалище занимают микроорганизмы семейства Lactobacillaceae (71–100%), которые значительно преобладают над УПМ. Основная роль Lactobacillaceae заключается в осуществление неспецифической защиты экосистемы влагалища. Их наличие в высокой концентрации не только препятствует контаминации вагинального тракта экзогенными микроорганизмами, но и ограничивает рост УПМ, монополязация которых может привести к возникновению различных патологических состояний [5–7].
На сегодняшний день, парадокс инфекционно-воспалительных заболеваний нижних отделов урогенитального тракта заключается в том, что несмотря на то, что у нас накоплен огромный опыт в диагностике и лечении такой патологии, мы все равно нуждаемся в их постоянном усовершенствовании. Такая потребность обусловлена тем, что практический врач все чаще сталкивается с атипичным, затяжным и часто рецидивирующим течением простой, на первой взгляд, патологии.
Накопленный опыт показывает, что манифестация БВ не всегда ассоциирована с активацией таких типичных патогенов как Gardnerella vaginalis, Mobiluncus curtisii, Prevotella, Peptostreptococcus и Bacteriods spp. Существует еще 35 некультивируемых видов уникальных бактерий. К ним относятся Atopobium vaginae, БВ-ассоциированные бактерии — BVAB 1, BVAB 2, BVAB 3, Megasphera spp., Eggerthella spp. и Leptotrichia spp. Благодаря многочисленным исследованиям и разработкам, сегодня у нас есть возможность качественно и количественно определять такие виды возбудителей. ПЦР диагностика в формате Real-time позволяет провести сравнительный анализ конкретных представителей нормо- и условно-патогенной микрофлоры, а также оценить общее количество микроорганизмов во влагалище [8–10].
Получение максимально полного представления о состоянии биоценоза нижних отделов урогенитального тракта является большим подспорьем для практикующего врача, однако, оно не всегда способствует, достижению желаемого результата при лечении патологии. Возможно, развитие такой ситуации связано не только с устойчивостью микроорганизмов к уже имеющимся в нашем арсенале препаратов, но и с их способностью образовывать биопленки. Механизм формирования последних обусловлен тем, что при соприкосновении изолированных сообществ друг с другом, микроорганизмы создают особый матрикс и объединяются в общую структуру. В результате микробные ассоциации фиксируются на различных абиотических и биотических поверхностях. При этом бактерии в биопленках полностью защищены от фагоцитоза и других компонентов врожденного и приобретенного иммунитета. Такая особенность диктует необходимость подбора терапии, которая будет включать не только использование антимикробных и антибиопленочных препаратов, но и поддерживать кислую среду в нижних отделах половых органов.
Манифистация ВВК также сопряжена с целым рядом трудностей. Во-первых, среди населения процент самолечения очень высок. Данный факт не только не позволяет судить о истинной распространенности инфекционной патологии в популяции, но и делает невозможным для врача качественно и своевременно провести диагностику и лечение заболевания.
Из данных литературы известно, что 75% женщин в возрасте до 25 лет хотя бы однократно получали терапию, направленную на лечение ВВК, 40–50% пациенток нуждаются в повторном проведении курса терапии, у 5% больных развивается стойкая рецидивирующая форма ВВК (РВВК), а в 20– 50% наблюдений наличие возбудителя рода Candida удается выявить случайно при первичном обращении к гинекологу с целью профилактического осмотра.
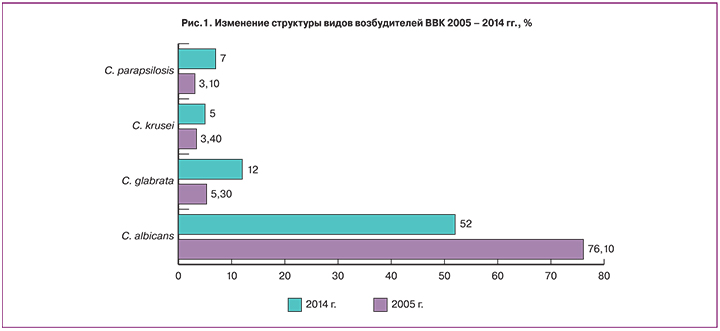
Несмотря на имеющийся большой арсенал антимикотических препаратов и многочисленных схем лечения, процент обращения по поводу обострения инфекции ни только не снижается, а неумолимо растет. Такое явление многие специалисты связывают с ростом распространенности видов non-albicans, среди которых наиболее часто встречаются C. glabrata, C. tropicalis, C. krusei, C. parapsilosis. Данные авторов демонстрируют, что структура возбудителей ВВК постепенно меняется и роль C. albicans в развитии инфекционного процесса снижается, в то время как значимость видов non-albicans наоборот возрастает (рис. 1) [11–13].
ВВК, ассоциированный с видами возбудителей non-albicans, относится к осложненным, однако, триггером развития заболевания является не изменение свойств возбудителя, а снижение резистентности организма-хозяина. В последнее время, именно это утверждение лежит в основе изучения особенностей гормонального и иммунного статусов у пациентов, а также их генотипических особенностей.
Различия в гормональной и иммунной системах у больных с ВВК были хорошо продемонстрированы и разъяснены на примере беременных женщин еще много лет назад. Ученые обратили внимание на тот факт, что в когорте таких пациенток ВВК встречается в 2–3 раза чаще, чем у небеременных. Данное явление было объяснено развитием у них частичного временного иммунодефицита. Проведенные исследования свидетельствовали, что во время беременности соотношения клеточных субпопуляций (Т-лимфоциты хелперы 1-го типа /Т-лимфоциты 2-го типа — цитотоксические) изменяются в пользу цитотоксических клеток. В дальнейшем, возникают изменения гуморального звена иммунитета: снижается уровень иммуноглобулинов класса G в сыворотке крови, а уровень иммуноглобулинов классов А и М увеличивается. Происходит угнетение фагоцитарной активности нейтрофилов и макрофагов, что усиливает восприимчивость к инфекции.
Гиперэстрогенемия и гиперпрогестеронемия во время беременности тоже является одним из важнейших факторов, предрасполагающих к возникновению ВВК. Так гиперэстрогенемия способствует повышению пролиферации клеток влагалищного эпителия, в результате чего содержание в них гликогена увеличивается и изменяется pH среда во влагалище. В следствии такого процесса степень колонизации дрожжеподобными грибами возрастает. Гиперпрогестеронемия, также является предрасполагающим фактором для развития ВВК, так как гликоген, освобождающийся при разрушении поверхностных клеток влагалищного эпителия, превращается в глюкозу, которая является прекрасной питательной средой для дрожжеподобных грибов. Более того, важно упомянуть, что клетки дрожжевых грибов имеют рецепторы, которые распознают половые гормоны. В связи с чем, процесс адгезии грибов к эпителию гениталей довольно прост.
Возвращаясь к особенностям иммунной системы при ВВК, нельзя не отметить, что при исследовании больных с ВИЧ-инфекцией, был установлен факт наличия у них повышенной колонизации влагалища грибами Candida, однако, несмотря на наличие системной иммуносупресии, частота РВВК росла умеренно. Такое наблюдение позволило ученым сделать вывод, что кратность обострения ВВК зависит в первую очередь от состояния местных защитных иммунорегуляторных механизмов, изучение особенностей которых, наиболее популярно сегодня в рамках проблемы ВВК.

Из приведенных данных следует, что в основе описанных патологических состояний в первую очередь лежит нарушение локального иммунного ответа. Такое утверждение обосновывает не только целесообразность интравагинального применения препаратов, но и свидетельствует о том, что выбранное лекарственное средство не должно оказывать негативного влияния на лактобактерии.
Вид возбудителя, который вызывает манифест описанных заболеваний, играет роль не только в формировании особенностей течения патологического процесса, но и должен являться основанием для осуществления персонализированного подхода к пациенту. В связи с чем, поиск новых или совершенствование уже имеющихся препаратов является важной и актуальной задачей [14, 15].
Производные имидазола на протяжении ни одного десятка лет применяются для лечения и входят в состав комплексной терапии БВ и ВВК. Эти препараты широко известны не только специалистам, но и населению, что немало важно в настоящее время. Специфика течения привычных инфекционных процессов и изменение структуры видов патогенов, которые их провоцируют, неминуемо привело к решению вопроса о совершенствовании известных лекарственных средств. Одним из таких производных имидазола, является 2% вагинальный крем клотримазол. Отличительная особенность препарата заключается в том, что он не только обладает широким спектром действия, но и не оказывает негативного влияния на Lactobacillaceae, что важно, так как в основе развития заболевания лежит нарушение локального иммунного ответа. К тому же, производитель утверждает о том, что входящие в состав лекарственного средства компоненты эффективны в отношении видов non-albicans.
Цель нашего исследования заключалась в проведении сравнительного анализа эффективности усовершенствованного производного имидазола с общепринятой стандартной терапией.
Материалы и методы исследования
Отобрано 160 женщин от 18 до 35 лет. При первичном обращении все пациентки предъявляли жалобы на выраженный дискомфорт со стороны наружных половых органов и обильные выделения из половых путей. У каждой из них во время осмотра была отмечена резкая гиперемия слизистой в области предверия влагалища, малых половых губ и цервикального канала шейки матки (экзоцервицит). Все исследуемые были обследованы на наличие инфекций, передающихся половым путем (ИППП) и вирусных заболеваний (HPV, CMV, HSV1/2 типов). Им также проводилось измерение рН вагинального секрета, аминотест, микроскопия мазка отделяемого из половых путей, культуральный метод диагностики и ПЦР в формате Real-time.
После обследования нами было отобрано 90 (100%) женщин, у которых отсутствовали ИППП и в состав микрофлоры входили ассоциации Atopobium vaginae, Gardnerella vaginalis и Candida krusei. Они были рандомизированны на 2 группы. В группу сравнения вошли 45 пациенток, которые получали терапию по стандартной схеме: тинидазол по 1 г в сутки перорально однократно в течение 5 дней и натамицин по 100 мг 1 раз в сутки интравагинально в течение 6 дней. В основную группу были включены 45 женщин, у которых с целью лечения БВ, ассоциированного с Atopobium vaginae и Gardnerella vaginalis был также использован тинидазол по 1 г в сутки 1 раз в течение 5 дней, а терапия non-albicans ВВК проводилась с применением 2% крема клотримазол 1 раз в сутки интравагинально в течение 6 дней. Контроль эффективности терапии в обеих группах был проведен через 14 дней после окончания терапии.
Результаты исследования и обсуждение
При оценке эффективности терапии, первое на что мы обратили внимание во время опроса исследуемых, что у пациенток основной группы такие симптомы как зуд и жжение со стороны наружных половых органов были купированы сразу, после первого дня приема препаратов в 48% (43) наблюдений. В то время как в группе сравнения такой ответ на лечение был достигнут лишь в 22% (22) наблюдений к концу первых суток терапии и в 44% (40) наблюдений к концу третьих суток. Такую скорость исчезновения симптомов у пациентов основной группы, можно объяснить тем, что производное имидазола имеет кремовую основу, которая оказывает влияние на скорость репаративных процессов. В связи с чем, можно утверждать, что препарат обладает высокой эффективностью при поражениях вульвы.
Последующий контроль эффективности лечения был также основан на проведении микроскопии мазка отделяемого из половых путей, культурального метода диагностики и ПЦР в формате Real-time. Исследования продемонстрировали, что в основной группе полной эрадикации возбудителей БВ и ВВК удалось добиться в 47% (42) наблюдений. При этом количество Lactobacillaceae было нормальным и варьировалось в пределах 106–108 КОЕ. В оставшихся 3% (3) наблюдений несмотря на проводимое лечение, возник рецидив заболевания через 7 дней после окончания приема препаратов. Состояние пациенток потребовало смены терапии, курс лечения у них был пролонгированным. Возможно, неудовлетворительный результат лечения у трех женщин основной группы был связан с исходно низким количеством Lactobacillaceae в биотопе влагалища. Ведь перед назначением курса терапии их концентрация достигала 104 КОЕ, 105 КОЕ и 104 КОЕ соответственно.
У пациенток группы сравнения ситуация, сложившаяся после окончания терапии, была несколько хуже. Несмотря на то, что лечение оказалось эффективным, в 42% (38) наблюдений и так же, как и в основной группе была достигнута эрадикация возбудителей БВ и ВВК, количество Lactobacillaceae в биотопе было снижено в 22% (22) наблюдений и составляло менее 107 КОЕ. Такой результат был для нас неожиданным, так как все препараты, которые получали пациенты, не оказывают на них отрицательного влияния. Единственное разумное объяснение таких обстоятельств, возможно, заключается в специфике иммунного ответа и требует дальнейшего изучения.
В 8% (8) наблюдений у пациенток группы сравнения лечение оказалось не эффективным, рецидив заболевания возник на 12 сутки после отмены препаратов, но был ассоциирован не с Candida krusei, а с Atopobium vaginae. В связи с чем, мы можем утверждать, что 2% клотримазол крем (производное имидазола) позволил добиться излечивания non-albicans кандидоза.
Заключение
Проведенное исследование показало, что применение усовершенствованного производного имидазола способствует исчезновению симптомов воспалительных заболеваний нижних отделов урогенитального тракта уже после однократного применения. Такой эффект связан с формой выпуска лекарственного средства и также свидетельствует о его высокой эффективности при поражениях вульвы. Помимо изложенного выше, необходимо сделать акцент на том факте, что препарат продемонстрировал высокую эффективность в лечении осложненного БВ и non-albicans ВВК, что крайне важно в условиях изменений структуры возбудителей данных заболеваний. Отсутствие негативного влияния препарата на Lactobacillaceae, является его значительным преимуществом перед аналогами, учитывая, что в основе развития заболевания лежат нарушения локального иммунного ответа (рис. 2).
Таким образом, наш опыт применения усовершенствованного производного имидазола показал, что препарат не менее эффективен при воспалительных заболеваниях нижних отделов урогенитального тракта, чем его аналоги. Особенность его формы выпуска, позволяет максимально быстро купировать симптомы заболевания. Лекарственное средство хорошо переносится пациентами. Его применение в лечении осложненных форм БВ и non-albicans ВВК высоко результативно. Отсутствие негативного влияния на количество лактобактерий в биоценозе влагалища добавляет ему только дополнительных преимуществ при лечении БВ И ВВК, специфика течения которых стремительно изменяется.



