Понятие плацентарной недостаточности (ПН) вызывает множество противоречивых вопросов, как с теоретической, так и с практической стороны в современной науке [1, 2]. Многообразие факторов, влияющих на женский организм еще на этапе зачатия приводит к нарушениям имплантации и формирования фетоплацентарного комплекса, отставанию формирования маточно-плацентарного кровообращения, к прерыванию беременности в I триместре, осложнениям гестации, таким как ПН, преждевременная отслойка нормально расположенной плаценты, преэклампсия [3–7]. Дисрегуляция трофобласта предполагает нарушение созревания ворсин, их ишемию, нарушение образования сосудов, проницаемости барьера плаценты, дисбаланс пролиферации клеток, цитокиновых, гормональных, ферментных систем, что ведет к сужению спиральных артерий и ухудшению маточно-плацентарного кровотока, усилению перекисного окисления липидов, повреждению мембран клеток [8–12]. Только полноценный маточно-плацентарный кровоток способен обеспечить необходимый обмен веществ для развития плода, а в случае нарушения инвазии трофобласта запускается каскад вышеперечисленных механизмов и закладываются основы ПН [13].
DcR3 – рецептор-ловушка, ингибирует апоптоз, предоставляя возможность синцитиотрофобласту избегать негативного влияния со стороны иммунных клеток материнского организма [14]. DcR3 хорошо изучен при возникновении аутоиммунных, воспалительных, бронхолегочных, кардиоваскулярных, неврологических заболеваний, болезней почек, доброкачественных и злокачественных опухолей [15–28]. В исследованиях последних лет показано, что уровень DcR3 постепенно снижается от первого к третьему триместру при неосложненной беременности и является максимальным в середине лютеиновой фазы менструального цикла; также наблюдается уменьшение содержания данного показателя при анэмбрионии, преэклампсии (ПЭ) [29].
Изменение содержания DcR3 в I триместре может быть одним из факторов, ведущих к нарушению регуляции апоптоза при беременности, что обусловливает развитие ПН. При этом данные о его системном содержании при привычном невынашивании беременности отсутствуют в литературе. Определение уровня DcR3 в сыворотке крови с целью прогнозирования ПН у беременных ранее не использовалось.
Цель исследования – изучить содержание DcR3 в периферической крови у женщин с угрозой прерывания в I триместре и привычным невынашиванием в анамнезе и у женщин без нарушений репродуктивной функции, на основании чего разработать новый метод прогнозирования ПН.
Материалы и методы
В условиях клиники ФГБУ «НИИ МиД им. В.Н. Городкова» Минздрава России и женских консультаций г. Иваново проведена проспективная оценка течения беременности и перинатальных исходов 75 женщин. Основную группу составили 46 пациенток с угрожающим выкидышем и привычным невынашиванием беременности ранних сроков в анамнезе. Контрольную группу составили 29 женщин с физиологическим течением беременности и неотягощенным репродуктивным анамнезом. Постановка диагноза ПН во второй половине беременности основывалась на данных функциональных методов общепринятой диагностики в 20–24 и 30–32 недели гестации (ультразвуковое исследование (УЗИ) с фетометрией, оценка плодово- и маточно-плацентарного кровотока методом допплерометрии, кардиотокографическое (КТГ) исследование). В исследование были включены пациентки с одноплодной беременностью, угрожающим выкидышем ранних сроков и привычным невынашиванием в анамнезе. Критерии исключения: индуцированная беременность, декомпенсированная соматическая патология, многоплодие. Для исследования содержания DcR3 в I триместре гестации забирали венозную кровь в объеме 3 мл в сухую пробирку до свертывания крови в течение 10–15 мин. Сгусток центрифугировали на протяжении 10 мин. Полученную сыворотку помещали в пробирки типа Эппендорф для хранения при температуре -20 °С. Сывороточное содержание DcR3 определяли иммуноферментным методом (Multiscan EX Labsystems, Finland) с использованием тест-системы (R&D, USA). Анализировали результаты согласно протоколу фирмы-изготовителя.
При статистическом анализе результаты представляли в виде медианы, верхней и нижней квартили для непараметрической статистики (Ме (Q1; Q3)) c использованием непараметрических критериев Вальда–Вольфовица, Колмогорова–Смирнова, Манна–Уитни. При соблюдении нормального распределения данные представляли в виде среднего арифметического (М) и стандартного отклонения (SD) с использованием критерия Стьюдента. Качественные признаки представляли в виде абсолютного числа и относительной величины в процентах с использованием критериев χ2 и Фишера. Использовали расчет относительного риска (ОР), доверительного интервала (ДИ). Различия считали статистически значимыми при р<0,05 (95-й уровень значимости). Для оценки диагностических методов вычисляли и анализировали следующие характеристики: чувствительность, специфичность, прогностическую ценность положительного результата теста, прогностическую ценность отрицательного результата теста, диагностическую точность метода. Чувствительность, специфичность, прогностическая ценность положительного результата и прогностическая ценность отрицательного результата теста были оценены при помощи ROC-анализа с вычислением площади под ROC-кривой (AUC – Area under ROC-curve, пер. с англ.). Диагностическую точность метода рассчитывали по общепринятой формуле как долю истинных результатов среди всех результатов и выражали в процентах. Для статистической обработки использовали Statistica for Windows 10.0, Microsoft Excel 2007, MedCalс и OpenEpi.
Результаты и обсуждение
 Анамнестические, клинические данные и осложнения гестационного периода представлены в табл. 1. Возраст женщин составил 32 (28;34), 26 (24;31) лет (по группам соответственно), р<0,001, однако все пациентки были в пределах репродуктивного возраста (до 40 лет). При анализе связи угрожающего выкидыша и привычного невынашивания были выявлены следующие факторы: возраст, курение (ОР 1,58; 95% ДИ 1,17–2,12), повышенный индекс массы тела (ИМТ), воспалительные заболевания матки (ОР 1,75; 95% ДИ 1,33–2,29), оперативные вмешательства на репродуктивных органах (ОР 1,72; 95% ДИ 1,3–2,25), повышение уровня гликемии плазмы, развитие ПН (ОР 2,47; 95% ДИ 1,66–3,68). При изучении течения гестационного периода выявлено снижение срока родоразрешения в основной группе женщин, р=0,007.
Анамнестические, клинические данные и осложнения гестационного периода представлены в табл. 1. Возраст женщин составил 32 (28;34), 26 (24;31) лет (по группам соответственно), р<0,001, однако все пациентки были в пределах репродуктивного возраста (до 40 лет). При анализе связи угрожающего выкидыша и привычного невынашивания были выявлены следующие факторы: возраст, курение (ОР 1,58; 95% ДИ 1,17–2,12), повышенный индекс массы тела (ИМТ), воспалительные заболевания матки (ОР 1,75; 95% ДИ 1,33–2,29), оперативные вмешательства на репродуктивных органах (ОР 1,72; 95% ДИ 1,3–2,25), повышение уровня гликемии плазмы, развитие ПН (ОР 2,47; 95% ДИ 1,66–3,68). При изучении течения гестационного периода выявлено снижение срока родоразрешения в основной группе женщин, р=0,007.
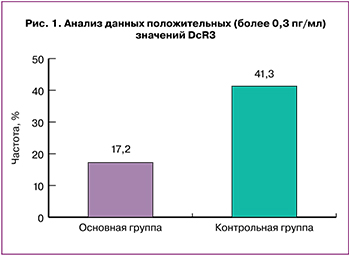
Для более детального изучения сывороточного уровня DcR3 мы проанализировали частоту положительных (более 0,3 пг/мл) результатов данного показателя у женщин исследуемых групп (рис. 1). Уровень содержания 0,3 пг/мл был выбран согласно указаниям фирмы-изготовителя применяемой тест-системы. Положительные значения были выявлены у 41,3% женщин контрольной группы и у 17,2% пациенток основной, р=0,02.
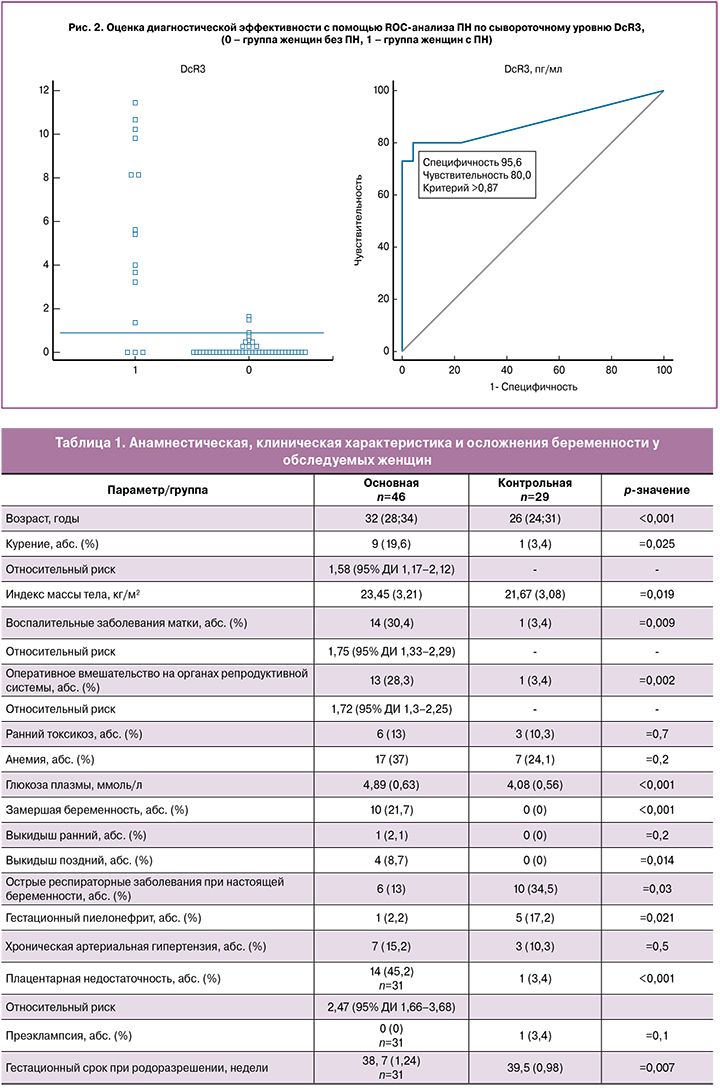
В последующем был проанализирован уровень DcR3 у 60 женщин исследуемых групп, доносивших беременность до 22-недельного гестационного срока. Особого внимания заслуживает анализ связи сывороточного уровня DcR3 с развитием ПН. Установлено, что у исследуемых групп развитие ПН во второй половине гестации было ассоциировано с более высоким уровнем DcR3, по сравнению с женщинами без ПН независимо от наличия у них в анамнезе привычного невынашивания беременности (р<0,001) (табл. 2).
Мы предположили, что уровень содержания DcR3 в сыворотке крови в I триместре гестации может быть использован как прогностический критерий развития ПН во второй половине беременности. Для проверки этого предположения мы провели ретроспективный анализ содержания DcR3 в зависимости от наличия или отсутствия ПН во второй половине беременности у 60 женщин, доносивших беременность до 22-недельного срока. У всех определяли уровень DcR3 в сыворотке крови. У 14 пациенток содержание DcR3 было более 0,87 пг/мл. У 12 из них в последующем наблюдалось развитие ПН во второй половине гестации. У 46 пациенток уровень DcR3 был равен или менее 0,87 пг/мл.

При дальнейшем наблюдении у 43 из них при беременности не наблюдали признаков ПН. При этом ROC-анализ показал хорошую диагностическую ценность при сравнении группы женщин без ПН с группой с ПН – AUC=0,87 (95% ДИ 0,76–0,95). Чувствительность составила 80,0% (95% ДИ 51,9–95,4), специфичность – 95,6% (95% ДИ 84,8–99,3), прогностическая ценность положительного результата – 85,7% (95% ДИ 62,1–97,1), прогностическая ценность отрицательного результата – 93,5% (95% ДИ 86,3–96,9) (рис. 2). Таким образом, оценка сывороточного уровня DcR3 в I триместре позволяет прогнозировать ПН во второй половине беременности. При значениях этого показателя более 0,87 пг/мл точность составила 91,6%.
Преимуществами метода являются: хорошая воспроизводимость, малоинвазивность, доступность выполнения и интерпретации результатов исследования.
Несмотря на накопленные данные, механизмы, лежащие в основе апоптоза плаценты, секреции специфических медиаторов и вазоактивных факторов до конца не расшифрованы. Данное исследование направлено на выявление патологической роли DcR3 и основных механизмов патогенеза данного осложнения гестации.
Апоптоз участвует в процессах имплантации и плацентации: на ранних этапах апоптоз подлежащих клеток эндометрия освобождает место для прикрепления плодного яйца; апоптоз гладкомышечных клеток спиральных артерий обеспечивает достаточный кровоток; обеспечивает трансформацию цитотрофобласта в синцитиотрофобласт, в котором уровень апоптотических процессов выше; а также участвует в формировании фетоматеринской толерантности, блокируя апоптоз-опосредованную цитотоксичность иммунокомпетентных клеток матери по отношению к клеткам трофобласта. Исследования последних лет позволяют говорить о важной роли процессов апоптоза при развитии плаценты, снижение уровня которых приводит к развитию ПН [15, 20].
Рецептор-приманка 3 (DcR3), также известный как член суперсемейства 6b (TNFRSF6B)/TR6 / M68 суперсемейства рецепторов фактора некроза опухолей (TNFR), представляет собой растворимую форму рецептора LIGHT, способный нейтрализовать известные индукторы апоптоза и воспаления, включая лиганд Fas (FasL/CD95L/TNFSF6), LIGHT (TNFSF14) и TNF-подобной молекулы 1A (TL1A/TNFSF15). Этот антиапоптотический растворимый рецептор практически не обнаруживается в непатологических условиях, но может участвовать в подавлении иммунитета и играть важную роль в иммуномодуляции. В дополнение к иммунной регуляции было показано, что DcR3 способствует ангиогенезу путем антагонизма ангиостатических эффектов TL1A на эндотелиальные клетки [29, 30].
LIGHT и его рецепторы экспрессируются на трофобластных и эндотелиальных клетках. Уровень LIGHT значительно повышен в крови и плаценте у женщин с ПЭ, что непосредственно запускает апоптоз в плаценте, секрецию вазоактивных факторов, включая циркулирующую растворимую fms-подобную тирозинкиназу-1 (sFlt-1) и эндотелин-1 (ET-1). Кроме того, экспериментальные данные показывают, что LIGHT-опосредованная активация его рецепторов напрямую индуцирует апоптоз. LIGHT вызывает апоптоз плацентарной ткани и снижение веса плода у беременных мышей [29, 30].
Обнаружено, что LIGHT индуцирует продукцию вазоконстриктивного пептида ET-1 и антиангиогенного фактора sFlt-1, играя важную роль в формировании маточно-плацентарного кровотока. Повышенный уровень циркулирующей растворимой fms-подобной тирозинкиназы-1 (sFlt-1), вероятно, приводит к нарушению плацентации, снижению перфузии матки и плаценты и последующей ПН. DcR3 ингибирует секрецию sFlt-1, индуцированную LIGHT, и процессы апоптоза в плаценте человека [30].
Учитывая вышесказанное, повышение сывороточного содержания DcR3, во-видимому, является ответной реакцией на повышение уровня LIGHT, что приводит к угнетению процессов апоптоза в плаценте, и, как следствие, нарушениям механизмов материнской толерантности, инвазии трофобласта, ремоделирования спиральных артерий, что закладывает основы первичной ПН на ранних сроках и переходящей во вторичную ПН, манифестирующую клиническими проявлениями во второй половине беременности. Проведенное исследование дает убедительные доказательства того, что повышенное сывороточное содержание DcR3 является одним из основных механизмов повреждения плаценты независимо от наличия привычного невынашивания в анамнезе.
Заключение
Таким образом, увеличение уровня DcR3 в сыворотке крови беременных женщин относится к возможным патогенетическим факторам развития ПН. Данный способ позволяет прогнозировать развитие ПН во второй половине гестации еще в I триместре с точностью 91,6% и является перспективным методом диагностики, который позволяет проводить профилактику ПН.



