Работа частично поддержана Государственным контрактом Министерства образования и науки РФ № 16.522.12.2009 от 29.09.2011.
Распространенность хронического эндометрита (ХЭ) в общей популяции женского населения по различным оценкам составляет от 0,8 до 19,0% [1]. Заболевание часто приводит к бесплодию, привычному невынашиванию беременности и преждевременным родам [2]. Полагают, что патогномоничным признаком ХЭ являются перименструальные кровянистые выделения из половых путей [3]. Клинико-лабораторная диагностика сложна и основана на результатах ультразвукового исследования, гистероскопии и морфологического исследования [3–6].
Полагают, что существенная роль в развитии ХЭ принадлежит инфекционным поражениям репродуктивных органов, нарушениям местного и общего иммунитета. В ответ на действие различных микроорганизмов, попадающих во влагалище, цервикальный канал и полость матки, в первую очередь включаются механизмы врожденного иммунитета [6, 7]. Инфекционные агенты, связываясь с толл-рецепторами (TLRs), через свои молекулярные паттерны (липополисахариды, пептидогликаны клеточных стенок и др.) активируют клетки макрофагально-моноцитарного ряда, продуцирующие провоспалительные цитокины (интерлейкины (IL) 1, 6, 8, фактор некроза опухоли (TNF)-α, хемокины и интерфероны (IFN) I типа IFNα/β) [8]. Развивается воспаление, направленное на ликвидацию чужеродных агентов, так называемый классический путь активации иммунокомпетентных клеток, который приводит к повышению бактерицидной активности фагоцитирующих клеток. TLR4 взаимодействует с липополисахаридами клеточных стенок грамотрицательных бактерий, TLR9 – с неметилированными CpG-мотивами бактериальной ДНК, TLR2 – с широким спектром паттернов, включая липопротеины и пептидогликаны клеточных стенок грамположительных и грамотрицательных бактерий [9].
Полагают, что система цитокинов представляет собой полиморфную регуляторную сеть медиаторов, которые играют важную роль не только при воспалении слизистой оболочки матки, но и в регуляции физиологических процессов в эндометрии: пролиферации, имплантации, развитии эмбриона, при менструации, родах и др. Цитокины регулируют процессы взаимодействия иммунокомпетентных клеток и могут отражать интенсивность воспалительного процесса при эндометритах.
Цель данного исследования состояла в определении особенностей экспрессии мРНК генов цитокинов, TLRs и других маркеров иммунокомпетентных клеток в тканях эндометрия при ХЭ.
Материал и методы исследования
В исследование были включены 110 женщин репродуктивного возраста от 18 до 45 лет (средний возраст 32,3±5,5 года), обратившиеся в Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова с различными жалобами (таблица). Из них у 79 пациенток в дальнейшем был подтвержден диагноз ХЭ (I группа). Группу сравнения составила 31 условно здоровая пациентка (II группа). Всем пациенткам выполнено ультразвуковое исследование органов малого таза и гистологическое исследование биоптатов эндометрия с окраской гемотоксилином и эозином. Гистероскопия, диагностическое выскабливание слизистой матки проведены 60 пациенткам; аспирационная биопсия эндометрия с помощью кюретки Pipelle de Cornie – 50. Материал для исследования получали на 7–11-й день менструального цикла.
Определение профиля мРНК генов цитокинов (IL-1B, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12A, IL-12B, IL-18, TNFα, трансформирующего фактора роста (TGFβ)-1, IFNG, фактора, ингибирующего лейкемию (LIF), сосудисто-эндотелиального фактора роста (VEGFA) изоформы 121, 165, 189), транскрипционного фактора FoxP3, α-цепи рецептора IL-2 (IL-2RА) и тол-подобных рецепторов (TLR-2, TLR-4, TLR-9) в ткани эндометрия выполнено методом полимеразной цепной реакции в режиме реального времени с обратной транскрипцией (ОТ-ПЦР) (ДНК-Технология, Россия).
Во избежание деградации РНК взятие материала (аспират ткани эндометрия) осуществляли в пробирки с раствором гуанидинтиоционата (лизирующий раствор наборы «Проба НК»). Осаждение РНК проводили изопропанолом в присутствии соосадителя, с последующими отмывками промывочными растворами. Производитель гарантировал отсутствие амплификации на матрице геномной ДНК цитокинов и референсных генов. Это позволило не использовать дополнительный этап обработки нуклеиновых кислот ДНК-азой. В реакции обратной транскрипции использовали смесь специфических олигонуклеотидов всех исследуемых генов. Амплификацию осуществляли в режиме реального времени с измерением уровня флуоресценции по каналу FAM на каждом цикле при температуре отжига праймеров. Реакцию ставили в двух повторах для каждой точки. Обработка результатов осуществлялась с помощью программы Excel на основании данных, полученных с помощью прибора. Нормировка значения уровня экспрессии осуществлялась по трем референсным генам TBP, B2M, GUSB и значению медианы в контрольной группе (метод сравнения пороговых циклов Δ∆Cq). За 1 было принято значение медианы (Ме) в группе сравнения.
При статистической обработке данных в качестве меры центральной тенденции количественных признаков выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний (L) квартили, так как исследуемые выборки не подчиняются закону нормального распределения. Для оценки значимости межгрупповых различий применялся непараметрический U-критерий Манна–Уитни для количественных признаков. Статистическая обработка проведена с применением пакета прикладных программ SPSS Statistics версии 17.0. Для дискриминации групп использовался многофакторный анализ (бинарная логистическая регрессия), который позволил вычислить вероятность «классификации в группу наличия фиброза эндометрия» (Р) для каждого клинического образца. Для расчета оптимального значения величины порога отсечения Р (точки cut off) использовали ROC-анализ.
Результаты исследования
 Гистологическая верификация ХЭ была основана на современных общепризнанных критериях [4–6]. При одновременном наличии в строме эндометрия очагового фиброза стромы, склеротических изменений стенок спиральных сосудов эндометрия, воспалительных лимфоидных инфильтратов в сочетании с плазматическими клетками ставился диагноз ХЭ (полный симптомокомплекс ХЭ). При выявлении у женщин с клиническими проявлениями ХЭ только одного из вышеперечисленных морфологических признаков имела место неполная форма заболевания.
Гистологическая верификация ХЭ была основана на современных общепризнанных критериях [4–6]. При одновременном наличии в строме эндометрия очагового фиброза стромы, склеротических изменений стенок спиральных сосудов эндометрия, воспалительных лимфоидных инфильтратов в сочетании с плазматическими клетками ставился диагноз ХЭ (полный симптомокомплекс ХЭ). При выявлении у женщин с клиническими проявлениями ХЭ только одного из вышеперечисленных морфологических признаков имела место неполная форма заболевания.
На основе результатов гистологического исследования эндометрия пациентки с ХЭ были разделены на 3 подгруппы: Iа подгруппа – 44 пациента с полным симптомокомплексом ХЭ (55,7%), Ib подгруппа – 20 человек с эндометрием стадии пролиферации с очаговой или рассеянной инфильтрацией стромы лимфоцитами и плазмоцитами (неполная форма ХЭ, 25,3%), Ic подгруппа – 15 пациентов с эндометрием стадии пролиферации с фиброзированием стромы эндометрия (неполная форма ХЭ, 19%), II группа (сравнения) – эндометрий ранней, средней и поздней стадий пролиферации (n=31) (рис. 1 А–Г см. на вклейке).
В группах обследованных больных по возрасту, весу, росту, менархе, количеству родов и абортов статистически значимых различий выявлено не было (р>0,05). Основные причины обращения пациенток представлены в табл.
Пациентки I группы (ХЭ) по сравнению с женщинами II группы чаще предъявляли жалобы по следующим признакам: наличие перименструальных кровянистых выделений и обильных менструаций (р<0,05). У пациенток Iс подгруппы чаще наблюдался гипоменструальный синдром в сравнении со всеми остальными группами.
При наличии полного симптомокомплекса ХЭ (подгруппа Iа) был достоверно повышен уровень экспрессии мРНК следующих цитокинов: IL-1В в 2 (р=0,006), IL-6 в 2,9 (р=0,023), IL-10 в 1,9 (р=0,035), IL-12А в 1,6 (р=0,032), TNFα в 1,8 (р=0,007), TGFβ1 в 1,5 (р=0,012), IL-2Ra в 1,8 (р=0,014), LIF в 2,4 (р=0,009), TLR9 в 2,3 (р=0,05), изоформ VEGFА в 1,5 раза (p<0,05), а также отмечена тенденция к повышению IL-8 в 2,2 (р=0,096), Foxp3 в 1,6 (р=0,062), TLR2 в 1,5 раза (р=0,145) по сравнению со II группой (рис. 2).
Аналогичные изменения были отмечены и при неполной форме ХЭ с лимфоидной инфильтрацией стромы (Ib подгруппа): был достоверно повышен уровень экспрессии мРНК следующих цитокинов: IL-1В в 2 (р=0,008), IL-6 в 2,9 (р=0,029), IL-8 в 2,2 (р=0,043), IL-10 в 1,9 (р=0,014), IL-12А в 1,6 (р=0,019), TNFα в 1,8 (р=0,011), TGFβ1 в 1,5 (р=0,042), FoxP3 в 1,6 (р=0,019), IL-2Ra в 1,8 (р=0,002), LIF в 2,4 (р=0,002), TLR9 в 2,3 (р=0,014), изоформ VEGFА в 1,2-1,7 (p<0.05), TLR2 (р=0,003) в 1,5 раза по сравнению со II группой (рис. 2 см. на вклейке).
Более выраженные изменения в уровне экспрессии мРНК отмечены при неполной форме ХЭ с фиброзом стромы эндометрия (Iс подгруппа): IL-1В в 26 раз (р=9,6×10-8), IL-6 в 16,6 (р=0,0014), IL-8 в 7,9 (р=6,7×10-5), IL-10 в 5,9 (р=4,1×10-6), IL-12А в 4,3 (р=7,4×10-6), TNFα в 16 (р=6,6×10-7), TGFβ1 в 4,7 (р=3,5×10-6), Foxp3 в 2,6 (р=3,5×10-5), IL-2Ra в 2,3 (р=0,025), LIF в 6,3 (р=1,4×10-6), TLR9 в 5 (р=4,3×10-6), изоформы 121 VEGFА в 2,2 (p=0.0018), TLR2 в 2,6 (р=8,3×10-5) раза, а также IL-18 в 3,5 (р=6,3×10-6), IFNG в 2,8 (p=0,0021), TLR4 в 1,7 (р=0,0032) раза по сравнению со II группой (рис. 2, см. на вклейке).
Хроническая активация иммунокомпетентных клеток сопровождается повышенной выработкой цитокинов и других биологически активных веществ, что приводит к нарушению микроциркуляции, экссудации и фиброзу эндометрия. В первую очередь имеет место склерозирование стенок сосудов и образование периваскулярного склероза вокруг спиральных артерий и в базальных отделах эндометрия, что приводит к развитию ишемии эндометрия [10]. Таким образом, фиброз стромы и склероз сосудов эндометрия могут рассматриваться как более тяжелые формы ХЭ, требующие наибольшего внимания. В связи с этим на основании полученных данных проведен регрессионный анализ с целью дискриминировать группу с фиброзом эндометрия.
Уравнение линейной функции имело следующий вид: Z=3,6×ln[IL1B]/[IL2]+5,5×ln[IL10]/[FOXP3]+3,5×ln[TLR9]/[IL2Ra]-10 (формула 1), где [IL1B]/[IL2], [IL10]/[FOXP3], [TLR9]/[IL2Ra] – отношение уровня экспрессии соответствующих маркеров, которое может быть определено напрямую без нормировки на референсные гены.
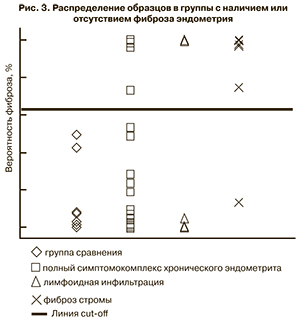
В результате ROC-анализа выбрано значение точки CUT-OF=63%. Площадь по кривой составила AUC=0,995±0,007 (p=6,3×10-7). Чувствительность и специфичность предложенной модели составили 93,3 и 100% соответственно. При значении вероятности более 63% образцы следует рассматривать как наличие фиброза стромы эндометрия.
В соответствии с предложенной статистической моделью все образцы II группы были определены в свою группу. Как образцы с фиброзом эндометрия были определены 12 пациенток (27%) Ia подгруппы, 7 пациенток (35%) – Ib подгруппы и 14 пациенток (93%) Ic подгруппы (рис. 3).
Учитывая разнонаправленный характер синтеза IL-4 и IL-2, был посчитан индекс отношения экспрессии IL-4/IL-2 (рис. 4). В Ib подгруппе данный индекс был достоверно выше и составил Me=0,11 (0,06–0,021), p=0,012) по сравнению с контролем (Me=0,07 (0,03–0,010)). Аналогичная тенденция отмечена и в Ia подгруппе (Me=0,13 (0,04–0,21, p=0,06). Для склерозированного эндометрия
(Ic подгруппа) данная тенденция не подтвердилась (Me=0,10 (0,02–0,16, p=0,61).
Обсуждение
 В результате проведенного исследования установлено, что при ХЭ наблюдаются изменения транскрипционного профиля: по сравнению со II группой повышается экспрессия ряда маркеров: IL-1B, IL-6, IL-8, IL-12А, TNFα, IL-10, TGFβ1, TLR9, LIF, VEGFA; экспрессия IL-2 не изменяется, характерна даже некоторая тенденция к снижению данного маркера (р=0,12, р=0,14 в Ia и Ib подгруппах соответственно). Изменения профиля экспрессии биомаркеров в подгруппе женщин с лимфоидной инфильтрацией стромы лимфоцитами и плазмацитами позволяют рассматривать данную патологию как ХЭ, что согласуется с данными литературы о наличии полного симптомокомплекса и неполной формы ХЭ [5]. Пациенток, у которых в результате гистологического исследования тканей эндометрия выявлена только лишь лимфоидная инфильтрация, можно рассматривать как женщин с ХЭ.
В результате проведенного исследования установлено, что при ХЭ наблюдаются изменения транскрипционного профиля: по сравнению со II группой повышается экспрессия ряда маркеров: IL-1B, IL-6, IL-8, IL-12А, TNFα, IL-10, TGFβ1, TLR9, LIF, VEGFA; экспрессия IL-2 не изменяется, характерна даже некоторая тенденция к снижению данного маркера (р=0,12, р=0,14 в Ia и Ib подгруппах соответственно). Изменения профиля экспрессии биомаркеров в подгруппе женщин с лимфоидной инфильтрацией стромы лимфоцитами и плазмацитами позволяют рассматривать данную патологию как ХЭ, что согласуется с данными литературы о наличии полного симптомокомплекса и неполной формы ХЭ [5]. Пациенток, у которых в результате гистологического исследования тканей эндометрия выявлена только лишь лимфоидная инфильтрация, можно рассматривать как женщин с ХЭ.
Повышение целого ряда цитокинов и отсутствие маркеров, снижающихся при ХЭ в подгруппах Iа и Ib, может быть связано с патогенетическими особенностями ХЭ и клеточными ассоциациями, участвующими в хроническом воспалительном процессе.
Как полагают, наиболее информативным показателем наличия ХЭ является присутствие в строме СD138+ плазматических клеток [11]. Одним из ключевых цитокинов, поддерживающих функциональную активность плазматических клеток, является IL-4. При ХЭ в Ia и Ib подгруппах отмечены тенденции к повышению данного маркера (р=0,068 и р=0,054). Синтезируется IL-4 расположенными по соседству с плазматическими клетками Th2-лимфоцитами. IL-4 активен только в отношении стимулированных антигеном или другими индукторами β-лимфоцитов и способствует выработке плазмоцитами антител класса IgE и IgG4 [12]. Помимо этого IL-4 подавляет Th1-ответ. Возможно, это и определяет некоторое снижение синтеза IL-2 (р=0,12, р=0,14 в Ia и Ib подгруппах соответственно), продуцируемого Th1-лимфоцитами. Учитывая разнонаправленный характер синтеза IL-4 и IL-2, в нашей работе был посчитан индекс отношения экспрессии IL-4/IL-2 (рис. 4).
ХЭ как вариант хронического воспаления неминуемо приводит к склерозу эндометрия за счет пролиферации фибробластов, усиленного синтеза коллагена и компонентов экстрацеллюлярного матрикса. В нашем исследовании мы наблюдали значительное увеличение цитокинового каскада при склерозе эндометрия (Iс подгруппа).
Данные литературы по склерозированию стромы эндометрия очень ограничены, однако патогенез фиброза вне зависимости от места локализации процесса, вероятно, достаточно стереотипен.
Например, TGFβ1 является одним из основных медиаторов формирования фиброза [13]. TGFβ1 – это иммунорегуляторный, профибротический, проапоптотический и просклеротический цитокин, который влияет на функции клеток иммунной системы [14, 15]. Он синтезируется регуляторными Th3 и Tr1-клетками, вызывает усиление экспрессии Foxp3 и дифференцировку естественных Т-регуляторных клеток, тем самым ограничивая активацию клеток иммунной системы, не позволяя воспалительной реакции перейти в гиперергическую фазу [12]. С другой стороны, TGF-β1 стимулирует выработку других ростовых факторов. Факторы роста фибробластов стимулируют избыточную пролиферацию соединительной ткани, а VEGFA способствуют васкуляризации ткани и усиливает сосудистую проницаемость [16].
Другой механизм фиброза может начинаться через активацию TLR9, что было доказано для пациентов, склонных к быстро прогрессирующему идиопатическому фиброзу легких. Экспрессия белка TLR9 в иммунокомпетентных клетках данных пациентов была существенно выше, чем при медленно прогрессирующих формах и в нормальной ткани, что согласуется с нашими данными. Культуры клеток фибробластов, полученных из материала биопсии данных пациентов, на стимуляцию синтетическими CpG-олигонуклеотидами (CpG-ODN) реагировали и синтезировали целый ряд хемокинов, часть из которых является мощным профибротическим посредником в легких [17].
ХЭ со склерозированием сосудов и фиброзом стромы эндометрия характеризуется существенным повышением целого ряда маркеров: IL-1B, TLR9, IL-10, IL-6, IL-8, TNFα, TGF-β1. Уровень повышения других маркеров менее значителен (например, Foxp3, IL2Ra), либо не меняется вовсе (IL-2). Фактически в Iс подгруппе возникает ряд дисбалансов: с одной стороны, провоспалительных цитокинов, TLR9, регуляторных IL-10, TGF-β1, c другой стороны, IL-2 и иммуносупрессорных естественных Т-регуляторных клеток (транскрипционный фактор Foxp3 (скурфин) и α-цепь рецептора IL-2, без которой невозможно формирование высокоафинного рецептора СD25high). Естественные Т-регуляторные клетки, таким образом, тоже могут играть существенную роль в фиброзировании стромы эндометрия. Как известно, механизм их действия может быть либо прямым (непосредственный контакт между клетками), либо дистантным (посредством выработки иммуносупрессорных факторов Foxp3, IL-10 и TGF-β1). Мишенями действия Тreg клеток являются Т-эффекторные клетки (Т-хелперы и Т-цитотоксические лимфоциты) и дендритные клетки, ответственные за презентацию антигена и активацию Т-клеток. При прямом механизме супрессии Treg взаимодействуют с эффекторными Т-клетками, выделяют гранзим B, который вызывает апоптоз в этих клетках, тем самым элиминируя активные Т-клетки. Тreg-клетки, взаимодействуя с рецептором CD86 на дендритных клетках при помощи CTLA-4, блокируют активацию Т-клеток дендритными клетками. При дистантном механизме транскрипционный фактор Foxp3 регулирует транскрипцию генов, а TGF-β1 связывается со своими рецепторами на поверхности Т-эффекторных клеток и ингибирует их активацию. Важным механизмом также служит захват IL-2 при помощи CD25high и секвестрация рецептора у эффекторных Т-клеток [18]. Как известно, IL-2 является основным аутокринным стимулирующим фактором, поддерживающим дифференцировку и клональную пролиферацию Т-клеток [12].
Возможно, дисбаланс IL-1B/IL-2, IL-10/FOXP3 и TLR9/IL-2Ra в какой-то степени отражают физиологические процессы, протекающие в строме эндометрия при склерозе, и могут быть использованы для прогноза наиболее тяжелых форм ХЭ.
При фиброзировании стромы эндометрия помимо активации по классическому провоспалительному I типу, сопровождающемуся экспрессией целого ряда цитокинов (IL-1B, IL-6, IL-8, TNFα, IL-12), осуществляется активация и по II типу, которая приводит к повышению экспрессии иммуносупрессорных IL-10, TGF-β1 [19]. Данный иммуносупрессорный путь активации иммунокомпетентных клеток направлен на контроль воспалительной реакции и предотвращение гиперергии, а так же ликвидацию повреждений.
Заключение
Таким образом, ХЭ может быть представлен 3 морфологическими вариантами: полный симптомокомплекс ХЭ, неполная форма ХЭ с очаговой или рассеянной инфильтрацией стромы лимфоцитами и плазмоцитами, неполная форма ХЭ с фиброзирование стромы эндометрия, что подтверждается данными по экспрессии мРНК генов биомаркеров. При ХЭ повышается экспрессия мРНК генов IL-1B, IL-6, IL-8, IL-12А, TNFα, IL-10, TGF-β1, TLR9, LIF, VEGFA. Склерозирование сосудов и фиброз стромы эндометрия может считаться одним из важнейших признаков ХЭ, что сопровождается «цитокиновым всплеском»: увеличением в 5–10 и более раз уровня экспрессии мРНК генов IL-1В, IL-6, IL-8, IL-10, TNFα, TGF-β1, TLR9, LIF по сравнению с II группой (группа сравнения). По трем индексам отношения экспрессии генов: IL-1B/IL-2, IL-10/Foxp3, TLR9/IL2Ra предложен способ определения степени тяжести ХЭ, который гистологически ассоциирован с фиброзированием стромы эндометрия. Чувствительность и специфичность данного метода для обучающей выборки составила 93,3 и 100% соответственно.




