Снижение уровней эстрогенов в перименопаузе способствует формированию приливов [1], приводит к нарушениям метаболизма костной и жировой ткани. Сочетанные микронутриентные дефициты усугубляют последствия снижения эстрогенов и способствуют формированию хронического воспаления [2]. Как следствие, в период постменопаузы манифестируют остеопороз, ожирение, сахарный диабет, сердечно-сосудистые заболевания.
Недостаточность витамина D (определяемая как уровень 25(OH)D в сыворотке крови менее 30 нг/мл) встречается у 80% женщин репродуктивного возраста и почти у 90% женщин в период постменопаузы [3]. Наиболее частым последствием недостаточности витамина D является остеопороз. В России среди лиц в возрасте 50 лет и старше остеопороз выявляется у 34% женщин и 27% мужчин, а частота остеопении составляет 43 и 44% соответственно [4]. 20 млн людей имеют снижение минеральной плотности костной ткани (МПК), соответствующее остеопении [5].
Коморбидные патологии существенно отягощают течение остеопороза: например, на фоне сахарного диабета 2-го типа (СД2) отмечается более агрессивное течение остеопороза. Сочетание СД2 и неалкогольной жировой болезни печени (НАЖБП) достоверно ассоциировано со сниженным метаболизмом кости, остеопенией и остеопорозом [6].
В настоящей работе представлены результаты систематического анализа научной литературы по вопросу взаимосвязи между обеспеченностью витамином D и патологическими состояниями женщины в период перименопаузы. По запросу «(vitamin D OR vitamin D3 OR 25(OH)D OR cholecalciferol OR VITD OR HYDROXYVITAMIN) AND (menopause OR menopausal)» в базе данных биомедицинских публикаций PUBMED найдено 1190 ссылок. Мы осуществили компьютеризованный анализ данного массива публикаций с использованием современных методов анализа больших данных [7, 8], развиваемых в рамках топологического [9] и метрического [10, 11] подходов к задачам распознавания/классификации [12] и выделили в этом массиве публикаций 710 результативных исследований. Напомним, что результативными называются клинические исследования, в которых представлены клинически значимые результаты и отсутствуют грубые нарушения в процедурах анализа данных [13].
В ходе систематического анализа литературы были определены наиболее информативные ключевые слова, отличающие публикации по взаимосвязи недостаточности витамина D и патологий в постменопаузе от контрольной выборки публикаций. В качестве контрольной выборки использовались 710 случайно выбранных статей из 38 100 найденных по запросу «(vitamin D OR vitamin D3 OR 25(OH)D OR cholecalciferol OR VITD OR HYDROXYVITAMIN) NOT menopause NOT menopausal» в базе данных PUBMED, т.е. исследования витамина D, не имеющие отношения к наступлению менопаузы. В результате проведенного анализа текстов были отобраны наиболее информативные ключевые слова, описывающие взаимоотношения между недостаточной обеспеченностью витамином D и патологиями в менопаузе (табл. 1).
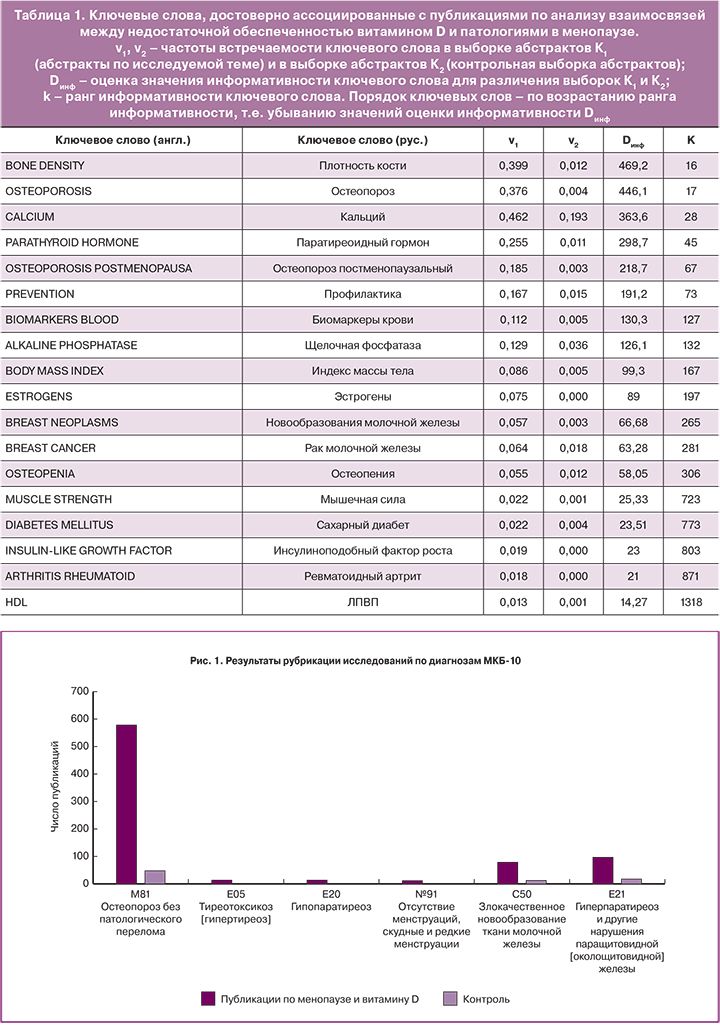
Анализ полученного списка наиболее информативных ключевых слов (см. табл. 1) показал, что недостаточная обеспеченность витамином D в период пери- и постменопаузы способствует не только формированию нарушений метаболизма кости. Недостаточность витамина D также ассоциирована с развитием метаболического синдрома, новообразований молочной железы, потери силы мышц и саркопении, ревматоидного артрита и нарушений липидного профиля.
Дальнейший анализ информативных ключевых слов с последующей рубрикацией исследований по диагнозам МКБ-10 показал, что недостаточность витамина D в постменопаузе наиболее часто ассоциируется с диагнозами: Остеопороз без патологического перелома (M81), Тиреотоксикоз (E05), Гипопаратиреоз (E20), Гиперпаратиреоз (E21)и другие нарушения паращитовидной железы, Злокачественное новообразование ткани молочной железы (C50) (рис. 1).
Далее последовательно рассмотрены взаимосвязи между недостаточностью витамина D и остеопорозом, риском формирования опухолей молочной железы, риском развития метаболического синдрома и сахарного диабета в период постменопаузы.
Постменопауза, остеопороз, недостаточность витамина D
Риск остеопороза у женщин в постменопаузе зависит от возраста наступления менопаузы, индекса массы тела (ИМТ) и потребления алкоголя [14]. Курение до наступления менопаузы является фактором риска остеопороза у женщин в постменопаузе и ассоциировано со сниженными уровнями 25(OH) D [15]. В когортах постменопаузальных пациенток с остеопорозом уровни 25(ОН)D<20 нг/мл отмечены у 70% пациенток с переломами в анамнезе [16]. Сниженные уровни 25(OH)D соответствуют повышенным уровням маркера резорбции кости щелочной фосфатазы и паратиреоидного гормона (ПТГ) [17].
В исследовании здоровых женщин в постменопаузе, получающих дотации витамина D, самыми сильными предикторами пониженных концентраций 25(OH)D в крови были: (1) недостаточная суточная доза холекальциферола; (2) потребление алкоголя; (3) короткое время пребывания на открытом воздухе; (4) использование солнцезащитных средств для кожи. Данный набор предикторов ассоциирован с 46–47% вариацией концентраций 25(OH)D в кросс-валидации [18].
В рандомизированном исследовании было показано, что прием холекальциферола в дозе 2000 МЕ/сут в течение 20 недель способствовал усилению ремоделирования костной ткани у взрослых с недостаточностью витамина D3 (25(ОН)D3<20 нг/мл (выраженный дефицит – менее 10, согласно рекомендациям по витамину D), n=448). Дотации холекальциферола были ассоциированы с положительными изменениями уровня щелочной фосфатазы, N-концевого пропептида коллагена I типа и тартратрезистентной кислой фосфатазы 5b (TRAP5b) в сыворотке крови (r=0,07–0,16, p<0,02), но обратно пропорциональны изменениям уровням ПТГ (r=-0,15, p<0,001). Достижение порога концентраций 25(ОН)D3≥50 нг/мл было ассоциировано с бо́льшим увеличением уровней C-концевого телопептида β-изомеризованного коллагена I типа (β-CTX) в сыворотке крови (224%, остальные – 146%; p=0,02) и уровней TRAP5b (Tartrate-resistant acid phosphatase 5b, тестируемый маркер снижения резорбции кости – 22,2%, остальные – 9,1%, p=0,007) [19]. Это свидетельствует об ускорении восстановления костной ткани (β-CTX), снижении резорбции и риска периостита (TRAP5b).
Метаанализ 8 рандомизированных исследований показал, что прием даже 800 МЕ/сут холекальциферола женщинами в постменопаузе (n=6089) предотвращает переломы лучше, чем плацебо (n=6569). Добавление витамина D снизило частоту переломов позвонков (ОР 0,77; 95% 0,6–0,93) и переломов бедра (ОР 0,70; 95% ДИ 0,53–0,90). По сравнению с дотациями только кальция, дотации кальция и витамина D уменьшали риск переломов позвонков (OR 0,68; 95% ДИ 0,43–1,01) и других переломов, за исключением переломов бедренной кости (OR 0,64; 95% ДИ 0,38–0,99) [20]. Таким образом, дозы витамина D соответствующие суточной потребности женщин в период постменопаузы способствуют повышению эффективности профилактики остеопороза с использованием препаратов кальция (рис. 2).

Недостаточность витамина D и риск формирования опухолей молочной железы в постменопаузе
Уровни 25(ОН)D при раке молочной железы (n=691) достоверно ниже, чем у здоровых женщин (в среднем на -4,84 нг/мл; 95% ДИ -6,56…-3,12 нг/мл, р<0,001) [21]. Исследование взаимосвязи между уровнями 25(OH)D в сыворотке крови и характеристиками опухолей молочной железы у женщин в постменопаузе показало, что более низкие уровни 25(OH)D сопровождают более тяжелые стадии рака молочной железы [22].
Низкие уровни 25(OH)D в сыворотке крови ассоциированы с более агрессивными вариантами рака молочной железы (n=78). Средние уровни витамина D в сыворотке крови были значительно ниже по сравнению с контролем (22,33±8,19 против 37,41±12,9 нг/мл; р=0,0001). Пациентки с приемлемыми значениями прогностического индекса Ноттингема NPI характеризовались более высокими уровнями 25(OH)D, чем пациенты с менее благоприятными значениями индекса NPI [23].
Другие исследователи подтвердили, что недостаточность витамина D (25(OH)D<30 нг/мл) ассоциирована с ухудшением прогноза рака молочной железы у женщин 45–75 лет в постменопаузе (n=192). Недостаточные уровни витамина D были обнаружены у 67% обследованных женщин. Участницы с недостаточностью или дефицитом витамина D характеризовались более высокой частотой встречаемости опухолей III–IV стадии с метастазированием, а также более низкой долей ER-, PR-положительных опухолей и более высоким процентом опухолей с наличием маркера Ki-67 (p<0,05) [24]. Важно отметить, что в этом исследовании все случаи «тройного негативного» рака молочной железы были выявлены именно у пациенток со сниженными уровнями 25(OH)D. Трижды рецептор-негативный рак молочной железы характеризуется отсутствием экспрессии генов рецептора эстрогена (ER), рецептора прогестерона (PR) и гена HER2/neu. Такая форма рака затрудняет лечение, так как большинство схем лечения нацелены на один из этих трех рецепторов. Соответственно, для «трижды негативного» рака требуются более сложная комбинированная химиотерапия и дотации витамина D [24].
Метаанализ 14 проспективных исследований пациенток с опухолями молочной железы (n=9110) по сравнению с контролем (n=16244) показал, что уровни 25(OH)D в сыворотке крови более 30 нг/мл были достоверно ассоциированы со снижением риска развития рака молочной железы на 15% (ОР 0,85; 95% ДИ 0,75–0,95). При этом увеличение концентрации 25(OH)D на каждые 10 нг/мл соответствовало достоверному снижению риска рака молочной железы на 3,2% [25]. Таким образом, достаточная обеспеченность витамином D – фактор снижения риска рака молочной железы, а для пациенток с уже установленным диагнозом улучшает прогноз заболевания и ответ на химиотерапию.
Недостаточность витамина D и риск развития метаболического синдрома и сахарного диабета в постменопаузе
Повышенный ИМТ является сильным предиктором низкой обеспеченности витамином D у женщин независимо от возраста (18–80 лет). В группе женщин, страдающих ожирением, средние значения витамина D были достоверно ниже, чем в группе с избыточной массой тела, часто достигая состояния дефицита витамина D (<10 нг/мл) как зимой, так и летом. Ассоциация между ИМТ и концентрацией 25(OH)D в крови была намного сильнее, чем взаимосвязь между концентрациями 25(OH)D и изменениями инсоляции в разные сезоны года [26]. В исследовании женщин в постменопаузе (n=609) наиболее информативными предикторами для выявления недостаточности витамина D (<30 нг/мл) были повышенный ИМТ, длительное (в течение года) сохранение загара кожи, низкий уровень инсоляции в течение последних 3 месяцев, использование солнцезащитного крема и недостаточное дополнительное потребление витамина D [27].
Недостаточность витамина D (25(OH)D<30 нг/мл) ассоциирована с повышенным риском метаболического синдрома у женщин в постменопаузе (n=463, 45–75 лет), которые не получают дотаций витамина D и не имеют сердечно-сосудистой патологии в анамнезе [28]. Авторы показали, что недостаточность витамина D соответствует повышению риска метаболического синдрома на 90% (ОР 1,90; 95% ДИ 1,26–2,85), гипертриглицеридемии (ОР 1,55; 95% ДИ 1,13-2,35) и сниженных уровней ЛПВП (ОР 1,60; 95% ДИ 1,19–2,40) (р<0,05) по сравнению с женщинами с достаточным уровнем 25(OH)D. Установленные ассоциации сохранялись после поправок на возраст, время после наступления менопаузы, ИМТ, курение и физическую активность [28].
В кросс-секционном (поперечном) исследовании женщин в возрасте от 35 до 74 лет (n=680) более высокие уровни 25(OH)D в крови были ассоциированы с более низким уровнем глюкозы в крови. В частности, уровень 25(OH)D<30 нг/мл был связан с уровнем глюкозы в крови более 100 мг/дл (ОР 1,29; 95% ДИ 1,05–1,57) [29]. Прием витамина D в дозе 2500 МЕ/сут в течение 6 недель на фоне диеты с ограничением калорийности у здоровых женщин с повышенной массой тела в постменопаузе достоверно улучшал чувствительность к инсулину (р<0,05) [30].
Недостаточность витамина D и другие патологические состояния женщин в постменопаузе
Исследователи F. Gimigliano и соавт. (2018) показали, что сочетание дефицита витамина D и избыточного веса способствует потере мышечной массы (саркопении) и функции скелетных мышц у женщин в постменопаузе (n=368, возраст 67,2±7,8 года) [31]. Женщины с избыточным весом и гиповитаминозом D имели существенно более высокий риск снижения мышечной массы (ОР 5,70), силы сжатия (ОР 12,05) и работоспособности (ОР 5,84) по сравнению с контрольной группой (p<0,001 во всех случаях). Женщины с нормальным весом и гиповитаминозом D характеризовались более высоким риском снижения мышечной силы (ОШ 7,30; р<0,001) и работоспособности (ОШ 3,16; р<0,001), однако риск саркопении у них не повышался [31]. Дотации холекальциферола (1000 МЕ/сут, 9 месяцев) женщинам в постменопаузе снижают риск потери равновесия тела и падения [32].
По данным Y. Hao и соавт. (2015), более низкие уровни 25(OH)D в сыворотке крови достоверно ассоциированы (p<0,001) с большей толщиной интима-медиа сонных артерий у женщин в постменопаузе (n=926). Установленная корреляция была также достоверна в подгруппе женщин с нормальным уровнем глюкозы и с нормальными значениями артериального давления, ИМТ и показателей липидного профиля (p=0,018) [33]. В 16-летнем долговременном исследовании дефицит витамина D у здоровых женщин в постменопаузе (n=2016) являлся предиктором сердечно-сосудистых заболеваний. У женщин с дефицитом витамина D (25(OH)D<20 нг/мл, n=788) определялись повышенные значения ИМТ, повышенные уровни триглицеридов на фоне более низкого уровня ЛПВП в крови; чаще отмечался фактор курения. Риск сердечно-сосудистых заболеваний был на 49% выше в группе женщин с дефицитом витамина D (ОР 1,49; 95% ДИ 1,16–1,92; p=0,002) [34].
 Сухой кератоконъюнктивит (так называемый синдром «сухого глаза») в постменопаузе и нарушение выработки слезной жидкости чаще встречаются у пациенток с дефицитом витамина D (<20 нг/мл), так как витамин D способствует улучшению биохимических и иммунологических показателей слезы, поверхностного натяжения слезной пленки, меньшему испарению слезы, уменьшению активности хронического неспецифического воспаления роговой оболочки глаза [35]. На фоне недостаточности витамина D снижается выработка не только слезы, но и слюны. Дефицит витамина D приводит к сухости во рту за счет уменьшения секреции слюны околоушными железами. Пилокарпинстимулируемый поток слюны снижается на 57% на фоне дефицита витамина D (рис. 3), хотя секреция амилазы не изменилась. Было установлено, что нарушение секреции возникало не вследствие вторичных причин (гипокальциемия, гиперпаратиреоз), а являлось прямым следствием дефицита витамина D. Дотации витамина D3 нормализовали уровни секреции слюны [36]. Нормализация слюноотделения витамином D имеет важное значение для всасывания многих микронутриентов (в частности, кальция и самого витамина D, цинка, магния, витамина С, витамина K и др.), начиная с ротовой полости [3].
Сухой кератоконъюнктивит (так называемый синдром «сухого глаза») в постменопаузе и нарушение выработки слезной жидкости чаще встречаются у пациенток с дефицитом витамина D (<20 нг/мл), так как витамин D способствует улучшению биохимических и иммунологических показателей слезы, поверхностного натяжения слезной пленки, меньшему испарению слезы, уменьшению активности хронического неспецифического воспаления роговой оболочки глаза [35]. На фоне недостаточности витамина D снижается выработка не только слезы, но и слюны. Дефицит витамина D приводит к сухости во рту за счет уменьшения секреции слюны околоушными железами. Пилокарпинстимулируемый поток слюны снижается на 57% на фоне дефицита витамина D (рис. 3), хотя секреция амилазы не изменилась. Было установлено, что нарушение секреции возникало не вследствие вторичных причин (гипокальциемия, гиперпаратиреоз), а являлось прямым следствием дефицита витамина D. Дотации витамина D3 нормализовали уровни секреции слюны [36]. Нормализация слюноотделения витамином D имеет важное значение для всасывания многих микронутриентов (в частности, кальция и самого витамина D, цинка, магния, витамина С, витамина K и др.), начиная с ротовой полости [3].
Дотации высоких доз витамина D (40 000 МЕ/нед) также предотвращают недержание мочи в постменопаузе вследствие атонии уретры и мочеточников (р<0,05) [37].
Доза витамина D для профилактики остеопороза и коморбидных патологических состояний у женщин в перименопаузе
Результаты крупномасштабных клинических исследований за последние 10 лет показали, что дотации холекальциферола в диапазоне доз 2000–4000 МЕ/сут приводят к более эффективному повышению уровней 25(ОН)D в крови пациента до нормативных параметров/показателей/концентраций [38]. Метаанализ 28 рандомизированных исследований показал, что дотации витамина D в дозах более 2000 МЕ/сут эффективны для снижения резистентности к инсулину [39] и уровней гликированного гемоглобина HbA1c [40].
Метаанализы рандомизированных исследований показали, что дотации холекальциферола в диапазоне доз 2000–4000 МЕ/сут значительно уменьшали уровень С-реактивного белка [41], приводили к снижению потребности в антибиотиках [42], уменьшению боли, возникающей при остеоартрите коленного сустава [43], способствовали повышению силы мышц верхних и нижних конечностей [44].
Коррекцию недостаточности витамина D можно проводить с помощью Детримакс витамин D3, содержащего 1000 МЕ холекальциферола в 1 таблетке. Детримакс витамин D3 имеет удобную форму выпуска: таблетки позволяют точно дозировать и восполнять дефицит витамина D3 в организме [45].
Для профилактики гиповитаминоза D при уровне 25(ОН)D 20–30 нг/мл следует принимать витамин D в дозах 1000–2000 МЕ/сут или 6000–14 000 МЕ/нед [46]. При ожирении, синдроме мальабсорбции, приеме лекарственных средств, влияющих на метаболизм витамина D, – 4000–6000 МЕ/сут. Профилактическая доза витамина D – 1000–2000 МЕ/сут – может применяться в течение достаточно длительных интервалов времени (6 месяцев и более) [47, 48].
Важной особенностью использования дозировок холекальциферола в диапазоне 2000–4000 МЕ/сут является более выраженный отклик уровней 25(ОН)D3 в крови пациента [49, 50]. Например, рандомизированное исследование с участием пожилых добровольцев 25(ОН)D3 старше 65 лет (n=305) показало выраженные дозозависимые эффекты дотаций холекальциферола на уровни 25(ОН)D3 в крови. На момент начала исследования уровни 25(ОН)D3 составили 20±7 нг/мл. Через 12 месяцев приема витамина D уровни 25(ОН)D3 увеличились до 54,8±15,6 нг/мл (в группе принимавших 4000 МЕ/сут) и до 40±10 нг/мл (в группе принимавших 2000 МЕ/сут) [49]. При этом уровня 25(ОН)D3 более 30 нг/мл достигли 92% пациентов в группе принимавших 4000 МЕ/сут и только 74% – в группе принимавших 2000 МЕ/сут холекальциферола. Ни та, ни другая доза витамина D3 не ассоциировались со значительными отклонениями уровней кальция или ПТГ от диапазона нормы [50].
Через 3–6 месяцев обычно удается достичь концентрации 25(OH)D порядка 50–75 нг/мл, после чего рекомендуется перейти на прием холекальциферола в дозе 1000–2000 МЕ с целью профилактики остеопороза и других коморбидных патологий в постменопаузе. Длительность курса Детримакс витамин D3 и дозировку определяет врач по клиническим и лабораторным критериям (определение концентрации 25(OH)D в крови через 3 и 6 месяцев после начала лечения).
Заключение
Недостаточность витамина D в пери- и постменопаузе является одной из причин развития остеопороза вследствие нарушения кальций-фосфорного обмена в костной ткани. Внекостные проявления недостаточности витамина D сопряжены с повышением хронического воспаления, развитием инсулинорезистентности и сахарного диабета, которые, в свою очередь, усиливают деградацию костной ткани. Систематический анализ результатов 1190 клинических и экспериментальных исследований позволил установить сложные взаимодействия между недостаточностью витамина D, остеопорозом, саркопенией, метаболическим синдромом и новообразованиями молочной железы в период постменопаузы. Адекватные дотации витамина D (2000–4000 МЕ/сут) в период постменопаузы будут восполнять недостаточность витамина D у женщин, способствуя профилактике этих коморбидных патологических состояний.



