Демографические показатели России, так же, как и всего мира, требуют повышенного внимания к населению средней и старшей возрастной групп в связи с увеличением продолжительности жизни и ростом заболеваний, связанных с биологическим старением [1].
Выделение в классификации МКБ-11 нового пункта «aging related disease», к которому, в том числе, будут относиться заболевания, связанные со старением и, в том числе, с возрастным ухудшением когнитивной функции, диктуют необходимость поиска новых решений [2, 3].
Ежегодно миллионы женщин вступают в менопаузу [4]. В Российской Федерации (РФ) в настоящее время более 30 млн женщин старше 45 лет. Средний возраст наступления менопаузы у женщин в РФ составляет 51 год (абсолютное большинство женщин проходит этот период в возрасте 45–55 лет) [5]. Поскольку продолжительность жизни женщин значительно возросла за последние 50 лет и будет увеличиваться, то практически треть своей жизни женщины будут проводить в постменопаузе [6, 7]. Целесообразно возникает потребность ответить на вопросы: как предотвратить, выявить и вовремя остановить менопаузальные симптомы, последствия эндотелиальной дисфункции, утрату ментальных способностей и сохранить психоэмоциональное равновесие в турбулентный период жизни каждой женщины.
Своевременное назначение менопаузальной гормональной терапии (МГТ) имеет ключевое значение в профилактике заболеваний, ассоциированных с менопаузой. Показано, что своевременно и грамотно назначенная МГТ может предотвратить вазомоторные симптомы в 75% случаев [8], снизить риски перелома шейки бедра на 30% [9], развития сахарного диабета – на 30% [10]; сердечно-сосудистую смертность – на 12–54% [11], общую смертность – на 31% у женщин в возрасте 50–59 лет [12]. По данным многоцентровых проспективных исследований, именно ранний старт МГТ положительно влияет на исходы ССЗ [13]. Возникновение первичных признаков когнитивной дисфункции и психоэмоциональных расстройств также четко ассоциировано со снижением уровней половых стероидов в женском организме [14, 15].
Эти данные позволяют рассматривать период менопаузального перехода как наиболее подходящий временной интервал для начала терапии, которая способна предотвратить ухудшения, своевременно остановить прогрессирование менопаузальных симптомов, ментальной и психоэмоциональной дисфункций [16].
Вопросы персонализации МГТ с учетом индивидуальных предпочтений и нужд пациенток для эффективного устранения менопаузальных симптомов в настоящее время привлекают центральное внимание.
Цель исследования: оптимизация профилактических и терапевтических мероприятий, направленных на уменьшение тяжести менопаузальных симптомов, сохранность когнитивной функции для повышения качества жизни женщин в перименопаузе.
Материалы и методы
В нашем исследовании участвовали 120 женщин перименопаузального периода в возрасте от 40 до 50 лет с признаками гипоэстрогении.
Все пациентки были разделены на 4 клинические группы. В 1-ю были включены 30 пациенток, получавших системную МГТ, содержащую дидрогестерон 10 мг и эстрадиол 1 мг в циклическом режиме; 2-ю группу составили 30 пациенток, которые получали дидрогестерон 10 мг и эстрадиол 1 мг в циклическом режиме в комбинации с негормональным препаратом полипептидов эпифиза (шишковидной железы) крупного рогатого скота; 30 пациенток 3-й группы получали МГТ препаратами 0,06% трансдермального геля 17-β эстрадиола в циклическом режиме и левоноргестрел-высвобождающую внутриматочную систему (ЛНГ-ВМС) 52 мг; 4-я группа из 30 пациенток – контрольная – не получала лечения.
Всем участникам проводились общеклиническое обследование для первичной оценки состояния здоровья, оценка исходных показателей климактерической шкалы Грина, шкалы депрессии Бека, МоСа-теста когнитивных функций и лабораторных уровней фактора роста нервов, с последующим динамическим контролем указанных показателей на 180-й (через 6 месяцев) и 360-й дни (через 12 месяцев) наблюдения.
Менопаузальная шкала Грина [17]. Климактерическая шкала Грина включает в себя 21 симптом-вопрос для оценки эмоционально-психического состояния (1–11 вопросы), соматических проявлений (12–18), вазомоторного статуса (19–20) и сексуального статуса (21-й вопрос). На каждый из них имелось 4 варианта ответа: симптомы вовсе не беспокоят – 0, слегка беспокоят – 1, беспокоят достаточно сильно – 2, крайне выражены – 3 балла. Дополнительно с целью контроля безопасности проводимой терапии на всем протяжении лечения исследовали показатели гемостаза.
MoCA-тест (Монреальская шкала оценки когнитивных функций) [18]. Разработана для быстрого скрининга мягких когнитивных нарушений, оценки внимания и концентрации, исполнительных функций, памяти, речи, оптико-пространственной деятельности, концептуального мышления, счета и ориентированности. Продолжительность теста – приблизительно 10 минут. Выполняемые задания: черчение ломаной линии, оптико-пространственная деятельность (часы), повторение названий для оценки памяти, последовательное вычитание по 7, повторение предложений, скорость, абстрактное мышление, отсроченное воспроизведение, ориентировка во времени и пространстве. К полученной сумме добавляют один балл, если обследуемый имеет среднее образование. Шкала валидирована в Российской Федерации. Максимальное количество баллов – 30. В норме количество баллов – 26 и выше.
Шкала депрессии Бека (Beck Depression Inventory) [19]. Содержит 21 категорию симптомов и жалоб, наиболее часто встречающихся при депрессии. Каждая категория состоит из 4–5 утверждений, распределенных с учетом значимости вклада определяемых показателей в общую степень тяжести. Опросник заполняется пациенткой самостоятельно. Каждый пункт категории шкалы оценивается от 0 до 3 баллов, суммарный балл составляет от 0 до 62. Когнитивно-аффективные проявления депрессии: пункты 1–13, соматические проявления депрессии – 14–21. Анализ результатов теста: 0–9 – отсутствие депрессивных симптомов; 10–15 – легкая депрессия (субклиническая депрессия); 16–19 – умеренная; 20–29 – выраженная (средней тяжести); 30–63 – тяжелая.
Статистический анализ
Статистическую обработку проводили с использованием пакета SPSS 21.0 for Windows. Качественные переменные были представлены частотами встречаемости (%), для количественных переменных определяли среднее арифметическое и среднеквадратическое отклонение (M±SD).
Результаты и обсуждение
Анализ представленных в таблице 1 показателей продемонстрировал репрезентативность исходных данных во всех группах, на 180-й и 360-й день наблюдения отмечалось улучшение показателей шкалы Грина, свидетельствующее о снижении тяжести климактерических проявлений во всех группах, за исключением контрольной (без терапии).
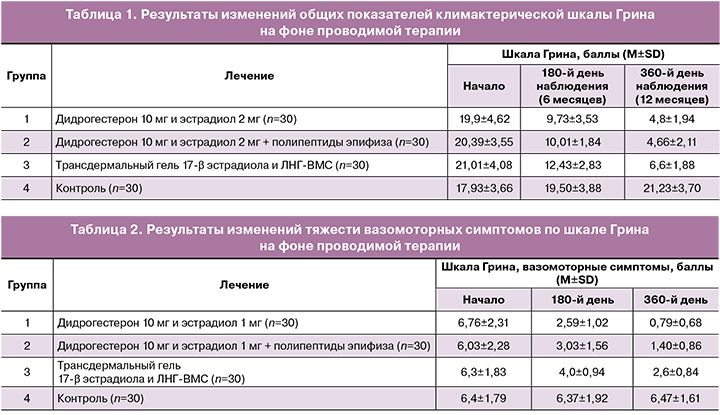
В 1-й группе через 6 месяцев значение показателей шкалы Грина составило 9,73±3,53 (снижение на 51,1% от исходного уровня), а через 12 месяцев – 4,8±1,94 (снижение на 75,8% от исходного уровня). Во 2-й группе пациенток – через 6 месяцев показатели шкалы Грина составили 10,01±1,84 vs 20,39±3,55 (снижение на 50,3%), через 12 месяцев – 4,66±2,11 (снижение на 76,6%).
Таким образом, общие результаты по климактерической шкале Грина были сопоставимы в 1-й и 2-й группах, но превосходили результаты, продемонстрированные пациентами 3-й группы. Через 6 и 12 месяцев терапии было отмечено снижение на 37,5% (12,43±2,83) и 68,59% (6,6±1,88) соответственно. В контрольной группе, не получавшей лечения в течение 360 дней, отмечалось усугубление тяжести климактерического синдрома на 18,4%.
При сравнительном анализе эффективности различных форм МГТ на динамику выраженности вазомоторных симптомов было выявлено значительное преимущество комбинированной МГТ (дидрогестерон 10 мг и эстрадиол 1 мг) как в группе монотерапии, так и в сочетании с негормональной терапией полипептидами эпифиза крупного рогатого скота по сравнению с локальной гормональной терапией.
В ходе исследования выраженность вазомоторных симптомов у пациентов 1, 2 и 3-й групп снизилась по итогу 6 месяцев лечения на 61,7% (2,59±1,02); 49,7% (3,03±1,56) и 36,5% (4,0±0,94) соответственно, а через 12 месяцев – на 88,3% (0,79±0,68), 76,8% (1,40±0,86) и 58,7% (2,6±0,84) соответственно (табл. 2).
Тяжесть депрессивных симптомов была оценена с помощью теста Бека. По истечении 12 месяцев был рассчитан процент, который указывал на разницу в полученных баллах. Через 6 месяцев терапии у пациенток 1-й и 2-й групп было отмечено статистически значимое снижение тяжести депрессивных симптомов по шкале Бека (снижение на 28,9% (11,07±3,45) и 38,7% соответственно (10,60±3,78)). По итогу 12 месяцев наблюдения показатели продемонстрировали снижение на 49,9% (7,80±2,01), 65,9% (5,90±2,08) соответственно по отношению к исходным данным (табл. 3).
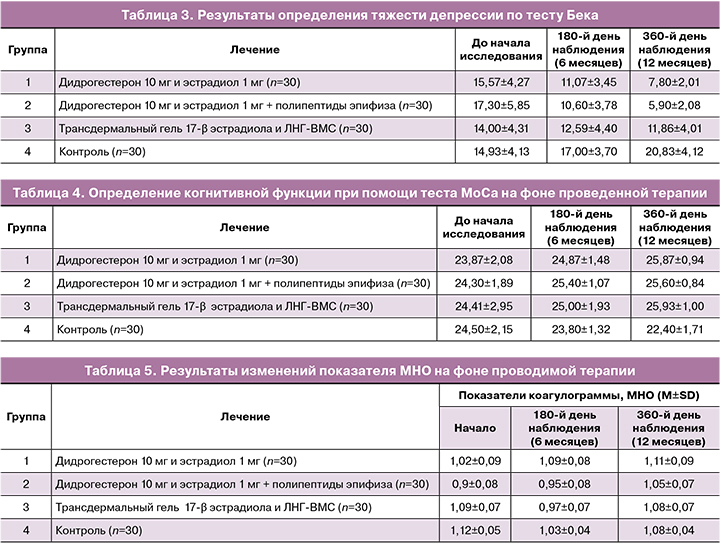
В группе назначения комбинации трансдермального геля 17-β эстрадиола и ЛНГ-ВМС тенденция к облегчению депрессивных проявлений была значительно менее выражена и через 6 месяцев составила 10,1% (12,59±4,40), а к концу исследования (12 месяцев) – 15,3% (11,86±4,01) (табл. 3).
У пациенток контрольной группы наблюдалось усугубление депрессивного синдрома, выражающееся в повышении показателей шкалы Бека к 180-му дню на 13,9%, а к 360-му дню – на 39,5% по отношению к исходным данным (табл. 3).
Таким образом, на фоне применения МГТ, содержащей 10 мг дидрогестерона и 1 мг эстрадиола, было наиболее выражено снижение депрессивных симптомов в сравнении с комбинацией трансдермальной терапии и ЛНГ-ВМС.
Когнитивная функция оценивалась с помощью теста MoCa, результаты которого отражены в таблице 4.
Результаты МоСа-теста на фоне лечения отличались наиболее выраженной положительной динамикой в группе, получавшей комбинацию 1 мг эстрадиола и 10 мг дидрогестерона. Так, через 6 месяцев когнитивные функции повысились на 4,2% (24,87±1,48) от исходного уровня, а через 12 месяцев – на 8,4% (25,87±0,94). В группе пациентов, которые принимали комбинацию эстрадиол/дидрогестерон и негормональную поддержку, по итогу 6 месяцев отмечено повышение на 4,5% (25,40±1,07) от исходного уровня, а по истечении 12 месяцев – на 5,3% (25,60±0,84).
Группа, получавшая трансдермальный гель 17-β эстрадиола в комбинации с ЛНГ-ВМС, по результатам МоСа-теста показала незначительное повышение на 2,4% (25,00±1,93) и 6,2% (25,93±1,00) соответственно по истечении 6 и 12 месяцев.
Отсутствие терапии продемонстрировало снижение результатов МоСа-теста на 2,9% (23,80±1,32) к 180-му дню и на 8,6% (22,40±1,71) – к 360-му дню, что свидетельствует об усугублении когнитивных расстройств и еще раз демонстрирует важность своевременного восполнения эстрогендефицита.
Для объективизации результатов исследования по шкалам нами была проведена лабораторная оценка динамики уровня фактора роста нервов на фоне проводимого лечения. Фактор роста нервов (ФРН) относится к белкам семейства нейротрофинов. Этот белок принимает участие в развитии, дифференцировке и выживании отдельных популяций нервных и других клеток, в том числе и не относящихся к нервной системе. ФРН выполняет в организме широкий спектр физиологических функций, например, регулирует функцию норадренергических ядер гипоталамуса и ствола мозга, модулируя тем самым активность гипоталамо-гипофизарно-надпочечниковой системы. Лабораторное определение его уровня все чаще используется в медицинских исследованиях для определения состояния нервной системы, способности к нейрогенезу [20]. Результаты представлены на рисунке.

Анализ показателей на рисунке свидетельствует о значимом улучшении, выраженном в 4-кратном увеличении уровня ФРН по итогу 12 месяцев терапии, в сравнении с исходным у пациенток, использовавших 1 мг эстрадиола и 10 мг дидрогестерона в комбинации с полипептидами эпифиза. В группе принимавших только МГТ, содержащую 1 мг эстрадиола и 10 мг дидрогестерона, этот показатель увеличился в 2,5 раза. В группе использовавших трансдермальный гель эстрадиола в комбинации с ЛНГ-ВМС показатель увеличился лишь в 1,9 раза по итогу 12 месяцев. Тогда как в контрольной группе уровень ФРН снизился в 1,5 раза, что свидетельствовало об ухудшении когнитивной функции.
С целью контроля безопасности применения менопаузальной гормональной терапии, на всем протяжении наблюдения проводилась оценка следующих показателей коагулограммы: уровень МНО (международное нормализованное соотношение), АЧТВ (активированное частичное тромбопластиновое время), фибриноген. Результаты динамического наблюдения представлены в таблицах 5–7.
В группах применения 1 мг эстрадиола и 10 мг дидрогестерона как в качестве монотерапии, так и в сочетании с полипептидами эпифиза (группы 1 и 2) отмечается улучшение реологических свойств крови. Зафиксировано повышение показателей МНО и снижение АЧТВ в обеих исследуемых группах. В группах назначения МГТ как в монотерапии, так и в комбинации с альтернативной терапией отмечается положительная динамика показателей свертываемости. Было отмечено снижение концентрации фибриногена через 6 месяцев (3,3±0,26, снижение на 5,9% от исходного) и через 12 месяцев (2,8±0,2, снижение на 11,9% от исходного) на фоне приема МГТ, содержащей 10 мг дидрогестерона и 1 мг эстрадиол. При дополнительном назначении альтернативной терапии полипептидами эпифиза было отмечено снижение концентрации фибриногена (через 6 месяцев – на 8,1% от исходного (2,97±0,23), через 12 месяцев – 2,77±0,2, снижение на 13,9% от исходного)). На фоне локальной терапии эстрогенами в сочетании с ЛНГ-ВМС отмечается незначительное смещение показателей в сторону гиперкоагуляции.
В контрольной группе не отмечалось выраженных изменений показателей коагулограммы.
В течение всего периода наблюдения ни у одной пациентки не отмечалось эпизодов тромботических осложнений и выраженных изменений показателей коагулограммы.
Также на фоне лечения проводилось систематическое ультразвуковое наблюдение за состоянием эндометрия. В процессе наблюдения ультразвуковые признаки патологии эндометрия не выявлены.
Обсуждение
Наше исследование подтвердило необходимость персонифицированного подхода при выборе МГТ с учетом коморбидного статуса и индивидуальных потребностей пациентки.
Согласно результатам проведенной работы, системная циклическая МГТ, содержащая дидрогестерон 10 мг + эстрадиол 1 мг самостоятельно или в комбинации с инъекциями полипептидов эпифиза крупного рогатого скота, способствовала более эффективному снижению тяжести менопаузальных симптомов (при оценке по шкале Грина), положительно влияла на показатели гемостаза, восстановление когнитивной функции и психоэмоциональных показателей у пациенток в перименопаузе в сравнении с комбинацией трансдермального геля 17-β эстрадиола и ЛНГ-ВМС.
Основным риском в отношении МГТ считается и риск венозной тромбоэмболии. Ряд исследований ранее позволял предположить, что трансдермальный путь ведения эстрогенов, возможно, ассоциирован с наименьшим риском тромбоэмболии. Однако в результате недавнего исследования Blondon M. et al. (2021) было показано, что среди различных эстрогенов по сравнению с использованием перорального конъюгированного эквинного эстрогена относительный риск венозных тромбозов сопоставим при использовании перорального или трансдермального эстрадиола [21]. В данной работе показано отсутствие различий по риску венозных тромбозов в зависимости от пути введения эстрогенов – перорального или трансдермального, что также подтвердили данные, которые были получены нами в ходе исследования.
Кроме того, имеются данные, что пероральная комбинированная терапия способна позитивно влиять на липидный профиль и индекс атерогенности в сравнении с трансдермальным путем введения эстрогенов [21]. Согласно недавнему обзору исследований, пероральные эстрогены оказывают более выраженное положительное влияние на проатерогенную дислипидемию, чем трансдермальный эстрадиол [22].
Дидрогестерон в роли гестагена, входящий в состав пероральной МГТ в комбинации с эстрадиолом, не ассоциирован с дополнительными рисками в отношении тромбозов, рака молочной железы, рака эндометрия, метаболических эффектов [23–27].
Заключение
Таким образом, комбинация эстрадиола с дидрогестероном является оптимальным выбором МГТ с учетом профиля эффективности и безопасности терапии.
При отсутствии МГТ в группе контроля у пациенток с первичной гипоэстрогенией выраженность вазомоторных симптомов, когнитивные нарушения усугублялись, что сопровождалось снижением социальной активности и ухудшением качества жизни, что еще раз подчеркивает важность своевременного, раннего старта гормональной терапии.



