Продолжительность жизни людей в развитых и развивающихся странах стремительно увеличивается. К 2050 г. доля мирового населения старше 60 лет почти удвоится – с 12% (900 млн человек) до 22% (2 млрд) по сравнению с 2015 г. [1]. При этом женщины старшего возраста численно превосходят мужчин. Так, в 2022 г. в мире женщины составляли 55,7% людей в возрасте 65 лет и старше, и данная тенденция будет сохраняться [2]. Масштаб и скорость демографических изменений подчеркивают необходимость разработки мер реагирования на старение населения.
Менопауза – актуальная проблема современного общества
Средний возраст естественной менопаузы в развитых странах составляет 51,5 года, варьируя в диапазоне 45–55 лет. Возрастной дефицит эстрогенов приводит к развитию климактерического синдрома [3]. Вазомоторные симптомы (ВМС) являются наиболее специфичными для эстрогенодефицита и служат основным показанием для назначения системной гормональной терапии (ГТ). Психоэмоциональные и соматические нарушения часто сочетаются с ВМС и снижают качество жизни в пери- и постменопаузе (рис. 1) [3, 4].

Согласно данным эпидемиологических исследований, 74% женщин в возрасте до 55 лет испытывают ВМС, у 28% женщин в возрасте до 55 лет наблюдаются ВМС умеренной и тяжелой степени выраженности, 42 и 33% женщин в возрасте 60–64 лет и 65–79 лет соответственно все еще отмечают проявления ВМС [4, 5]. Период климактерия может быть «отправной точкой» для последующего развития неблагоприятных состояний пожилого возраста, таких как остеопения/остеопороз и сердечно-сосудистые заболевания (ССЗ). Все это обусловливает необходимость коррекции проявлений менопаузы.
Регламентирующие документы
В Российской Федерации (РФ) доступны различные формы менопаузальной гормональной терапии (МГТ), включая системные и топические, пероральные (ПО) и трансдермальные (ТД) эстрогены, а также разные варианты гестагенной «поддержки» эндометрия. Выбор вида терапии требует индивидуального подхода с учетом регламентирующих документов [6, 7]. С 1 января 2022 г. клинические рекомендации (КР) стали основным руководством для врачей в РФ [7]. В связи с чем в рутинной практике следует ориентироваться на основные регламентирующие документы:
- КР «Менопауза и климактерическое состояние у женщины» (2021) [8];
- инструкция по медицинскому применению лекарственного препарата (листок-вкладыш) [9].
Помимо регламентирующих документов имеются дополнительные – международные рекомендации, результаты исследований, критерии приемлемости:
- «Критерии приемлемости применения МГТ у женщин с различными заболеваниями» (2022) – так называемые испанские критерии приемлемости [10];
- «Российские критерии приемлемости назначения МГТ пациенткам с сердечно-сосудистыми и метаболическими заболеваниями» (2023) – отечественные критерии приемлемости [11].
Знание и понимание дополнительных документов позволяют оптимизировать индивидуальный подход к назначению МГТ.
Особенности применения системной менопаузальной гормональной терапии у женщин с различными нозологиями
Эффективность различных форм гормональной терапии в отношении купирования климактерических симптомов
Согласно позиции Североамериканского общества по менопаузе (NAMS), ГТ остается наиболее эффективным методом коррекции ВМС [12].
Исследование KEEPS показало сопоставимую эффективность ПО и ТД форм эстрогена в комбинации с микронизированным прогестероном (МП) в снижении частоты приливов и ночной потливости на протяжении 4 лет [13].
Согласно заключению метаанализа 47 рандомизированных клинических исследований из рекомендаций Национального института здравоохранения и совершенствования медицинской помощи Великобритании (NICE), у женщин с интактной маткой комбинация ТД эстрадиола и прогестерона оказалась наиболее эффективной в отношении купирования ВМС [14].
Многоцентровое исследование 257 женщин подтвердило одинаковую эффективность ПО и ТД эстрогенов в уменьшении выраженности менопаузальных симптомов. При этом ТД форма демонстрирует более благоприятный профиль безопасности в отношении липидного и углеводного обмена, тромботических рисков, особенно для женщин с метаболическим синдромом, избыточной массой тела, ишемической болезнью сердца (ИБС) и факторами риска венозной тромбоэмболии (ВТЭ) [15].
Оптимальный подход с позиции безопасности
Для женщин старше 60 лет, а также при МГТ спустя 10 лет после менопаузы соотношение пользы и риска может быть менее благоприятным в связи с высоким риском ИБС, инсульта, ВТЭ и деменции. Лечение должно быть с периодической переоценкой преимуществ и рисков для решения вопроса о продолжении терапии [12].
Особенности метаболизма эстрогенов
При выборе МГТ важно учитывать особенности метаболизма активного вещества. На метаболизм влияют многочисленные факторы, включая возраст, массу тела, состояние органов и систем, а также путь введения [16].
ПО путь удобен, но имеет ограничения из-за частичного разрушения препарата пищеварительными ферментами и печеночным метаболизмом. Могут потребоваться более высокие дозы для достижения терапевтического эффекта. При этом значительная часть дозы превращается в эстрон и его конъюгаты, обладающие меньшей эстрогенной активностью, но связанные с рисками нежелательных явлений [17, 18].
ТД формы доставляют эстрадиол непосредственно в системный кровоток, минуя желудочно-кишечный тракт (ЖКТ) и печень. Это обеспечивает более стабильную терапевтическую концентрацию эстрадиола в плазме и более низкий уровень циркулирующего эстрона, который может негативно влиять на ткани молочной железы и усиливать синтез печеночных белков, включая тромбин [19]. Таким образом, метаболизм ТД форм эстрогенов ближе к физиологическому и обеспечивает более высокую биодоступность и безопасность по сравнению с ПО формами (рис. 2) [20].
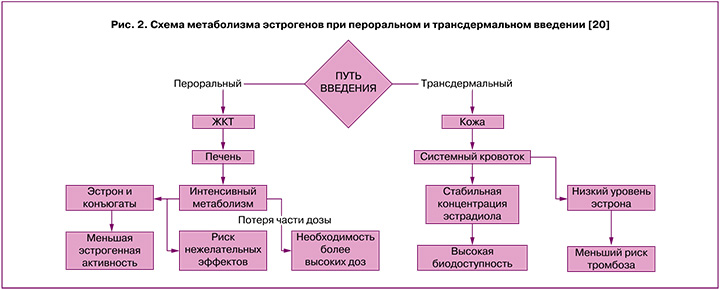
Путь введения эстрогенов и заболевания ЖКТ
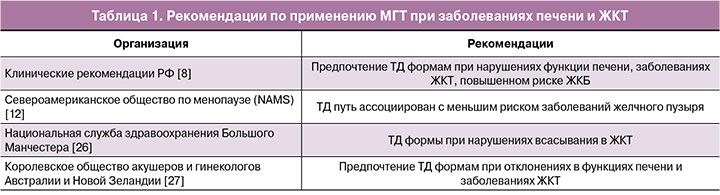
Распространенность заболеваний печени составляет 26% среди женщин РФ, преобладая в период менопаузы [21]. Заболевания печени и кишечника могут ухудшать метаболизм ПО эстрогенов [22]. Частота желчнокаменной болезни (ЖКБ) составляет 10–40% среди мирового населения, встречаясь у женщин в 3 раза чаще [23]. NAMS отмечает, что ТД путь введения ассоциирован с меньшим риском ЖКБ [12]. Исследование 1 001 391 женщины в постменопаузе показало, что ТД применение эстрогенов позволяет избежать 1 холецистэктомии на каждые 140 женщин на МГТ [24]. Исследование E3N (70 928 женщин) выявило повышенный риск холецистэктомии при ПО МГТ, особенно при монотерапии без прогестагена (1 дополнительная холецистэктомия на 150 женщин за 5 лет) [25]. Сравнительный обзор рекомендаций представлен в таблице 1.
Путь введения эстрогенов и метаболический синдром
Метаболический синдром (МС) – комплекс нарушений, включающий инсулинорезистентность, дислипидемию, ожирение и артериальную гипертензию (АГ). Несмотря на относительную «молодость» данного состояния, масштабы исследований МС растут в геометрической прогрессии: МС играет не последнюю роль в развитии ССЗ [28].
Гиперинсулинемия, компонент МС, является фактором риска развития сахарного диабета 2 типа (СД2). В 2022 г. 65,5% летальных случаев по причине СД2 было у женщин [29]. Имеются данные о снижении риска дебюта СД при применении ТД эстрадиола и МП [30].
Hirsch H. et al. (2022) рекомендуют женщинам с контролируемым СД2 (HbA1c<8%) выбирать ТД эстрогены в сочетании с МП при интактной матке [31]. Другие профильные руководства также рекомендуют ТД эстрогены при СД [32–34].
Согласно рекомендациям NICE [35], Европейского общества по менопаузе и андропаузе (EMAS) [14] и Национальной службы здравоохранения (NHS) [26], женщинам с СД2 следует:
- при ИМТ>30 кг/м² и низком/умеренном риске ССЗ выбирать ТД эстрогены;
- при ИМТ<30 кг/м² и низком риске ССЗ возможно применение ПО форм у женщин моложе 60 лет;
- использовать МП или дидрогестерон.
Испанские критерии приемлемости [10] рекомендуют при СД ТД формы МГТ и комбинированную ПО терапию без ограничений, за исключением монотерапии ПО эстрогенами, которая рассматривается как приемлемая, несмотря на некоторые риски. Отечественные критерии [11] отмечают выбор ТД форм при наличии противопоказаний или риска тромбозов, российские КР [8] рассматривают ТД эстрогены в качестве первой линии для женщин с гиперинсулинемией.
Эстрогены также оказывают влияние на метаболизм липопротеинов и триглицеридов. Согласно метаанализу [36], обе формы эстрогенов повышают уровень холестерина липопротеинов высокой плотности (ХС-ЛВП), однако ТД в меньшей степени; обе снижают уровень холестерина липопротеинов низкой плотности (ХС-ЛНП); ТД эстрогены, в отличие от ПО, не повышают уровень триглицеридов; при ТД применении частицы ХС-ЛНП более устойчивы к окислению; повышенный уровень триглицеридов на фоне ПО эстрогенов ассоциирован с образованием более мелких частиц ХС-ЛНП и увеличением их восприимчивости к окислению.
Частота распространенности гипертриглицеридемии, независимого фактора риска ССЗ, у женщин в мире составляет 23,8%, и достоверно известно, что ТД эстрогены не повышают уровень триглицеридов [37, 38].
Исследование WHI показало, что исходно повышенный уровень ХС-ЛНП – фактор риска ССЗ, требующий четкого плана коррекции с применением таргетной терапии. А в последующем для коррекции симптомов менопаузы, согласно рекомендациям NAMS и Эндокринологического общества, оптимальны ТД формы с МП для женщин с интактной маткой во избежание печеночного метаболизма и негативного влияния на липидный обмен. При неконтролируемой дислипидемии следует выбирать альтернативные методы терапии [31].
NHS [26] и EMAS [39] не рекомендуют МГТ в качестве первой линии терапии дислипидемии. При гипертриглицеридемии и риске ССЗ/ВТЭ предпочтительны ТД формы с МП или дидрогестероном.
Испанские критерии [10] не ограничивают использование МГТ при гиперхолестеринемии. Отечественные критерии [11] и российские КР [7] при триглицеридемии отдают предпочтение ТД формам как более безопасным.
Увеличение заболеваемости ожирением наблюдается как в мире, так и в РФ [40]. В РФ 28,7% женщин имеют избыточную массу тела, а 31,4% – ожирение [41]. Ожирение в постменопаузе может быть ассоциировано с риском СД2, болезни Альцгеймера и ССЗ [22].
Исследования показали различия во влиянии ПО и ТД эстрогенов на уровень лептина и соотношение лептин/адипонектин. Соотношение лептин/адипонектин рассматривалось в качестве предиктора ССЗ. Zhu J. et al. (2023) оценили разные формы эстрогенов у женщин в постменопаузе с ожирением и МС. В группе с ТД терапией не отмечено влияния на уровень лептина, тогда как при ПО способе уровень лептина повысился с увеличением соотношения лептин/адипонектин и нарушением резистентности к инсулину [22].
Рекомендации международных организаций:
Королевское общество акушеров и гинекологов Австралии и Новой Зеландии [42], Британское общество по менопаузе [43], NICE [35], NHS [26] и Национальный колледж акушеров-гинекологов Франции [44] рекомендуют ТД формы эстрогенов женщинам с повышенным ИМТ и факторами риска ССЗ в сочетании с МП.
Испанские критерии приемлемости [10]: ИМТ 25–30 кг/м² – ТД эстрогены без ограничений, ПО – преимущества перевешивают риски; ИМТ>30 кг/м² – ТД эстрогены предпочтительны, ПО – риски превышают пользу.
Отечественный согласительный документ [11] рекомендует метаболически нейтральные прогестагены, при этом не категоризируя различные формы эстрогенов.
КР РФ [8] рекомендуют ТД эстрогены при ожирении.
Распространенность артериальной гипертензии (АГ) среди населения может достичь почти 30% к 2025 г. В РФ частота АГ среди женщин составляет до 39,6% [45].
Проспективное исследование 112 240 женщин показало более высокий риск развития АГ при использовании ПО форм эстрогенов по сравнению с ТД. Это связано, в том числе, с избыточной активацией ренин-ангиотензин-альдостероновой системы [46].
Рекомендации по применению МГТ при АГ:
1. NAMS и Эндокринологическое общество [31]: при хорошо контролируемой АГ и низком риске ССЗ возможно назначение обеих форм, при плохо контролируемой АГ оптимальны ТД эстрогены с МП.
2. Испанские [10] и отечественные [11] критерии приемлемости: ПО и ТД формы допустимы при контролируемом АД.
3. КР РФ [8]: рекомендованы ТД эстрогены с учетом профиля безопасности.
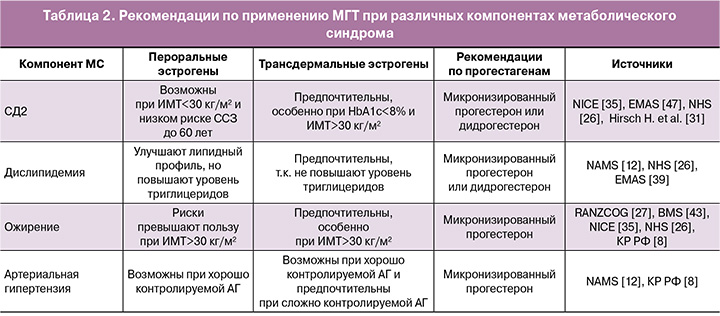
Общая сводка рекомендаций по применению МГТ при различных компонентах МС представлена в таблице 2.
Путь введения эстрогенов и тромботические риски
Исторически женщин относили к группе с низким риском развития CCЗ. Однако в 2019 г. у 275 млн женщин были диагностированы ССЗ с 8,9 млн летальных исходов. В 2021 г. комиссия журнала «Ланцет» пришла к выводу, что ССЗ у женщин недостаточно изучены, часто не диагностируются и слабо представлены в клинических исследованиях, в связи с чем была поставлена задача снизить «глобальное бремя ССЗ» у женщин к 2030 г. [48].
В современных исследованиях ССЗ используется термин MACE (major adverse cardiovascular events) – серьезные неблагоприятные кардиоваскулярные события, включающие прежде всего инфаркт миокарда (ИМ) и инсульт [49, 50].
Датское исследование выявило 4947 случаев ИМ. МГТ в целом не повышает риск ИМ у женщин, при этом ТД эстрогены ассоциированы с наиболее низким риском [51].
Испанские критерии приемлемости [10] относят как ПО, так и ТД эстрогены к группе, где риски перевешивают преимущества. Отечественные критерии [11] и КР РФ [8] рассматривают ИМ как противопоказание к МГТ.
Согласно NAMS, комбинированный анализ WHI и Кокрейновского метаанализа 2015 г. показал, что при старте МГТ в 50–59 лет увеличения частоты инсульта не наблюдалось, однако риск повышался при начале ГТ после 60 лет. ТД эстрогены имеют преимущества из-за отсутствия первичного печеночного метаболизма [12].
Когортное исследование «случай-контроль» показало, что ТД терапия низкими дозами эстрогенов не увеличивает риск инсульта [52].
Согласно рекомендациям Американской ассоциации клинической эндокринологии, ТД эстрогены меньше ассоциированы с тромботическими рисками и риском инсульта и ИБС [53].
Национальное когортное исследование в Дании не выявило повышения риска инсульта на фоне ТД МГТ, в отличие от ПО [54].
Частота встречаемости ВТЭ среди женщин составляет 110:100 000, при этом 20% перенесших ВТЭ умирают в течение года или страдают от осложнений [42, 55, 56].
Крупные исследования показали меньший риск ВТЭ при ТД эстрогенах:
- ESTHER: повышение риска ВТЭ на ПО эстрогенах, но не ТД [57, 58];
- GPRD: повышение риска ВТЭ на фоне ПО эстрогенов, но не ТД [59];
- E3N: ПО эстрогены связаны с повышенным риском тромбоза, ТД – нет [60];
- «Миллионное» исследование: риск ВТЭ выше при ПО терапии, но не при ТД [61].
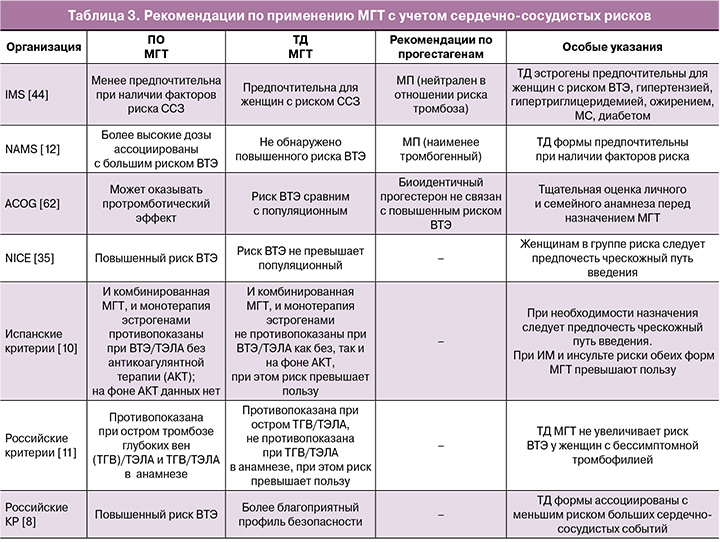
В таблице 3 обобщены ключевые позиции различных медицинских сообществ относительно применения ПО и ТД МГТ в контексте сердечно-сосудистых рисков.
ТД эстрогены в сочетании с МП считаются наиболее безопасной формой МГТ, в том числе для женщин с факторами риска ССЗ [52, 63, 64].
Путь введения эстрогенов и мигрень
Распространенность мигрени среди женщин в мире составляет 20,7% [23]. Мигрень как с аурой, так и без нее – фактор риска ишемического инсульта [65]. Согласно международным рекомендациям [26, 27, 43], мигрень не является противопоказанием к МГТ. Предпочтение отдается ТД эстрогенам. При необходимости использования комбинированной МГТ гестагенами выбора являются левоноргестрел-содержащая внутриматочная спираль (ЛНГ-ВМС), ТД норэтистерон или МП.
NAMS указывает, что у женщин с мигренью в анамнезе, использующих ТД МГТ, нет повышенного риска инсульта [31].
Испанские критерии приемлемости [10] при мигрени без ауры относят обе формы МГТ к группе, где преимущества перевешивают риски. При мигрени с аурой ТД эстрогены считаются более безопасными по риску инсульта. В отечественных критериях [11] мигрень не представлена. Российские КР при мигрени отдают предпочтение ТД эстрогенам [8].
Путь введения эстрогенов и курение
По данным Всемирной организации здравоохранения (ВОЗ), к 2030 г. 8 млн человек ежегодно будут умирать от заболеваний, связанных с курением [66]. В РФ распространенность курения среди женщин в 2022 г. составила 10% [41]. Курение является независимым фактором риска ССЗ и ИМ [67]. У курящих женщин при ПО приеме МГТ концентрация эстрогенов в крови снижается на 50% из-за влияния компонентов сигаретного дыма на печеночный метаболизм. Это нивелирует положительные эффекты МГТ на липидный профиль и минеральную плотность кости. При ТД применении таких изменений не наблюдается [68, 69].
Рекомендации по МГТ для курящих женщин:
- испанские критерии приемлемости МГТ [10]: ТД предпочтительнее ПО;
- отечественные критерии приемлемости МГТ [11]: обе формы допустимы, но необходимо соблюдать осторожность при назначении ПО МГТ, информировать о рисках;
- КР РФ [8]: предпочтительны ТД эстрогены.
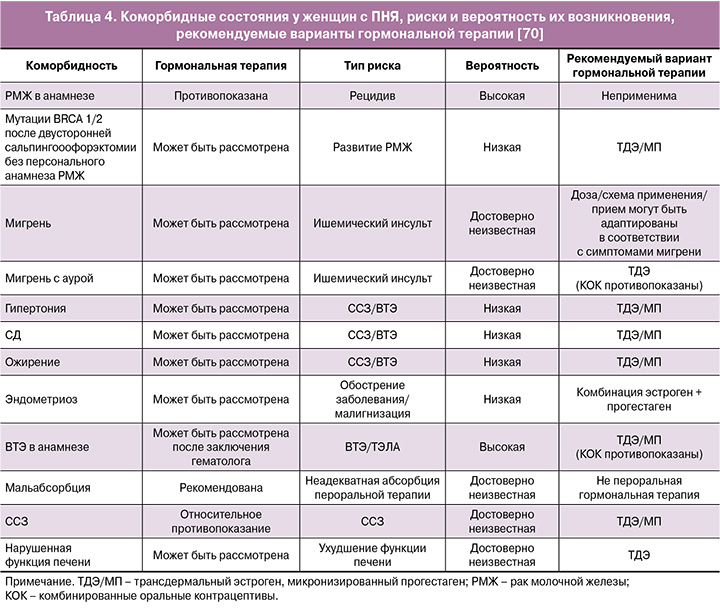
Проект рекомендаций Европейского общества репродукции человека и эмбриологии (ESHRE) по преждевременной недостаточности яичников (ПНЯ) 2024 г. подчеркивает важность раннего начала ГТ у женщин с ПНЯ для снижения риска общей заболеваемости и смертности. При коморбидных состояниях (включая ССЗ, ожирение, ВТЭ в анамнезе) рекомендуется использовать ТД эстроген и МП, что отражено в таблице 4 [70].
Актуальным остается вопрос о таком нежелательном явлении на фоне МГТ, как ациклические кровотечения (АцК). Поскольку большинство факторов, ассоциированных с АцК на фоне МГТ, в основном связаны с гестагеновым компонентом, при комбинированной терапии следует подбирать оптимальный гестаген с соответствующей дозой. Так, согласно данным руководства по ведению пациенток с АцК 2024 г., МП по сравнению с дидрогестероном может иметь более благоприятный профиль по АцК [71].
При применении ТД геля эстрадиола в сочетании с МП (вагинальные капсулы) гистологически атрофии эндометрия наблюдались в 100% случаев, аменореи – в 92,6% [72].
МП имеет целый ряд преимуществ. Антиальдостероновый эффект способствует лучшей переносимости по сравнению с дидрогестероном в связи с отсутствием задержки жидкости, клинически проявляющейся прибавкой массы тела, мастодинией, головными болями [73]. Наличие метаболита аллопрегнанолона, физиологического регулятора сна, помогает нормализовать ночной сон, улучшить общее самочувствие и настроение. МП в перименопаузе позволяет снизить выраженность и частоту ВМС, улучшить сон и уменьшить тревожность [69]. Эти эффекты свойственны только биоидентичному прогестерону. В отличие от синтетических прогестинов, МП метаболически нейтрален, не влияет на липидный и углеводный обмен, не приводит к прибавке массы тела, не повышает риск ВТЭ. Возможность применять МП как перорально, так и интравагинально обеспечивает максимальное удобство терапии. Интравагинальное применение МП обеспечивает стабильную концентрацию прогестерона и его таргетную доставку в эндометрий, тем самым эффективно защищая его от гиперплазии [35].
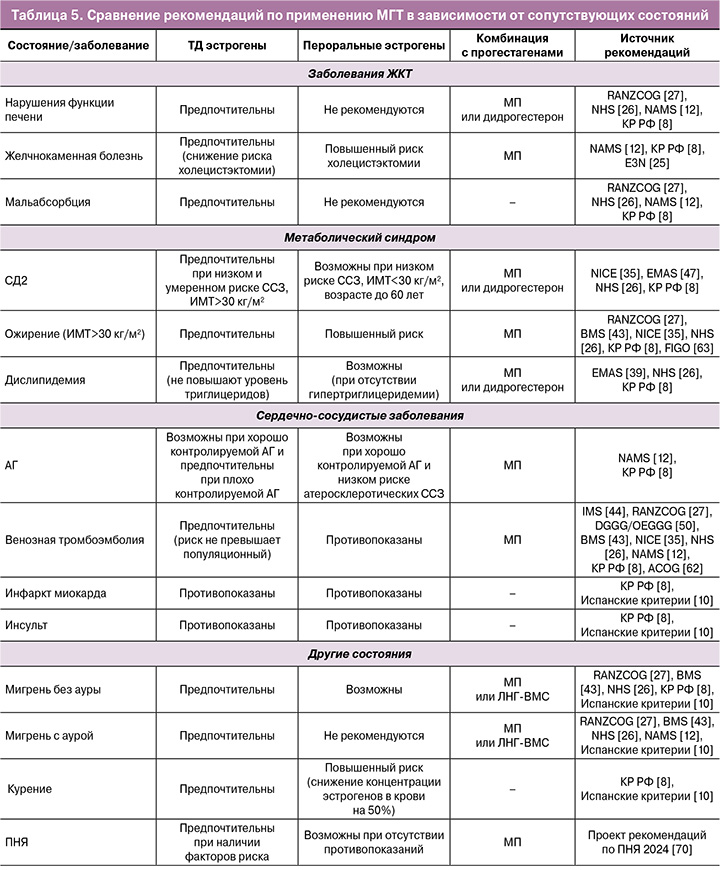
Сводка общих рекомендаций по применению МГТ представлена в таблице 5.
Заключение
Таким образом, имеющиеся современные научные данные об эффективности и безопасности различных компонентов МГТ, а также их дополнительных свойствах позволяют выделить оптимальный состав гормональной терапии для женщин с климактерическими симптомами с позиции баланса пользы и риска. Одной из таких комбинаций является сочетание ТД пути введения эстрадиола с МП, которое не просто ведет к снижению рисков общей и сердечно-сосудистой смертности, профилактике переломов и улучшению качества жизни, но при этом не повышает риска тромбоэмболических осложнений, ишемического инсульта, ЖКБ и, возможно, рака молочной железы.



