Одно из лидирующих мест в структуре заболеваемости и смертности новорожденных традиционно занимают повреждения гипоксически-ишемического характера и их последствия [1]. Наибольшую опасность и прогностическую значимость представляет ишемически-гипоксическое поражение центральной нервной системы (ЦНС), нередко являющееся причиной летальных исходов и играющее ведущую роль в дальнейшей дезадаптации детей и возникновении тяжелых инвалидизирующих заболеваний [2–4].
Успехи медицинской науки и практики, обобщение огромного количества новых данных позволили выйти на качественно иной уровень понимания патологических процессов, лежащих в основе развития ряда критических состояний, в том числе церебральной гипоксии/ишемии [5–6]. Патогенетическая терапия, в частности использование краниоцеребральной гипотермии, представляет собой новую веху в лечении перинатальной гипоксии и ее последствий, однако результаты этого лечения, особенно у недоношенных детей, далеки от совершенства [7–9].
Очевидно, что многие аспекты патогенеза перинатальных гипоксически-ишемических повреждений органов и систем, особенности адаптации новорожденных к перинатальной гипоксии и коррекции ее последствий до настоящего времени недостаточно изучены [10].
Материал и методы исследования
В исследование включены 226 новорожденных, перенесших анте- и/или интранатальную гипоксию, рожденных и/или находившихся на выхаживании и лечении в данных лечебно-профилактических учреждениях.
Дети разделены на 3 группы соответственно степени тяжести церебральной ишемии (ЦИ) (таблица). Контрольную группу составили 50 практически здоровых новорожденных от физиологических беременностей и родов.
РАМАН-спектроскопия гемоглобина проведена 151 новорожденному с перинатальной гипоксией и 50 здоровым детям. Осуществляли заборы крови (0,1–0,2 мл) у новорожденных детей. Делались обычные мазки крови на предметное стекло. Затем с помощью аппарата проводилась РАМАН-спектроскопия с записью кривых РАМАН-спектра гемоглобина новорожденного. Выписывались полоcы спектра РКР гемоглобина при возбуждении лазером 532 нм и соотнесение полос с колебаниями связей порфирина [11].
Соотношение интенсивностей I1375/(I1355+I1375) является характеристикой относительного количества оксигемоглобина в крови или суспензии эритроцитов. Отношение интенсивностей I1355/I1550 отражает относительную способность всего гемоглобина в пробе связывать лиганды (в том числе кислород), а соотношение I1375/I1580 — относительную способность гемоглобина выделять лиганды. Отношение (I1355/I1550)/(I1375/I1580) отражает сродство гемоглобина к лигандам, в первую очередь кислороду.
При использовании лазера 532 нм для сравнительного анализа спектров ГКР от мембраносвязанного и изолированного цитоплазматического гемоглобина рассчитывалось соотношение интенсивностей полос 1375 и 1172 см-1 I1375/I1172. Полоса 1172 см-1 появляется в результате асимметричных колебаний колец пирролов в оксигемоглобине. Отношение I1375/I1172 несет информацию о выраженности симметричных и асимметричных колебаний пиррольных колец, а его изменение может быть связано с конформационными изменениями пирролов. Данные формулы вносились в программу Microsoft Еxcel, производился подсчет данных показателей. Проведено исследование влияния различного потока кислорода на структурно-функциональные особенности гемоглобина in vitro. Взяты пробы крови у новорожденных с различной степенью тяжести церебральных ишемий, осуществлялась подача кислорода с разным потоком (2 л/мин, 5 л/мин, 10 л/мин).
Полученные данные обработаны статистически на персональном компьютере с использованием пакета программ Statistica 8, достоверность полученных результатов оценивалась с использованием критерия Стьюдента t. Корреляционный анализ проводился с использованием критерия Пирсона и коэффициента ранговой корреляции Спирмена.
 Результаты исследования
Результаты исследования
Для оценки функциональной активности эритроцитов и кислород-транспортирующих свойств гемоглобина как важнейшего патогенетического механизма формирования кислородной недостаточности у новорожденных, перенесших перинатальную гипоксию и имеющих ишемически-гипоксические поражения ЦНС, был применен метод спектроскопии комбинационного рассеивания (СКР). Предварительно при оценке спектров КР венозной крови здоровых новорожденных и взрослых людей установлены особенности конформационного состояния гемоглобина новорожденного.
В данной работе для характеристики относительного количества оксигемоглобина в крови определялось соотношение интенсивностей спектров I1375/(I1355+I1375). Относительная способность гемоглобина связывать лиганды рассчитывалась как отношение СКР I1355/I1550. Относительная способность гемоглобина выделять лиганды определялась как отношение СКР I1375/I1580. Сродство гемоглобина к лигандам (в том числе к кислороду) определяли по соотношению интенсивностей (I1355/I1550)/(I1375/I1580). Отношение СКР I 1375/I 1172 использовали для оценки колебаний пиррольных колец, свидетельствующих о конформационных изменениях пирролов.
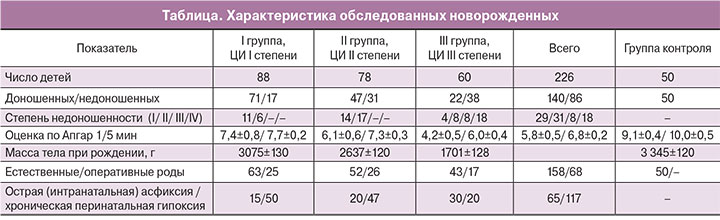
Согласно полученным данным, в эритроцитах новорожденных по сравнению с эритроцитами взрослых содержится большее количество оксигемоглобина, имеется меньшая относительная способность гемоглобина связывать и выделять лиганды, но более высокое сродство гемоглобина к кислороду. Более интенсивные колебания метиновых мостиков гемоглобина свидетельствуют о конформационных отличиях гемоглобина новорожденных от гемоглобина взрослых. При анализе спектров КР у новорожденных, которые перенесли гипоксию и у которых развилось ишемически-гипоксическое поражение ЦНС, выявлено, что соотношение интенсивностей полос, характеризующих количество оксигемоглобина, растет с увеличением тяжести заболевания, причем данный показатель оказался больше, чем у здоровых новорожденных.
Показатель, отражающий способность гемоглобина связывать лиганды, в первую очередь кислород, у новорожденных с перинатальными поражениями ЦНС уменьшается с увеличением степени тяжести ЦИ. Показатель относительной способности гемоглобина выделять лиганды у новорожденных при ишемически-гипоксическом поражении ЦНС выше, чем у здоровых новорожденных, и растет по мере увеличения тяжести ЦИ. Отношение полос в спектре КР, которое отражает сродство гемоглобина к лигандам, в том числе к кислороду, у новорожденных с ЦИ меньше, чем у здоровых, причем оно уменьшается по мере увеличения тяжести ЦИ (рис. 1).
Показатель, отражающий конформационные изменения пиррольных колец (так называемые колебания метиновых мостиков в гемоглобине), у детей с ЦИ выше, чем у здоровых, и возрастает по мере ее утяжеления, что свидетельствует о более выраженных структурно-функциональных нарушениях гемоглобина. В этих условиях присоединение кислорода к гемоглобину становится еще менее эффективным, способствуя усугублению гипоксии. Таким образом, у новорожденных, перенесших перинатальную гипоксию, в эритроцитах развиваются прогрессирующие патофизиологические нарушения конформации гемоглобина и его способности связывать и выделять кислород.
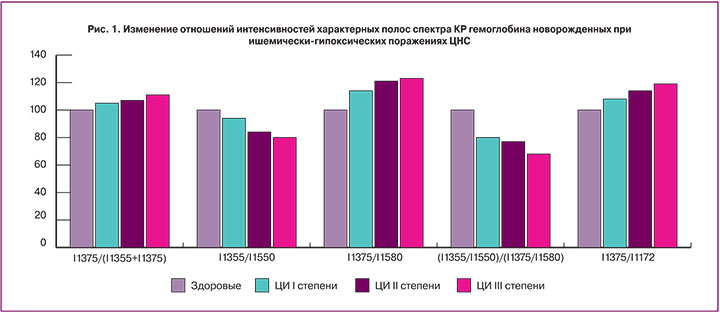
Морфологический анализ эритроцитов позволяет документировать изменение формы эритроцитов у новорожденных при ишемически-гипоксических поражениях ЦНС, что, по всей видимости, отражает частичные нарушения гемопоэза. Важнейшим патофизиологическим механизмом, лежащим в основе изменения кислород-транспортирующих свойств эритроцитов, выступает перераспределение гемоглобина в их внутреннем объеме. Как видно, интенсивность СКР, связанная с характером распределения гемоглобина, максимально изменяется у новорожденных с ЦИ III степени (рис. 2).
Полученные данные позволяют предположить, что при проведении аппаратной искусственной вентиляции легких (ИВЛ) новорожденным с тяжелой ЦИ повышение напряжения кислорода во вдыхаемой смеси будет нецелесообразным, так как гемоглобин с измененной молекулярной структурой не в состоянии будет его связывать и высвобождать. Хотя на практике для выхаживания доношенных детей, перенесших тяжелую перинатальную асфиксию/гипоксию, продолжают применять ИВЛ с достаточно высоким содержанием кислорода. Эта гипотеза подтверждена нами при анализе спектра КР у новорожденных с перинатальным поражением ЦНС ишемически-гипоксического генеза с применением газации кислорода.
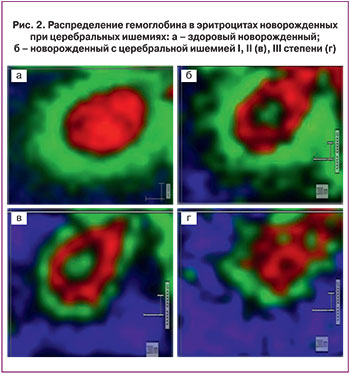
Установлено, что показатель, отражающий способность гемоглобина связывать лиганды (в первую очередь кислород), у новорожденных с ЦИ в пробах без подачи кислорода больше, чем в пробах с газацией, причем способность гемоглобина связывать лиганды уменьшается прямо пропорционально увеличению потока подаваемого кислорода. Возможно, при увеличении потока кислорода, гемоглобин им быстро заполняется, и при уже заполненных молекулах его способность связывать лиганды снижается. Следовательно, гипероксия нарушает транспортную способность гемоглобина у новорожденных.
Отношение полос в СКР, которое отражает сродство гемоглобина к лигандам, в том числе к кислороду, в пробах крови без газации выше по сравнению с пробами с подачей кислорода, и чем больше его поток, тем меньше данный показатель. Очевидно, при гипероксии изменяется конфигурация пиррольного кольца, что приводит к снижению способности гемоглобина связывать кислород (рис. 3). Поэтому детям, перенесшим тяжелую гипоксию, с развившимся в перинатальном периоде поражением ЦНС ишемически-гипоксического генеза нецелесообразно давать кислород в больших концентрациях. Эффектов, которых обычно ждут при этом клиницисты (улучшение общего состояния, показателей кислотно-щелочного равновесия, насыщения тканей кислородом и др.), не будет, а гипероксия, наоборот, приведет к «кислородному парадоксу», заключающемуся в повреждающем действии высоких концентраций кислорода на мембранные структуры после периода длительной гипоксии.
Таким образом, показатели СКР, отражающие способность гемоглобина связывать лиганды и конформационные изменения пиррольных колец (колебания метиновых мостиков), достаточно точно характеризуют структурно-функциональные свойства гемоглобина новорожденных с перинатальными ишемически-гипоксическими поражениями ЦНС и дают возможность корректировать параметры ИВЛ.
Заключение
Важнейшим патофизиологическим механизмом, лежащим в основе развития гипоксии новорожденного, является нарушение кислород-транспортирующих свойств эритроцитов за счет изменения конформационной структуры гемоглобина путем его перераспределения во внутреннем объеме эритроцитов и нарушения его функционального состояния. Тяжесть состояния новорожденных, перенесших перинатальную гипоксию, с развившимся гипоксически-ишемическим поражением ЦНС находится в корреляционной зависимости от изменений структурно-функционального состояния гемоглобина.
В опытах in vitro установлено, что газация кислорода ухудшает функциональную способность гемоглобина новорожденных, что проявляется снижением его способности связывать лиганды и ухудшением сродства гемоглобина к лигандам, очевидно, за счет изменения конфигурации пиррольного кольца. Одним из новых критериев тяжести перенесенной гипоксии может быть также изменение структурно-функциональных свойств гемоглобина, для выявления которого необходимо проводить новорожденным с тяжелой гипоксией РАМАН-спектроскопию, позволяющую более точно определить тактику оксигенотерапии у таких пациентов.



