Работа частично поддержана Государственным контрактом Министерства образования и науки РФ № 16.522.12.2009 от 29.09.2011.
Преждевременные роды являются одной из главных проблем современного акушерства и неонатологии. В настоящее время терапия угрожающих преждевременных родов является симптоматической и сводится к подавлению маточных сокращений. Однако, несмотря на появление современных токолитиков, частота преждевременных родов не снижается. Токолитическая терапия, направленная на подавление преждевременной маточной активности, способствует проведению профилактики респираторного дистресс-синдрома плода и транспортировке беременной в стационар третьей группы. Вместе с тем представляет интерес факт пролонгирования беременности, в ряде случаев до доношенного срока, после проведенного острого токолиза. В связи с этим изучение вопросов эффективности острого токолиза в плане перспективы пролонгирования беременности является актуальным аспектом современного акушерства.
Активные молекулярно-генетические исследования в области генетики человека в течение последнего десятилетия индуцировали появление новой области знаний – фармакогенетики, целью которой является изучение влияния особенностей генетики человека на эффективность лекарственных препаратов. В этой связи представляет интерес исследование молекулярно-генетической предикции пролонгирования беременности при проведении токолитической терапии гексопреналина сульфатом у женщин с угрожающими преждевременными родами с точки зрения полиморфизма генов β2-адренорецепторов как точек приложения препарата. Учитывая возрастающую роль инфекционно-воспалительного фактора, обратно пропорциональную сроку преждевременных родов, возможно предположить также влияние полиморфизма генов цитокинов. Кроме того, имеющиеся литературные данные относительно генетической природы преждевременных родов рассматривают их в целом с 22 до 366 недель. Вместе с тем логично было бы предположить различную степень участия полиморфизма генов в зависимости от классификации по сроку родов: 22–276, 28–336 и 34–366 недель беременности.

Цель исследования: изучить фармакогенетику токолитической терапии β2-адреномиметиком (гексопреналина сульфатом) на основании исследования полиморфизма генов цитокинов и β2-адренорецепторов.
Материалы и методы
Для достижения поставленной цели исследования на базе ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России и родильного дома при городской клинической больнице № 8 в период с 2010 по 2012 г. было проведено сплошное проспективное рандомизированное исследование 103 женщин с угрожающими преждевременными родами с интактными плодными оболочками в 22–336 недель беременности. Срок беременности 22–276 недель был у 46, 28–336 недель – у 57 женщин. Критериями включения в исследование служили короткая (менее 2,5 см) или сглаженная шейка матки, открытие маточного зева менее 2–3 см и схваткообразные боли внизу живота с частотой 1–2 в течение 15–20 мин, принадлежность к славянской популяции в трех поколениях, информированное согласие на участие в исследовании.
Проведенный гексопреналина сульфатом острый токолиз (в течение двух дней) в 22–336 нед беременности был эффективным во всех случаях. Далее в качестве поддерживающей терапии назначались свечи с индометацином (при сроке беременности менее 32 недель) в дозе 50 мг/сут (курсовая доза 1000 мг) и вагинальный прогестерон (утрожестан) 200 мг/сут до 34–35 недель.
В качестве потенциальных предикторов были изучены полиморфизмы 11 генов в 13 локусах (табл. 1), по данным литературы ассоциированные с преждевременными родами [1, 2].
Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 и IBM SPSS Statistics 19 for Windows. В качестве меры центральной тенденции всех количественных показателей использовали медиану (Me), в качестве интервальной оценки – нижний (0,25) и верхний (0,75) квартили. Результаты представлены Ме (0,25–0,75). Для оценки межгрупповых различий использовались непараметрические тесты: U-тест Манна–Уитни для двух независимых выборок и χ2 для сравнения частот аллелей и генотипов. Отношение шансов (OR) приведено с 95% доверительным интервалом.
Результаты исследования
С целью оценки значимости клинико-анамнестических факторов риска нами проведен сравнительный анализ среди женщин с угрожающими преждевременными родами в зависимости от срока родов: 13 (12,6%) женщин родили в сроке 22–276 недель, 34 (33%) – в сроке 28–336 недель, 22 (21%) – в сроке 34–366 недель и у 34 (33%) женщин удалось пролонгировать беременность до доношенного срока.
При сравнительном анализе клинико-анамнестических данных достоверные различия между обследованными группами были выявлены лишь в уровне образования, длительности становления менструального цикла, наличии преждевременных родов в анамнезе и истмико-цервикальной недостаточности во время беременности, которые чаще имели место среди родивших в 22–276 недель (р<0,05). Таким образом, по клинико-анамнестической характеристике и критериям включения все пациентки представляли однородную группу для оценки значимости молекулярно-генетических факторов, оказывающих влияние на эффективность токолитической терапии β2-адреномиметиками.
Нами был проведен анализ эффективности токолиза в плане пролонгирования беременности <7 дней, ≥7 дней и ≥34 недель. Все пациентки были разделены на 2 группы в зависимости от того, на каком сроке им была назначена токолитическая терапия: 22–276 недель – 46 женщин и 28–336 недель – 57 женщин. Роды, произошедшие в течение менее 7 дней от начала токолиза, нами интерпретировались как «частичный эффект» токолиза.
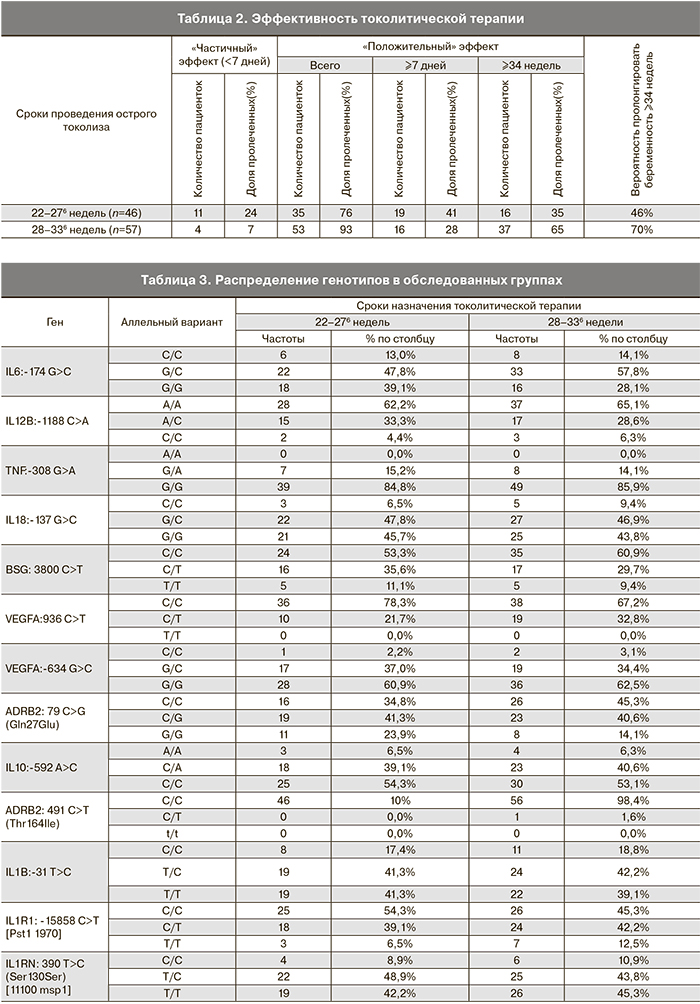
Результаты токолитической терапии приведены в табл. 2.
Как видно из табл. 2, эффективность токолитической терапии в плане пролонгирования беременности более чем на 7 дней в 22–276 недель была статистически ниже, чем в 28–336 недель: частота наступления родов менее чем через 7 дней после токолиза была более чем в 3 раза выше – у 11 и 4 женщин соответственно (24 и 7% соответственно); пролонгирование беременности более чем на 7 дней имело место у 35 женщин (76%) при токолизе в 22–276 недель и у 53 женщин (93%) при токолизе в 28–336 недель (OR=0,24 (0,07–0,81), р=0,02). Также почти в два раза ниже была вероятность пролонгирования беременности ≥34 недель (46 против 70%, OR=0,36 (0,15–0,87), р=0,03).
Результаты генотипирования обследованных женщин приведены в табл. 3. Следует отметить, что статистически значимых различий в распределении аллелей и генотипов исследуемых маркеров между группами выявлено не было.
Как видно из представленных в табл. 3 данных, отсутствие статистически значимых различий в распределении аллелей и генотипов изученных генных полиморфизмов в зависимости от срока проведения острого токолиза позволило для увеличения статистической мощности исследования проводить анализ эффективности токолитической терапии вне зависимости от срока беременности.
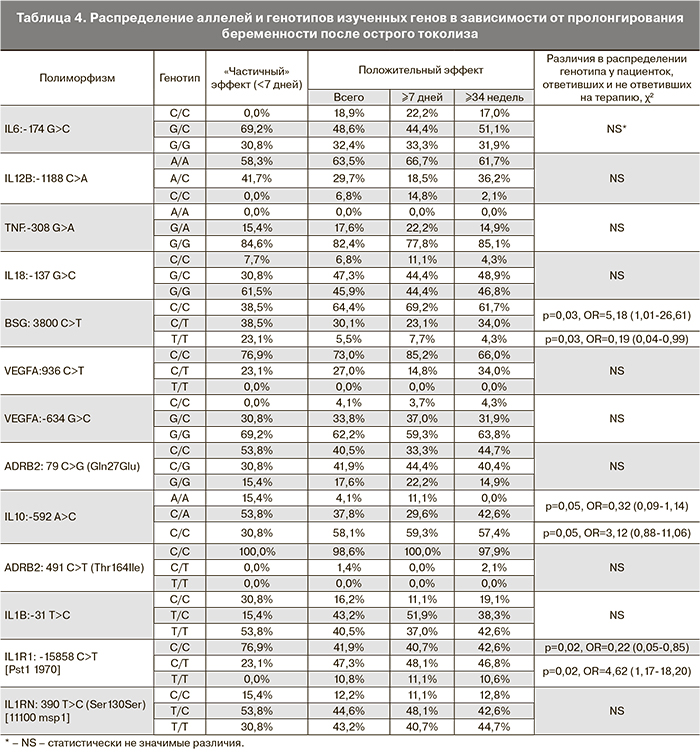
Было изучено распределение аллелей и генотипов среди пациенток. Помимо изучения распределения аллелей и генотипов нами также было проанализированы сроки пролонгирования беременности в зависимости от полиморфизмов изученных генов цитокинов и β2-адренорецепторов (ADRB2) (табл. 4).
Как видно из представленных данных, нами была выявлена ассоциация с эффективностью токолитической терапии в плане пролонгирования беременности более 7 дней для трех генов: гена BSG, кодирующего экстрацеллюлярный индуктор матриксных металлопротеиназ, и генов цитокинов IL-10 и IL-1R1, участвующих в регуляции Th1/Th2 пути иммунного ответа.
Для гена BSG наличие редкого генотипа 3800 Т/Т статистически значимо было ассоциировано с наступлением родов в течение 7 дней после острого токолиза (р=0,03, OR=5,18 (1,01–26,61) согласно аутосомно-рецессивной модели). Частота встречаемости генотипа Т/Т этого гена среди пациенток, у которых роды наступили в течение менее 7 дней, составила 23,1%, тогда как частота этого генотипа среди пациенток с пролонгированной более 7 дней беременностью была почти в 3 раза ниже (7,7%), а среди пациенток, родивших в сроки ≥34 недель – почти в 5 раз ниже (4,3%). Таким образом, согласно полученным данным, генотип Т/Т гена BSG 3800 является предиктором низкой эффективности терапии гексопреналина сульфатом у славянской популяции женщин в плане длительного пролонгирования беременности.
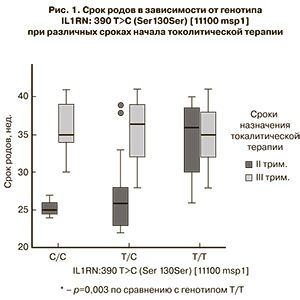 Анализ распределения аллелей и генотипов цитокинов выявил, что аллель А гена IL10:-592 A>C, согласно аутосомно-доминантной модели, был ассоциирован с низким эффектом токолитической терапии (наступлением родов в течение 7 дней после острого токолиза) (р=0,05, OR=3,12 (0,88–11,06)). В этих же случаях генотип А/А встречался в 15,3% по сравнению с 4,1% в случаях пролонгирования беременности более чем на 7 дней. При этом важно отметить, что ни в одном случае не удалось пролонгировать беременность до 34 недель. Таким образом, аллель А и генотип А/А гена IL10:-592 A>C являются предикторами наступления родов в течение 7 дней после проведения острого токолиза.
Анализ распределения аллелей и генотипов цитокинов выявил, что аллель А гена IL10:-592 A>C, согласно аутосомно-доминантной модели, был ассоциирован с низким эффектом токолитической терапии (наступлением родов в течение 7 дней после острого токолиза) (р=0,05, OR=3,12 (0,88–11,06)). В этих же случаях генотип А/А встречался в 15,3% по сравнению с 4,1% в случаях пролонгирования беременности более чем на 7 дней. При этом важно отметить, что ни в одном случае не удалось пролонгировать беременность до 34 недель. Таким образом, аллель А и генотип А/А гена IL10:-592 A>C являются предикторами наступления родов в течение 7 дней после проведения острого токолиза.
Также было выявлено, что наличие генотипа Т/Т гена IL1R1-15858 ассоциировано с эффективностью токолитической терапии, согласно аутосомно-рецессивной модели, р=0,02, OR=4,62 (1,17–18,20). У носительниц генотипа Т/Т не было отмечено ни одного случая преждевременных родов в течение 7 дней после проведения острого токолиза. Так, пролонгирование беременности более чем на 7 семь дней отмечалось у 10 женщин (10,8%) и более 34 недель – у 9 женщин, и составляло 10,6%. Эти данные позволяют считать, что назначение токолитической терапии пациенткам с данным генотипом позволит пролонгировать беременность до 34 недель почти в 100% случаев.
Важно отметить, что не было выявлено статистически значимых различий в распределении аллелей и генотипов среди пациенток, у которых применение токолитической терапии позволило пролонгировать беременность на 7 дней и ≥34 недель.
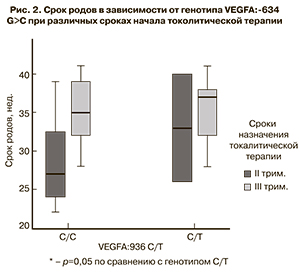
Следующим этапом исследования была попытка установить связь выявленных генотипов со сроками проведения острого токолиза: 22–276 нед (II триместр) и 28–336 нед (III триместр). Так, был выявлен статистически значимый более ранний срок родов (менее 7 дней после токолиза) у пациенток с генотипом IL1RN: 390 C/C по сравнению с генотипом Т/Т при проведении токолиза во II триместре беременности (рис. 1). При проведении токолиза в III триместре влияния данного генотипа на срок наступления родов не наблюдалось.
При проведении токолиза в 22–276 недель (II триместр) у пациенток с генотипом VEGFA:936 Т/T беременность удалось пролонгировать до срока более 34 нед, тогда как пациентки с генотипом C/C родили на 2 недели раньше (р=0,05). При начале терапии после 28 недель подобного эффекта не наблюдалось (рис. 2).
Таким образом, предикторами наступления родов в течение 7 дней после проведения острого токолиза являются генотип Т/Т гена BSG 3800 (р=0,03, OR=5,18 (1,01–26,61), аллель A гена IL10-592 (р=0,05, OR=3,12 (0,88–11,06)), а наличие генотипа Т/Т гена IL1R1-15858С>Т, напротив, способствует более длительному пролонгированию беременности (р=0,02, OR=4,62 (1,17–18,20)).
При проведении острого токолиза в 22–276 недель у пациенток с генотипом IL1RN: 390 C/C и VEGFA:936 С/С роды наступают в течение 7 дней. При остром токолизе, проведенном после 28 недель, полиморфизм генов IL1RN и VEGFA не влияет на сроки наступления родов.
Обсуждение
Исследования последних лет показали, что предрасположенность к развитию преждевременных родов может быть обусловлена взаимодействием средовых и генетических факторов [3]. Одним из важнейших факторов, традиционно относящихся к средовым воздействиям, является инфекция. Считается, что около 30% всех случаев спонтанных преждевременных родов обусловлено инфекцией, а при родах до 30 недель беременности гистологически верифицированный хориоамнионит имеет место в 80% случаев. Однако, учитывая низкую эффективность антибактериальных препаратов в предотвращении преждевременных родов, было предположено, что инфекционный агент выполняет скорее роль триггера, который запускает каскад воспалительных реакций [4]. Именно особенности течения воспалительного процесса играют основную роль в индукции преждевременных родов [5]. В то же время выявлено большое количество генных полиморфизмов, определяющих склонность к определенному варианту течения воспалительного процесса. В первую очередь речь идет о полиморфизме генов цитокинов.
 Имеются данные, что ген, кодирующий β2-адренорецептор, имеет несколько полиморфизмов, оказывающих влияние на функции рецепторов. Наиболее известные из них находятся в кодоне 16, 27 и 164 [6]. В нашем исследовании не было выявлено связи полиморфизмов гена ADRB2: 79 C>G (Gln27Glu) и ADRB2: 491 C>T (Thr164Ile) с пролонгированием беременности после проведенного острого токолиза.
Имеются данные, что ген, кодирующий β2-адренорецептор, имеет несколько полиморфизмов, оказывающих влияние на функции рецепторов. Наиболее известные из них находятся в кодоне 16, 27 и 164 [6]. В нашем исследовании не было выявлено связи полиморфизмов гена ADRB2: 79 C>G (Gln27Glu) и ADRB2: 491 C>T (Thr164Ile) с пролонгированием беременности после проведенного острого токолиза.
Нами было обнаружено, что предикторами наступления родов в течение 7 дней после проведения острого токолиза являются генотип Т/Т гена BSG 3800 (OR=5,18 (1,01-26,61) р=0,03) и аллель A гена IL10-592 (р=0,05, OR=3,12 (0,88-11,06)). Известно, что BSG (EMMPRIN) опосредует действие матриксных металлопротеиназ, усиливая их экспрессию и деградацию тканей, а аллель Т считается протекторным при преждевременном разрыве плодных оболочек в 22–276 нед беременности [7]. В то же время входящий в семейство иммуноглобулинов EMMPRIN участвует в активации иммунокомпетентных клеток и таким образом способен модулировать силу иммунного ответа. Эти данные позволяют сделать вывод, что влияние полиморфизма Т/Т гена BSG3800 на эффективность токолитической терапии, по-видимому, опосредуется через активацию иммунной системы.
Основной функцией IL-10 является супрессия дифференцировки Th1-Т-лимфоцитов и активированных макрофагов. Аллель А ассоциирован с повышенным уровнем спонтанной и стимулированной продукции IL-10 мононуклеарами крови, что в норме приводит к склонности к локальной иммуносупрессии и поляризация иммунного ответа по Th2-пути [8, 9]. Учитывая, что Th2-путь иммунного ответа является благоприятным фоном для сохранения беременности, можно предположить, что влияние данной генетической особенности на эффективность токолитической терапии опосредовано снижением резистентности к инфекционным агентам.
Нами также было выявлено, что наличие генотипа Т/Т гена IL1R1-15858С>Т, напротив, способствует более длительному пролонгированию беременности (OR=4,62 (1,17-18,20), р=0,02). По данным нашего исследования, у носительниц генотипа Т/Т не было отмечено ни одного случая преждевременных родов в течение 7 дней после проведения острого токолиза, а пролонгирование беременности до ??? 34 недель беременности имело место почти в 100% случаев. IL1R1, также известный как CD121a – рецептор интерлейкина-1 – мощного провоспалительного агента – опосредованно принимает участие в активации или подавлении функциональной активности цитокина, делая его более активным или, наоборот, ингибируя его действие за счет связывания. По-видимому, выраженный токолитический эффект при генотипе Т/Т гена IL1R1-15858С>Т ассоциирован с модулирующим действием данного цитокина на течение воспалительного ответа, что способствует пролонгированию беременности на более длительный срок.
Также было обнаружено, что при проведении острого токолиза в 22–276 недель у пациенток с генотипов IL1RN: 390 C/C (p<0,03) или VEGFA:936 С/С роды наступают в течение 7 дней. При остром токолизе, проведенном после 28 недель, полиморфизм генов IL1RN и VEGFA не влияет на сроки наступления родов. Поскольку IL1RN является мощной противовоспалительной молекулой и функционально значимый полиморфизм этого гена ассоциирован с дисрегуляцией иммунного ответа, показана связь аллеля C изученного нами полиморфизма гена IL1RN 390 T>C (Ser130Ser) с повышением уровня IL1RA [5, 9]. Являясь физиологическим иммуносупрессором, в высоких концентрациях IL1RA может снижать устойчивость организма к различным инфекционным агентам. Таким образом, носители аллеля IL1RN: 390C в большей степени восприимчивы к инфекции, которая, в свою очередь, может приводить к ранним преждевременным родам. Таким образом, дисрегуляция воспалительного ответа вследствие генетически обусловленного нарушения IL1B/IL1RN, по всей видимости, может неоднозначно влиять на течение беременности. Склонность к иммуносупрессии приводит к менее острому, но более продолжительному воспалительному ответу, хроническое течение которого вызывает длительную активацию провоспалительного цитокинового каскада и может являться причиной развития преждевременной родовой деятельности.
Помимо своего основного ангиогенного действия VEGF выполняет иммунорегуляторные функции, влияет на гемопоэз, дифференцировку и созревание дендритных клеток, а также лимфоцитов Т и В. Можно предположить, что факторы семейства VEGF помимо своих основных ангиогенных функций выполняют еще и важные медиаторные функции внутри иммунной системы. По данным нашего исследования полиморфизм гена VEGFA:936 C>T оказывает влияние на эффективность токолитической терапии при угрожающих преждевременных родах, что позволяет предположить как ангиогенный, так и иммунорегуляторный механизм действия VEGFA.
Роль инфекции в развитии преждевременных родов снижается в третьем триместре беременности, и, как следствие, снижается значимость генетически обусловленной восприимчивости к инфекционным агентам.
Заключение
Согласно полученным результатам, основным механизмом, обусловившим низкую частоту пролонгирования беременности после проведения острого токолиза в 22–276 нед, ассоциированным с полиморфизмом генов цитокинов, может являться склонность к активации воспалительного цитокинового каскада, инициируемого инфекцией. Генотипирование цитокинов может стать одним из критериев назначения токолитической терапии в плане предикции пролонгирования беременности (более 7 дней), что позволит улучшить перинатальные исходы.



