Согласно «Порядку патологоанатомического исследования биопсийного (биопсийного и диагностического) материала», утвержденному Федеральной службой по надзору в сфере здравоохранения и социального развития [1], весь биопсийный и операционный материал, а также последы и самопроизвольно выделившиеся у пациента ткани подлежат обязательному направлению на патологоанатомическое (патогистологическое) исследование.
В действующих в настоящее время стандартах специализированной медицинской помощи, утвержденных Минздравом России, также указано на необходимость проведения морфологического исследования плаценты при отеках, протеинурии и гипертензивных расстройствах во время беременности, родов и в послеродовом периоде (приказ от 07.11.2012 № 596н), при преждевременных родах (приказ от 07.11.2012 № 592н), кровотечении в последовом и послеродовом периоде (приказ от 07.11.2012 № 598н), а также при нарушениях родовой деятельности (приказ от 07.11.2012 № 591н) и при родоразрешении посредством кесарева сечения (приказ от 06.11.2012 № 583н). При этом отсутствуют стандарты ведения родов при целом ряде заболеваний и патологических состояний. А при самопроизвольных родах в затылочном (приказ от 06.11.2012 № 584н) и тазовом предлежании (приказ от 06.11.2012 № 581н) регламентировано лишь исследование (осмотр) плаценты.
Видимо, в связи с этим в ряде лечебных учреждений действует своеобразное «правило», что «нормальные плаценты» от «нормальных родов» не требуют морфологического исследования. В других медицинских организациях осуществляют отбор плацент на морфологическое исследование, руководствуясь при этом положениями, разработанными более 20 лет назад рабочей группой Американской коллегии патологов [2]. В качестве оснований для направления плацент на морфологическое исследование выделяют целый ряд обязательных (материнских, фетальных, плацентарных) и факультативных обстоятельств. При этом все другие последы рекомендуется не утилизировать сразу, а сохранять в течение нескольких дней, поскольку может возникнуть необходимость в исследовании какой-либо плаценты. Плаценты хранят в холодильнике при температуре 4°С.
Установлено, что в таких условиях ткани сохраняют свои свойства и пригодны для исследования в течение недели. То есть в течение недели хранения акушеры, неонатологи или другие специалисты могут сообщить о необходимости исследования последа в связи с выявлением или развитием каких либо осложнений.
В этой связи мы солидарны с мнением американских патологов C.M. Salafia и A.M. Vintzileos [3], которые еще в 1990 г. заявили о необходимости проведения морфологического исследования последов во всех наблюдениях, поскольку выявляемые, в частности, при микроскопии изменения плаценты могут способствовать определению причин различных осложнений беременности и родов, в том числе мертворождения, дифференциальной диагностике внутриутробных поражений плода, а также прогноза развития новорожденного и течения будущих беременностей.
Для сравнения, в Республике Казахстан в настоящее время действует постановление Правительства от 5 декабря 2011 г. № 1454 «Об утверждении Положения о деятельности организаций и (или) структурных подразделений организаций здравоохранения, осуществляющих патологоанатомическую диагностику, и Правил проведения патологоанатомического вскрытия», согласно которому патологоанатомическое исследование плаценты производится: во всех случаях мертворождения; при всех заболеваниях новорожденных, выявленных в момент рождения; при подозрении на гемолитическую болезнь новорожденных; при раннем отхождении вод и при грязных водах; при заболеваниях матери, протекающих с высокой температурой в последний триместр беременности; при явной патологии последа.
Таким образом, основной задачей традиционного патоморфологического исследования последа является выявление патологических изменений и признаков компенсаторных процессов, определяющих звенья патогенеза нарушений функционирования системы мать-плацента-плод и ряда заболеваний новорожденных.
С другой стороны, развитие современных молекулярных методов исследования, включающих молекулярно-генетические методики, протеомный анализ, определение метаболитов, ДНК/РНК, микро-РНК, уровня метилирования генов, молекул сигнальных путей, выделение синцитиальных почек, микровезикул и клеточных органелл предъявляют особые требования к образцам биологического материала.
Таким образом, отсутствие единых методических требований к пробоподготовке образцов материала, используемого для морфологического и молекулярно-генетических исследований, и определило цель настоящего обзора.
Известно, что образцы плаценты могут использоваться как для изучения этапов нормального развития плаценты, выяснения процессов метаболизма и межтканевого обмена, а также оценки влияния внешней среды и патологии матери на развитие плода.
Приступая к анализу морфологических изменений плаценты, следует отметить, что они зависят как от традиционных показателей (ее массы, зрелости, индекса массы тела плода, патологии беременности и родов, количества беременностей), так и различных факторов, связанных с состоянием здоровья матери, уровня ее благосостояния, образования, возраста, индекса массы тела. Например, высокий индекс массы тела беременной обратно пропорционален плодно-плацентарному индексу [4]. Тучность женщины сочетается с усилением процессов оксидативного стресса [5] и, как ни парадоксально, со снижением метилирования ДНК в ткани плаценты [6].
Более того, на формирование плаценты оказывают влияние лекарственные препараты, в частности, глюкокортикоиды, окситоцитин, магнезии сульфат, антигипертензивные средства, антибиотики [7], а также последствия вредных привычек, профессиональных вредностей, загрязнения окружающей среды. Так, при курении отмечается значительное снижение объема фетальных капилляров хориона, сопровождающееся утолщением мембран ворсин и повышенной концентрацией кадмия в ткани плаценты [8]. Прием алкоголя приводит к уменьшению массы плаценты, снижению ее кровотока и ухудшению доставки питательных веществ [9], что соответственно может влиять на массу плода и новорожденного. Доказана не только взаимосвязь возраста матери (чем старше женщина, тем больше масса плаценты) [10], но и возраста отца как фактора, влияющего на вес и развитие плаценты [11]. В то же время женщины, имевшие несколько беременностей, по сравнению с теми, у кого данная беременность наступила впервые, имеют больший вес плаценты независимо от пола плода [12].
При кажущейся простоте взятия материала образцов плаценты следует учитывать ряд факторов. Первое – это учет выраженности гипоксических изменений и повреждений, поскольку в силу своего функционального состояния плацента подвержена гипоксии. В свою очередь, уровень гипоксии существенным образом зависит от способа родоразрешения (гипоксия более выражена при самопроизвольных родах), а также от степени ее сдавления в полости матки, способствующего пережатию сосудов и нарушению кровоснабжения материнской кровью во время схваток [13]. Важную роль играет продолжительность родов, а также применение анестезиологических пособий. Выполнение эпидуральной анестезии приводит к снижению маточно-плацентарного кровотока, в то время как применение оксигенации уже через 2–3 минуты значительно повышает окислительно-восстановительные процессы [14, 15]. Кроме этого, кровообращение в плаценте зависит от длительности пережатия пуповины. В свою очередь восстановление кровоснабжения в участках, подвергшихся гипоксии, приводит к усилению процессов перекисного окисления липидов. При выборе места взятия образца ткани следует также учитывать, что в силу своего строения центральные и периферические участки плацентарного диска кровоснабжаются по-разному: центральные значительно выше, периферические – слабее.
Увеличение длительности периода родов сопровождается повышением в плацентарной ткани концентрации маркеров оксидативного стресса, в том числе перекисного окисления липидов, а также экспрессии антиоксидантных ферментов (каталазы, супероксиддисмутазы), что приводит к увеличению концентрации шоковых белков и активации NF-κB и р38 сигнального пути [16]. Важно отметить, что гипоксия неодинаково влияет на различные морфофункциональные показатели. Концентрация супероксиддисмутазы при нормально протекающей беременности не зависит от способа родоразрешения, однако повышается в образцах плацент у женщин, страдающих преэклампсией, только при родах через естественные родовые пути [17]. Наиболее уязвимы к гипоксии эндотелиальные клетки. Так, при самопроизвольных родах по сравнению с кесаревым сечением изменяется экспрессия маркеров эндотелия – сосудистого эндотелиального фактора роста (VEGF), плацентарного фактора роста (PlGF), концентрация PLAC1 становится ниже в 2–3 раза [18]. Гипоксию определяет также длительность родов, которая может колебаться от 5 до 15 ч. Уровень белков теплового шока 27, 70 и 90 не меняется в пределах 45 минут, в то же время развивающийся коллапс капилляров приводит к невозможности изучения образцов с помощью электронной микроскопии [12]. Показано, что под действием гипоксии значительно изменяется экспрессия различных генов, в большинстве случаев она снижается. Синтез белка является энергетически затратным процессом, поэтому гипоксия закономерно приводит к снижению трансляции [19]. В зависимости от выраженности гипоксии меняется экспрессия гистоновых деметилаз, способных изменять структуру хроматина ядер клеток [20].
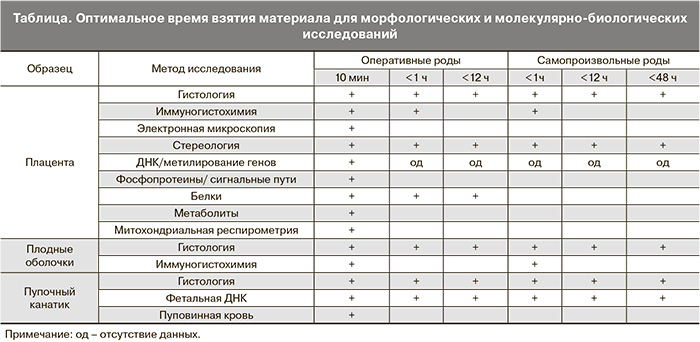
Таким образом, если для рутинного гистологического исследования пригоден материал плаценты, хранившийся в течение 48 ч при температуре 4°С, то изменения содержания метаболитов и структур внутриклеточных органелл начинаются уже через 5–20 минут после родов. В этой связи оптимальное время взятия образцов плаценты определяется в первую очередь задачей и объектом исследования (таблица).
Следует также обратить внимание, что на результаты исследований влияет загрязнение материнской кровью и микроорганизмами. Для избавления от материнской крови образцы следует промыть в РBS натрий-фосфатном буфере (PBS; от англ. phosphate buffered saline). Колонизация микроорганизмами поверхности плацентарного диска и плодных оболочек нормальной плаценты часто определяется при самопроизвольных родах. Наибольшее их количество выявляется при хориоамнионите. Установлено наличие четкой взаимосвязи между обнаружением микроорганизмов в амниотической жидкости, полученной путем амниоцентеза, и образцами ткани плаценты [21]. Однако бактерии могут выявляться в 20% наблюдений при отсутствии воспаления [21]. При гистологических признаках хориоамнионита частота выявления микроорганизмов достигает 25%, а в случаях взятия образцов взятых в стерильных условиях выявляемость микроорганизмов повышается до 50% [22].
Объектами для различных методов исследований могут быть фрагменты плацентарного диска, пупочного канатика (пуповины), плодных оболочек и плацентарной площадки, а также образцы пуповинной крови. Оценивая макроскопические характеристики плаценты, нужно помнить, что массу плаценты следует определять после отрезания внеплацентарных (экстраплацентарных) плодных оболочек и пупочного канатика (до удаления плодных оболочек и пуповины, послед следует сфотографировать с плодной и материнской поверхности с линейкой). По данным A.A. Farraj [23] разница в весе между плацентой без оболочек и с оболочками может составлять до 16%, и до 20% массы зависит от времени пережатия пуповины [24]. К концу доношенной беременности средний диаметр плацентарного диска составляет 22 см, толщина – 2,5 см, масса – 470 г. Более того, его масса может уменьшаться за счет вытекания жидкости и крови до 5% в течение 12–24 ч и на 10% спустя 48 ч после родов, а при фиксации в формалине, напротив, отмечается дополнительная прибавка в весе – около 5% [23, 24].
При рутинном морфологическом исследовании последа количество кусочков и последующие гистологические методики их окраски определяются исключительно врачом-патологоанатомом, производящим вырезку, исходя из потребностей максимальной достоверности диагностики [25–27].
В большинстве наблюдений берут следующие кусочки ткани: два кусочка из свитка оболочек (взятых возле плаценты и из места разрыва плодного мешка); два кусочка из пупочного канатика (с каждого конца, некоторые из авторов рекомендуют брать один кусочек на расстоянии 8–10 см от плаценты); два кусочка ткани плаценты во всю толщу, включающие плодную и материнскую поверхности (ряд авторов рекомендует взятие их из параумбиликальной, центральной и краевой зоны); кусочки из макроскопически измененных участков (инфарктов, кровоизлияний и др.) с захватом неизмененной ткани.
Несколько мелких фрагментов, взятых с материнской поверхности и помещенных в одну заливочную кассету, можно использовать для прицельного изучения децидуальных сосудов. Образцы ткани ворсинчатого дерева следует брать на некотором расстоянии от краев плацентарного диска, чтобы исключить изменения, обусловленные плохим кровоснабжением в краевой зоне. В эти же кусочки должны входить элементы хорионических сосудов и плодной поверхности. Рекомендуется брать хотя бы один кусочек плаценты вблизи места прикрепления пуповины.
При проведении научных исследований для обзорного микроскопического исследования визуально неизмененного плацентарного диска и сопоставления структурных изменений с данными других методов исследования рекомендуется брать не менее четырех образцов: по одному фрагменту из 4 частей (квадрантов) плацентарного диска, включающему плодную и материнскую поверхности. При этом каждый из четырех взятых фрагментов следует разделить на две части, одну из которых отправляют на морфологическое исследование, а вторую – на другие исследования, в том числе молекулярно-генетические и протеомные.
Во всех подобных случаях очень важен выбор участка для взятия образца плацентарного диска. Так, проведение гистологического исследования необходимо в первую очередь для исключения воспалительных изменений плаценты (виллузита, виллита), не определяемых макроскопически. Хорошо известно, что наличие воспалительной инфильтрации значительно изменяет большинство молекулярных показателей. В этом отношении важным дополнительным методом является микроскопическое изучение мазков-отпечатков с поверхности плаценты, в том числе на разрезе. Более точное заключение о наличии и характере инфекции может быть получено при использовании метода полимеразной цепной реакции [28].
При взятии материала для ультраструктурного и молекулярно-биологических исследований следует избегать участков с явной патологией (инфарктов, кровоизлияний, отложений фибриноида), выбранные фрагменты должны отражать по возможности общую морфологическую картину плаценты. Гистологическое исследование необходимо и для определения зрелости ворсинчатого дерева во взятом образце плаценты, поскольку практически всегда присутствует небольшая разница в зрелости ворсин в центральных и периферических участках плацентарного диска [26]. В центральной (параумбиликальной) области дольки, как правило, крупнее, чем на периферии, имеются также отличия в соотношениях различного вида ворсин и соответственно их строения [29]. Подобные различия, несомненно, следует учитывать при определении экспрессии факторов роста, медиаторов, генов, в частности VEGF, PlGF, ангиопоэтинов [30–32].
Плодные оболочки отделяют по краю плаценты, и готовят из них свиток. Для этого берется полоска оболочек шириной 10 см, крепко захватывается пинцетом у зоны разрыва, и сворачивается по направлению к зоне прикрепления к плацентарному диску. Поперечными разрезами перпендикулярно длиннику получают фрагменты свитка шириной 3–5 мм для последующего гистологического исследования. В полученном свитке место разрыва оболочек оказывается в центре, амнионом внутрь. Плодные оболочки в основном исследуют для исключения воспалительного процесса, в ряде наблюдений для оценки материнской васкулопатии [33].
При взятии материала из различных участков последа лучше использовать специальные ножи со сменными одноразовыми лезвиями, исключающими механическое сдавление и повреждение ткани. Ножницами вырезать кусочки запрещается. Толщина фрагментов не должна превышать 3–4 мм.
Взятие образца плацентарной площадки осуществляют путем пункционной или ножевой биопсии во время операции кесарева сечения или трансвагинально под контролем ультразвукового исследования до окончания родов [12, 34].
Плацентарная площадка представляет собой фрагмент миометрия из области плацентарного ложа. Материал информативен для изучения инвазии трофобласта, ремоделирования спиральных артерий, например, при преэклампсии и синдроме задержки плода [35]. При этом очень важным является правильная ориентация взятого биоптата. Рекомендуется полученный биоптат положить на фильтровальную бумагу той поверхностью, которая была обращена в полость матки, и затем аккуратно поместить в фиксирующий раствор. Материал decidua basalis можно получить при помощи вакуум-экстрактора [36].
Фиксация кусочков ткани плаценты имеет некоторые особенности. Наиболее часто используется 10% нейтральный формалин. При этом объем формалина должен превышать объем кусочков в 10–15 раз. Другим вариантом является предварительная непродолжительная фиксация ткани плаценты в жидкости Боуэна. Последняя представляет собой смесь насыщенного (1,2%) раствора пикриновой кислоты в воде, 40% формальдегида и ледяной уксусной кислоты в соотношении 15:5:1. После 1–3 ч фиксации в таком растворе ткани готовы к последующей обработке. В идеальном варианте кусочки ткани после фиксации в жидкости Боуэна следует промыть в насыщенном растворе карбоната лития. Такая процедура не обязательна, но позволяет удалить посторонние пигменты, в частности кислый гематин.
Приготовленные таким образом блоки можно использовать также и для иммуногистохимии. Важно подчеркнуть, что при фиксации кусочков метакарном (60% абсолютного метанола, 30% хлороформа и 10% ледяной уксусной кислоты) в них сохраняется ДНК [37], что позволяет при помощи лазерного микродисектора выделить необходимые участки ткани и провести microarray analisis, Western blotting, полимеразную цепную реакцию в режиме реального времени с обратной транскрипцией (PCR-RT) (от англ. polymerase chain reaction – real time).
В ряде случаев осуществляют замораживание взятых образцов тканей. Подобная методика позволяет наиболее полно сохранить антигенную структуру ткани для последующего иммуногистохимического ее исследования, в связи с чем проводят замораживание кусочков в жидком азоте при –80°С. Однако при замораживании происходят некоторые изменения архитектоники тканей и клеток.
Образцы ткани, предназначенные для исследования в просвечивающем (трансмиссионном) электронном микроскопе, должны быть объемом 1–2 мм3, а для сканирующего электронного микроскопа – объемом 2–5 мм3. Перед фиксацией кусочки можно промыть в физиологическом растворе для удаления протеинов плазмы [38]. Для ультраструктурного исследования в качестве фиксирующего раствора лучше использовать 2% глютаральдегид и 2% формальдегид, разведенный в нейтральном буфере, при этом объем фиксирующей жидкости должен в 10 раз превышать объем ткани. Продолжительность фиксации составляет 4–12 ч и зависит от размеров образца. Затем материал фиксируют в 1% растворе тетроксида осмия и заливают в эпоксидную или метилкрилатную смолу.
Кусочки, предназначенные для ультраструктурных иммуноцитохимических исследований с импрегнацией ионами золота, следует фиксировать в 2–6% формальдегиде с целью сохранении антигенных свойств ткани. Затем из них вырезают кусочек размером не более 1 мм3 и помещают в 2–6% формальдегид при 4°С не более 2 ч. Образцы для сканирующей электронной микроскопии могут храниться в фиксирующей жидкости при 4°С до достижения критической точки обезвоживания.
Молекулярно-генетические исследования могут дать весьма полезную информацию при ряде заболеваний. Так, при преэклампсии имеет место специфический профайлинг микро-РНК, в ткани плаценты снижение одних микро-РНК –181a, 584, 210, 152, и, напротив, повышение других: 10b, 218, 590, 204, 32 [39]. Однако полноценный и объективный анализ ДНК и РНК в ткани плаценты сопряжен с четким соблюдением времени взятия материала после родов (в течение 10 мин), то есть брать образцы лучше сразу после отделения плаценты, при оперативных родах. С целью сравнительного анализа содержания белков и РНК кусочки тканей следует брать из рядом расположенных участков. Технически рекомендуется вырезать фрагмент ткани плаценты размером 1–2 см, а затем делить его на небольшие порции для изучения ДНК/РНК (массой по 5 мг каждый) и белков (50 мг). Взятые образцы замораживают в жидком азоте и хранят в криоконтейнерах по 4 образца в одном флаконе: по одному кусочку из каждого из четырех квадрантов плацентарного диска, что обеспечивает репрезентативную выборку материала.
По мнению ряда исследователей, перед замораживанием до –80°С образцы можно поместить в криожидкость при температуре +4 °С на 48 ч, чтобы произошло полное ее проникновение в образец. Для анализа РНК, микро-РНК и ДНК, в том числе для определения различных возбудителей, выявляемых методом ПЦР, используют РНК стабилизирующие реагенты (RNAlater) различных фирм, которыми заливают небольшие кусочки тканей (массой до 5 мг). Универсальными стабилизирующими жидкостями как для ДНК, РНК, так и белков, являются растворы с пометкой «all protective». Расход указанного консерванта рассчитывается в соотношении 1 мл на образец, но в связи с быстрой инактивацией жидкости при контакте с материнской кровью, его количество следует увеличить, в соотношении объема образца и стабилизирующей жидкости примерно 1:10–15. Образцы необходимо поместить в данную среду в течение 10–15 мин после взятия. В дальнейшем образцы могут храниться при комнатной температуре неограниченное время, хотя длительное хранение клинического материала осуществляют в замороженном виде при –70°С. Во избежание деградации РНК, материал также можно помещать в пробирки с раствором гуанидинтиоционата.
Перспективным методом постгеномных исследований является протеомный анализ, дающий представление о совокупности белков исследуемой ткани и создающий качественно новые возможности для системных поисков молекулярных маркеров патологического процесса. Именно модификация экспрессии таких полифункциональных молекул, как белки, играет ключевую роль во всех клеточных процессах, и может служить инициирующим фактором в развитии патологии. Так, в результате протеомного анализа, проведенного с помощью двумерного электрофореза и пролетной масс-спектрометрии, при преэклампсии выявлено изменение уровней экспрессии ряда белков в ткани плаценты [40]. Залогом успешного проведения исследования является быстрое взятие (лучше сразу в операционном зале во время кесарева сечении, после отделения плаценты) образцов ткани и промывка их в PBS. Баланс метаболитов может значительно нарушаться при патологии, например, при преэклампсии и преждевременных родах имеет место изменение концентрации пуриновых оснований [41].
Фрагменты материала, предназначенные для исследования метаболитов, промывают в PBS, удаляя тем самым материнскую кровь. Затем образцы замораживают в жидком азоте при –80°С. Кусочки массой более 5 г могут быть использованы для высокоразрешающей магнитно-резонансной спектроскопии (1H и 31P MRS) [42], в то же время фрагменты меньшего размера пригодны для газовой хроматографии или пролетной масс-спектрометрии. Хранят образцы по 4 фрагмента в криофлаконах, взятые по одному из каждого квадранта плацентарного диска.
Митохондриальная респирометрия позволяет измерить потребление кислорода в присутствии различных субстратов и наиболее полно оценить функцию митохондрий [43]. Однако митохондрии очень уязвимы к гипоксии/ишемии и при неправильном выделении и хранении материала в них быстро происходят необратимые изменения. Методика криоконсервирования плацентарных ворсин с целью дальнейшего выделения митохондрий предполагает взятие материала сразу после родов. Для сохранения материала предпочтительнее замораживание образцов в операционной, а не доставка в лабораторию всей плаценты в ледяной жидкости [44]. Ткань плаценты массой около 10 мг должна быть промыта в РBS и помещена в 200 μл криоконсерванта, включающего 0,21 М маннозы, 0,07 М сахарозы, 30% диметилсульфоксид (DMSO) при PН 7.0, после чего через 30 секунд ее помещают в жидкий азот. При оттаивании клеточные мембраны становятся проницаемыми для сапонинов, позволяя оценить функцию митохондрий in situ.
В некоторых случаях необходимо выделить синцитиальные почки и везикулы. Следует учитывать, что уровень экзосом (30–100 μм), микровезикул (100–1 μм), апоптотических везикул (от 1–5 μм) (частицы отличаются друг от друга размером) снижается до нуля спустя 48 ч после родов, поэтому временной фактор в данном случае будет являться ключевым. Воздействие оксидативного стресса, к которому очень чувствительны синциальные почки, можно снизить добавлением антиоксидантов в буфер при транспортировке. Для выделения синциальных почек и пузырьков ткань плаценты берется сразу после кесарева сечения [45]. Современные методы с использованием протеолитических ферментов позволяют культивировать фибробласты, макрофаги, натуральные киллеры, клетки цитотрофобласта, эндотелия, децидуальные стромальные клетки с высокой степенью селективности, начиная с первого триместра беременности до окончания срока гестации. Для проведения культуральных исследований взятие материала плаценты необходимо осуществлять в первые 5–10 мин после оперативных родов. Для этого вырезают фрагмент материала размерами 3×3 см из центральных отделов и помещают его в среду для культивирования с антибиотиком при комнатной температуре. Клетки для селективного культивирования используются свежими, но могут быть заморожены в 10% DMSO при –80°С в жидком азоте [46].
Нередко в задачи исследования входит изучение ДНК для выявления наследственной предрасположенности, ассоциированной с акушерско-гинекологической патологией. Для создания коллекции биобанка, помимо взятия образцов плаценты, параллельно имеет значение взятие образцов биологических жидкостей: сыворотки или плазмы, представленные в замороженном или лиофилизированном виде [47]. После взятия образцы крови хранятся в течение 3 дней при 4°С или при –20–80°С в течении несколько лет. В настоящее время гепарин как антикоагулянт не применяют ввиду его ингибирующего действия на реакцию PCR и RFLP analysis (от англ. restriction fragment length polymorphism). Для создания банка ткани применяется также FTA (FAST technology analysis). Полученные образцы, созданные посредством FTA, необычайно стабильны при комнатной температуре, их можно хранить много лет. Слюна является альтернативным ресурсом ДНК ввиду простоты и доступности ее получения, хранится до 30 дней при 37°С или в течение нескольких лет при –20–80°С в промышленно изготовляемых для этого комплектах [48].
Пуповинная кровь – важный источник фетальных стволовых клеток, может служить также для определения ДНК плода. Клетки пуповинной крови являются естественным банком стволовых клеток пациента. Они хранятся неограниченно долго в замороженном виде, и могут быть использованы по мере необходимости для проведения клеточной терапии в течение всей жизни пациента [49, 50].
Важно подчеркнуть, что к каждому образцу должна прилагаться клиническая информация, включая информацию о матери и плоде.
Таким образом, патоморфологическое исследование плаценты является рутинным исследованием в диагностике, направленным на изучение этапов нормального развития плаценты, выяснения процессов метаболизма и межтканевого обмена, а также оценки влияния внешней среды и патологии матери на развитие плода. С другой стороны, развитие современных молекулярных методов исследования, включающих молекулярно-генетические методики, протеомный анализ, определение метаболитов, ДНК/РНК, микро-РНК, уровня метилирования генов, молекул сигнальных путей, выделения клеток плаценты и клеточных органелл предъявляют особые требования к образцам биологического материала.
Методика взятия и хранения образцов плаценты определяется в первую очередь задачами исследования. В этой связи необходимо параллельное морфологическое исследование участка ткани, взятого для молекулярно-биологического анализа, с целью получения объективной характеристики образца и верификации имеющихся изменений. В наибольшей степени это актуально при сборе коллекций биологического материала и создании биобанка, в котором образцы должны быть разделены по диагнозу, виду биопробы (ткань, кровь, культура клеток, ДНК) и месту (условиям) хранения, что и является основой выполнения успешных молекулярно-генетических исследований.



