Мезенхимальная дисплазия плаценты (МДП) (placental mesenchymal dysplasia) – редкая морфологическая аномалия, характеризующаяся плацентомегалией, аневризматическим расширением сосудов субхориальной зоны, их тромбозом. Стволовые ворсины при этом расширены и заполнены прозрачным студенистым веществом – такая кистозная трансформация стволовых ворсин придает плаценте вид крупных пузырьков (как виноградная лоза); при этом морфология плода сохраняется нормальной [1, 2].
Данная патология плаценты впервые была описана более 20 лет назад [3], и к настоящему времени накоплены определенные сведения об ее клинико-морфологических вариантах, диагностических критериях, тактике ведения беременности и исходах для матери и плода [1, 4–7]. Однако на сегодняшний день в клинической практике МДП по-прежнему часто ошибочно принимается за гестационную трофобластическую болезнь, и пациентам выставляется диагноз частичного или полного пузырного заноса (ЧПЗ) [1, 2, 5, 6].
При анализе литературы по освещаемой проблеме, найденной с использованием отечественных и международных (PubMed, Web of Science) поисковых систем, установлено, что частота встречаемости МДП невысока и составляет 0,02% от всех беременностей [1, 2, 4, 8], а в случаях, подозрительных на пузырный занос, МДП выявляется в 1 из 500 наблюдений [9]. Существует мнение, что истинная частота МДП неизвестна, что связано с малой изученностью данного заболевания, низкой осведомленностью патоморфологов с подобным поражением плаценты и существующими терминологическими разночтениями [4].
Отмечено, что МДП существенно чаще (до 80%) развивается при беременности плодом женского пола [5, 8, 10].
При достаточно малой распространенности описываемой патологии следует учитывать высокий риск неблагоприятных исходов беременности при МДП: повышенную частоту задержки роста плода, преждевременных родов, внутриутробной гибели плода. Неонатальные осложнения включают: гематологические нарушения (анемия и тромбоцитопения), опухоли печени, синдром Беквита–Видемана, основными признаками которого являются макросомия (71,4%) с увеличением окружности живота, макроглоссия (78,6%), нефромегалия и/или гепатомегалия (64%), водянка (50%), а у детей мужского пола – крипторхизм и/или гипоспадия (80%) [1, 5–7, 10].
Клиническое наблюдение
Пациентка Б., 32 лет, повторнобеременная, направлена в консультативную поликлинику Забайкальского краевого перинатального центра с диагнозом: Беременность 123+ недель. ЧПЗ.
Анамнез. Менструальная функция не нарушена. Гинекологические и соматические заболевания отрицает. Вредных привычек, профессиональных вредностей не имеет. Мужу 31 год, вредных привычек нет, обследован – здоров.
В 2016 г. – нормальная беременность, роды в срок без осложнений. В 2022 г. после прегравидарной подготовки наступила запланированная желанная беременность.
При 1-м пренатальном скрининге по программе «Аstraia» в 121+ недель беременности при ультразвуковом исследовании (УЗИ) обнаружена неоднородная структура хориона за счет множества анэхогенных включений различного диаметра (ячеистая структура), наибольшие 17,5 мм; толщина хориона 47,5 мм; при цветовом допплеровском картировании кровоток незначительно усилен ретрохориально. Анатомия плода не нарушена, его размеры соответствуют сроку беременности 12 недель 1 день. Дано заключение о наличии ультразвуковых признаков ЧПЗ. Величина медианы концентрации свободной бета-субъединицы хорионического гонадотропина человека (ХГЧ) составила 98,0 нг/мл (эквивалентно 2,943 МоМ, норма 0,5–2,0 МоМ), что кратно превышало значение для данного срока гестации 32,7 нг/мл и свидетельствовало о повышенной активности трофобласта [11]. Показатель медианы содержания альфа-фетопротеина (АФП) также был повышен 3,960 МЕ/л (эквивалентно 2,899 МоМ, норма 0,5–2,0 МоМ).
В пределах нормативных значений находились пульсовой индекс в маточных артериях (1,515, эквивалентно 0,926 МоМ) и среднее артериальное давление (80,166 мм рт.ст., эквивалентно 0,8897 МоМ).
Выявлены низкие риски по хромосомной патологии плода (трисомиям 13, 18, 21) и по развитию осложнений беременности (преэклампсии, задержки роста плода, преждевременных родов).
Проведены консультации врача-генетика, онкогинеколога, врачебная комиссия. Руководствуясь тем, что пузырный занос является медицинским показанием для прерывания беременности (приказ №736 Минздравсоцразвития РФ «Об утверждении перечня медицинских показаний для искусственного прерывания беременности» от 03.12.2007 г. с изменениями и дополнениями от 27 декабря 2011 г. «Класс XV. Беременность, роды и послеродовый период»), женщине предложено прерывание беременности в связи с возможным риском последующей малигнизации, который составляет 4–7,5% [12].
В соответствии с клиническими рекомендациями «Трофобластические опухоли» ID:КР80/1 (2020), учитывая наличие ЧПЗ и развивающуюся беременность, настойчивое желание женщины вынашивать беременность, отсутствие признаков малигнизации, нормальный кариотип и мужской пол плода, отсутствие пороков его развития, низкие риски хромосомной патологии и акушерских осложнений, пациентка проинформирована о возможных рисках (кровотечения в разные сроки гестации, невынашивание, патология плода и др.) и необходимости мультидисциплинарного ведения беременности (врач акушер-гинеколог, врач-онколог, врач ультразвуковой диагностики), динамического контроля состояния фетоплацентарного комплекса, уровней бета-ХГЧ, АФП, плацентарного лактогена (ПЛ) и оформлено юридическое согласие женщины на пролонгирование беременности [12].
Проведена заочная телемедицинская консультация (ТМК) со специалистами НМИЦ АГП им. академика В.И. Кулакова МЗ РФ. Выставлен диагноз: Прогрессирующая беременность 13 недель. ЧПЗ (молярная плацента) (код МКБ-10 O01.1). Заключение ТМК: с учетом представленных клинических данных и результатов обследования абсолютных противопоказаний для пролонгирования беременности нет. Признаков малигнизации пузырного заноса в настоящее время не выявлено. Аномалий развития и признаков генетических нарушений у плода не выявлено. Даны рекомендации: 1. наблюдение беременной совместно с НМИЦ АГП им. академика В.И. Кулакова МЗ РФ (либо специализированного перинатального центра по месту жительства); письменное согласие пациентки на вынашивание беременности высокого риска является обязательным; 2. еженедельный контроль сывороточного уровня общего ХГЧ до родоразрешения и в послеродовом периоде (до нормализации); 3. контроль сывороточных маркеров АФП и ПЛ – 1 раз в 4 недели до родов; 4. проведение акушерских скринингов в соответствии с установленными сроками; 5. повторный консилиум специалистов экспертного уровня: акушера-гинеколога, онкогинеколога – эксперта по трофобластическим опухолям, экспертов УЗИ, медицинского генетика по результатам второго скрининга и динамики показателей сывороточных маркеров; 6. при значительном прогрессивном росте уровня ХГЧ либо возникновении осложнений в течение настоящей беременности требуется незамедлительная повторная ТМК для определения дальнейшей тактики.
При УЗИ, проведенном при втором скрининге на 20–21-й неделе гестации, размеры плода соответствуют 19–20 неделям. Нормальная плацентарная ткань расположена больше по правой боковой стенке матки; по передней стенке структура плаценты неоднородная в виде мелкоячеистого образования толщиной 36 мм, кровоток в котором не определяется.
Заключение УЗИ беременной в 31 неделю: анатомия плода и фетометрические параметры в пределах нормы. Плацента расположена по передней стенке, выше 7 см от внутреннего зева. Структура плаценты неоднородная за счет множественных анэхогенных включений (ячеистая структура), в структуре определяется округлое гиперэхогенное образование размером 40×24 мм. Толщина плаценты 57 мм. Пуповина имеет три сосуда. При ультразвуковой допплерографии нарушений маточно-плацентарного и плодово-плацентарного кровотока не выявлено. Гемодинамика плода не изменена.
При еженедельной динамической оценке на протяжении периода гестации изначально повышенный уровень бета-ХГЧ планомерно понижался, составив 147 632,89 мМЕ/мл в 11 недель (норма 20 000–90 000 мМЕ/мл), 107 240,0 мМЕ/мл в 16 недель (норма 15 000–60 000 мМЕ/мл), достиг референсных значений 30 030,0 мМЕ/мл в 20 недель (10 000–60 000 мМЕ/мл) и продолжал снижаться, все время находясь в пределах нормативных величин: последний раз показатель исследован в 33 недели – 14 270,0 мМЕ/мл (норма 10 000–60 000 мМЕ/мл).
Величины концентраций АФП и ПЛ, определяемые 1 раз в 4 недели, напротив, имели тренд на повышение. Уровень ПЛ превышал верхнюю границу референсного интервала уже с 16 недель беременности, составив 4,68 мг/л (норма 0,3–2,8 мг/л), и сохранил эту характеристику на протяжении всего периода гестации: в 20 недель – 16,58 мг/л (норма 1,1–5,0 мг/л), в 26 недель – 8,28 мг/л (норма 2,0–7,7 мг/л).
Показатели величины концентрации АФП сыворотки крови матери в течение беременности имели разнонаправленный характер и большей частью превышали нормативные значения: в 16 недель – 58,38 нг/мл (15,4–51,1 нг/мл – здесь и далее приведены нормы метода лаборатории «Гемотест»), в 20 недель –140,3 нг/мл (норма 22–271 нг/мл), в 26 недель – 490,3 нг/мл (норма 22–271 нг/мл).
Тактика ведения беременной систематически обсуждалась и согласовывалась с врачом-онкологом и на ТМК со специалистами НМИЦ АГП им. академика В.И. Кулакова МЗ РФ. Учитывая положительную динамику в виде нормализации уровня бета-ХГЧ, отсутствие признаков малигнизации пузырного заноса, аномалий развития и признаков генетических нарушений у плода, коллегиально сделаны заключения об отсутствии абсолютных противопоказаний для пролонгирования беременности.
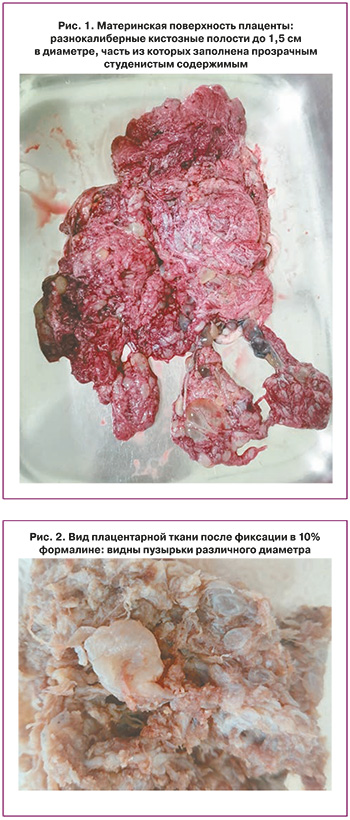
На сроке беременности 341+ недели отмечено снижение двигательной активности плода и зарегистрированы патологические типы кардиотокограммы, в связи с чем консилиумом принято решение о родоразрешении операцией кесарева сечения. Извлечен плод мужского пола с морфофункциональными признаками недоношенности массой 2090 г ростом 46 см, оценен по шкале Апгар 8–8 баллов, по шкале Ballard – 27 баллов. Наружная поверхность матки осмотрена на предмет признаков инвазивного роста пузырного заноса – изменений не выявлено, в яичниках тека-лютеиновых кист не обнаружено. При визуальной оценке плодовой поверхности плацента имеет неправильную форму (рис. 1) без характерных для пузырного заноса кист. С целью профилактики акушерского кровотечения внутривенно медленно введено Sol. Carbetocini 100 мкг, Sol. Acidi Tranexamici 1000 мг [13]. Плацента отделилась самостоятельно, увеличена в размерах: диаметр 26–27 см, толщина до 4 см, масса 720 г. На плодной поверхности определяются аневризматически расширенные множественные извилистые сосуды, в субхориальной зоне – разнокалиберные кистозные полости до 1,5 см в диаметре, часть из которых заполнена прозрачным студенистым содержимым (рис. 1–3).

При гистологическом исследовании стволовые ворсины резко увеличены в размерах, с выраженным отеком стромы, наличием в центральных зонах полостей, заполненных аморфными массами (рис. 4), в периферических зонах – кистозно-измененных сосудов с фибромышечной дисплазией стенки (рис. 5).

Строма стволовых ворсин содержит незначительное количество соединительнотканных волокон, большое количество фибробластов с наличием очагов миксоидной дегенерации и отложения фибрина. Отсутствует пролиферация клеток трофобласта и стромальных включений трофобласта. Терминальные и промежуточные ворсины хорошо васкуляризированы. Определяются признаки тромботической васкулопатии, в межворсинчатом пространстве – тромбы и избыточное отложение фибриноида. Опорные ворсины с облитерационной ангиопатией артерий, сосуды хориальной площадки толстостенные, варикозно расширены с признаками фибромышечной гиперплазии, местами тромбированы (рис. 6).

Патоморфологическое заключение: МДП.
Послеродовой период у пациентки протекал без осложнений. При проведении постнатальных инструментальных скрининговых исследований у новорожденного аномалий внутренних органов не выявлено. Ребенок находился на грудном вскармливании. Неонатальный период протекал на фоне перинатального гипоксического поражения центральной нервной системы и осложнился преходящими нарушениями углеводного обмена (гипогликемия с уровнем сывороточной глюкозы 2,3 ммоль/л в 1-е сутки жизни), неонатальной желтухой (сывороточный билирубин 209,1 мкмоль/л на 3-и сутки жизни) и умеренной анемией (уровень гемоглобина 153 г/л на 6-е сутки жизни), обусловленными преждевременным родоразрешением. По данным катамнеза, в течение 7 месяцев младенец рос и развивался в соответствии с постконцептуальным возрастом.
Обсуждение
Согласно данным современной литературы, в большинстве случаев МДП остается нераспознанной в течение всей беременности и выявляется только при исследовании последа после родов [1, 2, 4, 6–8, 10, 14]. Основным заболеванием, с которым следует проводить дифференциальную диагностику МДП, является пузырный занос, поскольку неверная диагностика последнего может повлечь за собой прерывание беременности [4]. В настоящее время специалистами обсуждается вопрос о внедрении в практику пренатального диагностического генетического тестирования для исключения ЧПЗ [6].
В представленном клиническом случае имели место сложности пренатальной дифференциальной диагностики ЧПЗ с МДП, обусловленные как сходной эхографической картиной, так и нетипичной для МДП динамикой уровня бета-ХГЧ.
Отечественные и зарубежные авторы единодушно отмечают сложности дородовой ультразвуковой дифференциальной диагностики ЧПЗ и неосложненной МДП ввиду отсутствия специфических критериев [1, 5, 6].
По данным систематического обзора Nayeri U.A. et al. (2015), при сонографическом исследовании авторы чаще всего описывали плаценту как кистозную с гипоэхогенными участками (80%), увеличенную, и/или утолщенную (50%), и/или с расширенными сосудами хориона (16%); при этом использовались такие сравнения, как «швейцарский сыр», «изъеденная молью» [14]. Данные характеристики подтверждаются и объясняются исследованиями патоморфологов, установивших, что по мере прогрессирования беременности, осложненной МДП, происходит перемещение кистозных полостей ближе к хорионической площадке, а также расширение сосудов (артерий и вен) с развитием аневризм. В связи с этим подозрение на МДП должно возникать у специалистов ультразвуковой диагностики при выявлении крупной кистозно-измененной плаценты и нормально сформированного плода [4]. В представленном нами клиническом наблюдении при сонографии плацента имела мелкокистозную структуру на ограниченном участке, что, безусловно, повлияло на поставленный диагноз.
В норме ХГЧ образуется в клетках синцитиотрофобласта плаценты, что обусловливает высокий уровень гормона при беременности. При нормальном формировании плаценты концентрация ХГЧ в плазме матери возрастает в 2 раза каждые 2 дня, достигая пика на 8–10-й неделе гестации (80 000–100 000 МЕ/л). Затем содержание гормона снижается (к 18–20-й неделе приблизительно в 2 раза) и остается на этом уровне до конца беременности. Концентрация ХГЧ зависит от количества плодов, активности трофобласта. Опухоли трофобласта следует подозревать при повышении содержания β-ХГЧ в крови более 100 000 МЕ/л [11, 12].
В соответствии с российскими клиническими рекомендациями «Трофобластические опухоли» (2020) диагностическая чувствительность уровня ХГЧ при трофобластической болезни близка к 100% [12]. В описываемом нами случае имелась не только специфическая ультразвуковая картина ЧПЗ (мелкоячеистая структура части плаценты), но и существенно превышающие нормативные значения величины концентраций бета-ХГЧ до 19 недель гестации, что нехарактерно для МДП [1, 4, 5, 7, 14] и затруднило дифференциальную диагностику.
Авторы подчеркивают, что при МДП достаточно часто (до 70%) определяется высокий уровень АФП материнской плазмы [1, 4, 7, 14], что имело место в большей части результатов исследования представленного нами клинического наблюдения. Данное явление обусловлено увеличенной площадью фетоплацентарного барьера за счет увеличения объема плаценты и количества сосудов стволовых ворсин, что приводит к повышению транспорта АФП из крови плода в кровоток матери [4, 14]. Ученые из Японии Kodera C. et al. (2021) считают, что повышенный уровень материнского АФП при нормальном уровне бета-ХГЧ можно использовать как диагностический критерий МДП [7].
К основным клиническим признакам пузырного заноса относятся влагалищные кровотечения (более 90%) и наличие двусторонних текалютеиновых кист, нередко больших размеров – 8 см и более (20–40%) [14], которые отсутствовали у нашей пациентки.
По данным систематического обзора Nayeri U.A. et al. (2015), только 9% беременностей при МДП протекали без осложнений у матерей и потомства [14]. Более половины (52–64%) беременностей заканчиваются преждевременными родами (самопроизвольными – до 33%; по медицинским показаниям – около 19–45%) с высокой частотой кесарева сечения (до 59,0%), выполняемого, главным образом, по показаниям со стороны плода [6, 7, 14]. Из перинатальных осложнений отмечена повышенная частота развития гипоксии и задержки роста плода (33–72,3%), внутриутробной гибели плода (13–40%); при этом большинство погибших плодов были без признаков задержки роста [4, 6, 7, 14, 15]. При проспективной оценке риск антенатальных потерь составил 29,4% к 24-й неделе гестации и 13% – к 36-й неделе [15]. Существует предположение, что основными причинами гипоксии и задержки роста плода при МДП являются шунтирование крови в участках сосудистых мальформаций стволовых ворсин и/или тромбоз сосудов стволовых ворсин [4]. Представленные данные литературы о высоком риске перинатальных потерь при МДП, а также результат гистологического исследования плаценты (тромботическая васкулопатия, тромбы в межворсинчатом пространстве) ретроспективно обосновывают избранную нами тактику досрочного оперативного родоразрешения пациентки при появлении признаков гипоксии плода.
Материнские осложнения (гестационная гипертензия, преэклампсия, эклампсия, HELLP-синдром) отмечены у 9–27% беременных с МДП и вносят определенный вклад в формирование высокого показателя частоты преждевременных родов [6, 14]. В настоящее время имеется ограниченное количество публикаций, посвященных особенностям течения неонатального периода у детей от матерей с МДП, в которых отмечено развитие анемии и/или тромбоцитопении (5–35%) у новорожденных [1, 6, 14], как и в описываемом нами наблюдении. Задержка развития в течение первого года жизни зарегистрирована в 7% наблюдений [6].
Заключение
Представленное клиническое наблюдение имеет благоприятный исход, поскольку, с одной стороны, ошибочно поставленный диагноз ЧПЗ не послужил основанием для прерывания беременности, а с другой – МДП, к счастью, не имела тяжелых антенатальных и постнатальных нарушений у потомства. С целью определения судьбы и тактики ведения беременности необходимы настороженность специалистов пренатальной диагностики и тщательная антенатальная дифференциальная диагностика ЧПЗ и МДП. Для стратификации рисков для матери и плода в каждом случае возникновения подозрения на ЧПЗ при УЗИ требуется мультидисциплинарный подход для детального сопоставления сонографических картин, клинических и лабораторных данных в динамике беременности.



