Основными проблемами в тактике ведения женщин с заболеваниями шейки матки (ШМ), в том числе ассоциированными с вирусом папилломы человека (ВПЧ), являются несвоевременная и некачественная диагностика, отсутствие четких алгоритмов при принятии решения, хаотичное применение неэффективных при ВПЧ лекарственных средств, недостаточная приверженность пациенток лечению, невыполнение рекомендаций врача. Между тем принципы ведения женщин при том или ином состоянии ШМ меняются вместе с новыми данными исследований [1–4].
По данным российских ученых, папилломавирусная инфекция (ПВИ) гениталий встречается у 44,3% женщин, обращающихся в гинекологические клиники, а заболевания шейки матки, ассоциированные с ВПЧ, встречаются у 50–80% женщин в течение жизни и в 99,7% случаев при подтвержденном РШМ. По оценкам Центров по контролю заболеваемости (CDC) в США, ВПЧ инфицируются до 5,5 млн человек в год. В Европе в год регистрируется 554 000 случаев заболеваний, вызванных этими вирусами, в том числе цервикальных внутриэпителиальных (интраэпителиальных) неоплазий легкой степени (CIN I), генитальных бородавок, CIN средней и тяжелой степени (CIN II и III) [3, 5–9]. В настоящее время идентифицировано более 130 различных типов ВПЧ, из них более 30 могут вызывать различные поражения половых органов. Различают 2 основных типа ВПЧ: высокоонкогенного и низкоонкогенного риска. В первую группу (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68, 73, 82 и др.) входят вирусы, приводящие к возникновению раковой опухоли. Вторую группу составляют вирусы, вызывающие доброкачественные поражения шейки матки и кондиломы (6, 11, 36, 42, 43, 44, 46, 47 и 50 и др.) [7, 10].
Как для лечения клинических проявлений ВПЧ-инфекции, так и ассоциированных с ней заболеваний (в первую очередь это касается CIN II и CIN III) применяют деструктивные и эксцизионные методы. При CIN I тактика может различаться в зависимости от величины поражения шейки матки, наличия другой патологии и мотивации самой пациентки к лечению. По этому вопросу нет единого мнения ввиду возможности регресса данного заболевания [9–11]. Общеизвестно, что физиохирургическое лечение (аблация или эксцизия) может повлечь за собой до 40% осложнений (шеечное кровотечение, стриктуры цервикального канала, экстравазаты и субэпителиальные гематомы, истмико-цервикальную недостаточность, эндометриоз и др.), поэтому тактика ведения послеоперационного периода во многом определяет исход лечения [1]. Предпринимаются попытки найти лекарственные препараты, которые могли бы повысить вероятность элиминации вируса и эффективность эпителизации ткани ШМ после деструкции. Иммунопрепараты в настоящее время за рубежом рекомендуются в стандартных схемах лечения при ведении ВПЧ-ассоциированных заболеваний гениталий [4, 6, 12–15]. К таким препаратам относятся лавомакс (системный иммуномодулятор с противовирусной активностью, активное вещество – тилорон) и локальный антисептик с ранозаживляющими свойствами депантол [2, 16–18].
Также в последние годы важна разработка адекватных методов ведения женщин с симптомами хронического цервицита на фоне эктопии цилиндрического эпителия (ЦЭ) и цитологически нормальной зоны трансформации (ЗТ). С позиций современных знаний последние относятся к нормальным кольпоскопическим картинам [9, 19], но учитывая уязвимость ЦЭ для многих инфекционных агентов, обширные эктопии даже при нормальном цитологическом мазке без признаков дисплазии могут являться серьезной клинической проблемой и быть благоприятным фоном для развития, в частности, хронического и острого цервицита. Поэтому с клинических позиций тактика ведения этой группы женщин не всегда ясна и для врача нередко сложна. Несомненно, при наличии жалоб и сочетании эктопии с симптомами цервицита следует предпринимать более активную тактику ведения. Одним из препаратов, показанных при данной ситуации, является депантол, который в соответствии с ранее проведенными исследованиями показал себя высокоэффективным ранозаживляющим препаратом, стимулирующим образование грануляционной ткани, ускоряющим эпителизацию, обладающим умеренной осмотической активностью, способствующим очищению раны, уменьшению риска вторичного инфицирования [17, 18, 20].
Изучению эффективности и безопасности указанных препаратов в составе комплексной терапии ВПЧ-ассоциированной патологии ШМ, а также в качестве монотерапии при цервиците посвящена данная статья.
Первичной целью данного исследования стала оценка эффективности комплексной терапии папилломавирусных заболеваний шейки матки с применением препаратов лавомакс и депантол в сочетании с деструктивным лечением и сравнение эффективности данной терапии с деструктивным лечением без использования этих препаратов, а также оценка эффективности консервативного лечения заболеваний шейки матки с применением препарата депантол в качестве монотерапии по сравнению с группой аналогичных пациенток без лечения.
Вторичной целью была оценка переносимости и безопасности препаратов на основе анализа нежелательных явлений.
Материал и методы исследования
Данная работа проводилось как сравнительное рандомизированное исследование с анализом клинико-лабораторных и инструментальных данных, оценивались эффективность и безопасность лечения с помощью указанных выше препаратов по сравнению со стандартной общепринятой клинической тактикой.
В исследование были включены 80 пациенток в возрасте от 18 до 50 лет (средний возраст 29,4±1,2 года), которые (согласно протоколу) соответствовали критериям включения (см. ниже), период наблюдения составил 6 месяцев.
Все пациентки перед назначением терапии (согласно протоколу) были разделены на 4 группы по 20 человек в соответствии с планом рандомизации. В 1-й группе (пациентки с ВПЧ-ассоциированными заболеваниями шейки матки, включая экзофитные и плоские кондиломы, CIN I–II) назначали комплексную терапию, включающую препарат лавомакс, который начинали принимать за 7 дней до аблации ШМ по схеме: первые 2 суток по 1 таб. (125 мг) per os, затем через день по 1 таб. (125 мг), курсовая доза 20 таб. (по 25 мг), деструктивное лечение радиоволновым методом или методом аргоноплазменной аблации (АПА) с последующим (через 2 недели) назначением препарата депантол интравагинально по 1 суппозиторию 2 раза в сутки в течение 10 дней для улучшения заживления слизистой оболочки шейки матки.

Во 2-й группе (аналогичные пациентки) было проведено только деструктивное лечение (без терапии препаратами лавомакс и депантол).
В 3-й группе проводилось консервативное лечение заболеваний шейки матки (пациентки с хроническим цервицитом на фоне эктопии и цитологически/кольпоскопически нормальной зоной трансформации) с применением вагинальных суппозиториев депантол в качестве монотерапии по схеме: 1 суппозиторий 2 раза в сутки в течение 20 дней.
В 4-й группе были аналогичные пациентки с хроническим цервицитом на фоне эктопии и нормальной зоны трансформации без лечения с возможностью пассивного наблюдения.
Критерии включения:
- Возраст от 18 до 50 лет.
- Диагностированные папилломавирусные заболевания шейки матки, подлежащие деструктивным методам лечения (включая экзофитные кондиломы, плоские кондиломы и CIN1).
- Диагностированный цервицит на фоне эктопии шейки матки и цитологически нормальной зоной трансформации с возможностью наблюдения (без терапии).
- Соблюдение указаний врача.
Критерии исключения:
- Инфекционно-воспалительные заболевания малого таза в стадии обострения, требующие назначения системной антибиотикотерапии.
- Сопутствующие ИППП – сифилис, гонорея, хламидиоз, трихомониаз, генитальный герпес (с манифестными проявлениями).
- Вульвовагинальный кандидоз (в стадии обострения).
- Бактериальный вагиноз (в стадии обострения).
- Индивидуальная непереносимость компонентов препарата.
- Наличие психического заболевания, не позволяющего проводить оценку эффективности терапии.
- Алкоголизм и наркомания в настоящее время, либо в анамнезе.
- Активный туберкулез, муковисцидоз, системные заболевания соединительной ткани.
- Злокачественные заболевания шейки матки.
- Отсутствие готовности к сотрудничеству со стороны пациентки.
Две пациентки (одна из первой и одна из второй группы) выбыли из исследования ввиду переезда на другое место жительства спустя 1 месяц после начала лечения. Таким образом, закончили исследование 78 пациенток.
На протяжении 6 месяцев наблюдения (через 0 дней и через 6 месяцев после окончания терапии) оценивались:
- динамика жалоб и клинических симптомов во всех четырех группах пациенток;
- динамика данных кольпоскопии/цитологии шейки матки во всех четырех группах пациенток;
- динамика элиминации ДНК ВПЧ по данным теста с вирусной нагрузкой и генотипирования вирусов (у пациенток 1-й группы в сравнении с пациентками 2-й группы).
Терапевтическая эффективность препарата депантол определялась в соответствии с положительной динамикой основных диагностических критериев и параметров, таких как общее состояние слизистой оболочки шейки матки визуально при осмотре и по данным кольпоскопии (цвет тканей, изменения сосудистого рисунка, зона трансформации, нарушения эпителия, наличие и форма желез, границы выявленных образований) и скорость регенерации эпителия после проведенного лечения по данным кольпоскопии (симптомы воспаления, васкуляризация эпителизирующейся поверхности, наличие рубцов или деформаций после деструкции), а также улучшение клинических симптомов и цитологическая картина мазков с ШМ. Терапевтическая эффективность препарата лавомакс в комплексе с депантолом (1-я группа) определялась положительной динамикой результатов лабораторного исследования на ВПЧ высокого и низкого канцерогенного риска, данными цитологии и кольпоскопии после аблации.
Статистическая обработка полученных данных осуществлялась по общепринятым методикам с помощью пакетов прикладных программ SPSS .15, Microsoft Excel 7.0. Числовые показатели, имеющие нормальное распределение, изменяющиеся в динамике, оценивались с помощью критерия Стьюдента. В случае отсутствия нормального распределения применялся непараметрический критерий Уилкоксона. Для определения различий между порядковыми показателями (%) использовали критерии χ2 и точный критерий Фишера для малых выборок. Различие между сравниваемыми величинами признавалось статистически значимым при р<0,05.
Результаты исследования
До начала терапии наиболее частыми жалобами пациенток всех групп были: межменструальные кровяные выделения мажущего характера, периодические выделения из половых путей с неприятным запахом. Подавляющее большинство женщин во всех группах исследования (74%) активных жалоб не предъявляли.
При гинекологическом осмотре у всех пациенток отмечались аномальные кольпоскопические картины слизистой оболочки шейки матки той или иной степени выраженности либо сомнительные картины, которые приходилось дифференцировать между нормой и патологией (3-я и 4-я группы пациенток). При лабораторной диагностике у всех пациенток 1-й и 2-й групп был обнаружен ВПЧ высокого и низкого канцерогенного риска согласно методу ПЦР. У пациенток 3-й и 4-й групп на фоне симптомов цервицита, эктопии ВПЧ выявлялся почти у каждой четвертой пациентки, при этом разницы в частоте между двумя группами отмечено не было (р>0,05).
В 1-й визит проводили: анализ критериев включения/исключения, сбор анамнеза, данных сопутствующей терапии, стандартное гинекологическое обследование, оценку данных кольпоскопии, ПЦР и цитологии, получали информированное согласие на участие в исследовании, назначали дополнительное обследование для уточнения соответствия требованиям протоколу.
Второй визит проводили в первой группе с целью проведения деструктивного лечения и назначения консервативной терапии, во второй группе – с целью проведения аблации.
Третий визит проводили через 1 месяц для пациенток всех групп от окончания курса лечения либо от момента АПА или консультации при втором визите.
Четвертый визит проводили с целью окончательной оценки эффективности через 6 месяцев (180±10 дней) после окончания соответствующей терапии в первых трех группах, в 4-й группе – через 6 месяцев наблюдения после первого визита.
Всем женщинам перед проведением аблации проводили прицельную биопсию ШМ с гистологическим подтверждением диагноза. По гистологическим данным у 3 и 2 пациенток 1-й и 2-й групп соответственно была диагностирована CIN II при наличии зоны трансформации (ЗТ) 1–2-го типа, что не исключило возможности радиоволновой аблации. У 3 и 4 пациенток 1-й и 2-й групп соответственно диагностированы экзофитные кондиломы, у остальных пациенток гистологическая картина соответствовала CIN или плоской кондиломе ШМ. Значимой разницы в гистологическом заключении между двумя группами не было обнаружено (P>0,05). 17 и 18 пациенткам 1-й и 2-й групп соответственно с диагнозом CIN I, плоские или экзофитные кондиломы, проведена аргоноплазменная аблация на 4–8-й день менструального цикла с выдачей стандартных рекомендаций по гигиене.
Критериями положительной динамики были: исчезновение клинических проявлений ВПЧ-инфекции и цервицита, улучшение кольпоскопической картины, нормализация цитологического исследования, достижение элиминации ДНК ВПЧ в мазках по данным ПЦР в реальном времени, динамика уменьшения вирусной нагрузки (количественный формат определения вирусов папилломы человека).
Безопасность и переносимость исследуемой терапии оценивали на основании анализа частоты возникновения неблагоприятных явлений у всех наблюдаемых женщин.
При интерпретации результатов использовали стандартные методы сравнительного анализа и описательной статистики.
Динамическое наблюдение за пациентками показало значительное уменьшение числа жалоб на бели и дискомфорт в области гениталий с момента начала терапии по сравнению с пациентками второй группы (табл. 1). Ни одна из пациенток 1-й группы к концу наблюдения не предъявляла активных жалоб.
У пациенток 3-й группы отмечено выраженное уменьшение числа жалоб (с 30 до 5%) по сравнению с пациентками 4-й группы, где данный показатель практически не менялся (табл. 2).
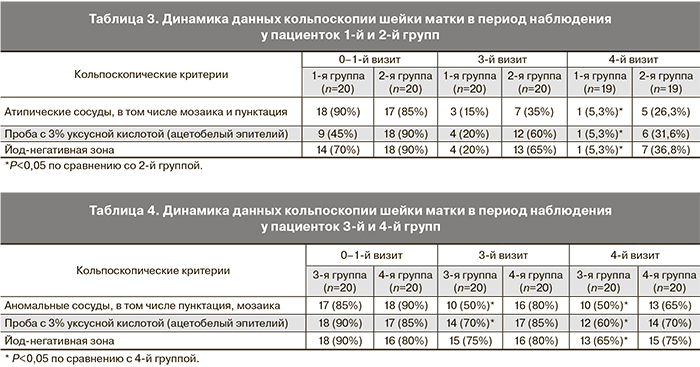
Кольпоскопически у всех пациенток 1-й и 2-й групп выявлены аномальные картины в виде ацетобелого эпителия грубого и нежного, мозаики и пунктации грубых и нежных, атипических сосудов, йоднегативных зон. Наличие признака и его степень выраженности оценивались в динамике наблюдения до и после лечения. У всех пациенток зона трансформации визуализировалась полностью (ЗТ 1-й и 2с тип), что позволило всем участницам исследования согласно международным рекомендациям предложить терапию в виде аблации ШМ [9, 11, 21]. В начале исследования в 1-й группе атипические сосуды, в том числе мозаика и пунктация шейки матки, выявлены у 90% женщин, ацетобелый эпителий – у 45%, йоднегативная зона у 70%. При оценке динамики кольпоскопической картины через 6 месяцев исследования эти цифры составили: 5,3%, 5,3%, 5,3% соответственно.
В целом у пациенток первой группы общая кольпоскопическая картина была значимо лучше, чем во второй группе на каждом визите наблюдения, что отражено в табл. 3.
У пациенток 3-й и 4-й групп на фоне признаков воспаления (гипертрофии ШМ, неровности рельефа, характерной пятнистости, крапчатости, неравномерной реакции на раствор Люголя) в большинстве случаев имели место признаки нормальной ЗТ на фоне эктопии различных размеров. На протяжении наблюдения у женщин 3-й группы улучшение кольпоскопической картины было более выражено по сравнению с пациентками 4-й группы, у которых при проведении контрольной кольпоскопии по окончании наблюдения положительная динамика наблюдалась лишь в единичных случаях. Кроме этого у пациенток 3-й группы в период наблюдения отмечено уменьшение площади эктопии за счет активации метапластических процессов, что можно объяснить регенерирующим эффектом депантола на фоне адекватной санации (табл. 4).

У всех пациенток 1-й и 2-й групп перед исследованием были выявлены высоко- и низкоонкогенные типы ВПЧ в клинически значимой концентрации, которая определялась методом ПЦР в условных единицах (lg). При оценке учитывалась клинически значимая концентрация – более 3,0 lg, при этом тест считался позитивным при показателе, превышающем 3,0 lg, отрицательным при показателе ниже 3,0 lg. На протяжении периода наблюдения у пациенток 1-й группы по сравнению со 2-й наблюдалось более выраженное снижение концентрации вируса (ВПЧ-ВР на момент начала исследования составлял 90%, а в конце 36,8%, во 2-й – 85 и 52,6% соответственно; низкого канцерогенного риска в начале исследования в 1-й группе – 45%, в конце – 15,8%, во 2-й группе 50 и 26,3% соответственно). Элиминация ВПЧ произошла достоверно чаще в 1-й группе по сравнению с визитом 1 и по сравнению со 2-й группой на одном (4-м) визите (p<0,05) табл. 5).
Результаты генотипирования показали, что только у 3 из 7 женщин 1-й группы, инфицированных ВПЧ-ВР, через 6 месяцев персистировал первоначальный тип ВПЧ (у двух – 16-й тип и у одной – 45-й), у остальных отмечалась реинфекция другими типами, что можно также расценивать как элиминацию первоначального агента. Во 2-й группе на 4-м визите из 10 инфицированных женщин у 8 сохранялся первоначальный тип вируса, что свидетельствует о персистирующем течении инфекции, на сегодняшний день считающемся прогностически более неблагоприятным [7].
Во всех группах проводился цитологический контроль, результаты которого представлены в табл. 6 и 7. Сегодня одним из наиболее важных динамических критериев эффективности любого лечения ШМ является положительная в отношении дисплазии или воспалительного процесса цитологическая картина. В начале наблюдения почти у всех пациенток 1-й и 2-й групп цитологически была заподозрена дисплазия или имелись признаки ВПЧ-инфекции. Гистологически диагноз был подтвержден перед принятием решения об аблативном лечении. У пациенток первой группы после лечения отмечалась стойкая нормализация цитологического мазка, ни у одной из женщин не было патологических изменений. У одной пациентки второй группы после проведенного АПА на 3-м визит был мазок, соответствующий LSIL, а на момент контроля через 6 месяцев у двух пациенток 2-й группы цитология соответствовала LSIL, что свидетельствовало о персистенции инфекции и неэффективности терапии.
Цитологические или бактериоскопические признаки хронического цервицита были подтверждены у 100% женщин 3-й и 4-й групп. Выраженная положительная цитологическая динамика отмечалась у пациенток 3-й группы, получающих в качестве монотерапии депантол. Уже на третьем визите у пациенток 3-й группы цитологические признаки хронического цервицита были отмечены лишь у 15%, а на момент контроля мазка через 6 месяцев – только у 10%. Заметной положительной динамики у пациенток 4-й группы не отмечено. На третьем визите признаки цервицита сохранялись у 95%, а при контрольном цитологическом исследовании – у 80%.
Пациентки, получавшие лечение препаратами лавомакс и депантол, в целом не отмечали субъективного дискомфорта и возникновения побочных реакций. Побочное действие в виде аллергической реакции, зуда, жжения, отмечено лишь у одной пациентки после приема лавомакса, прошедшее после отмены препарата, а также жжения у одной пациентки на 18-й день применения депантола (5%).
Ни одна женщина не была исключена из исследования в связи с непереносимостью терапии.
Обсуждение
Результаты проведенного исследования подтверждают общие эпидемиологические данные о факторах риска ВПЧ-ассоциированной патологии у женщин, а также о бессимптомности их течения в более чем половине клинических наблюдений. Это обусловливает необходимость скрининговых исследований.
В рамках данного исследования для пациенток с ВПЧ-ассоциированной патологией CIN II и менее была рекомендована тактика радикальной физиохирургической аблации экзоцервикса с захватом нижней трети цервикального канала. У пяти пациенток с CIN II выполнена более глубокая аблация (глубина 0,7–0,9 см) с помощью радиоволнового электрода, остальным 35 пациенткам проведена аргоноплазменная аблация (АПА) в соответствии с международными рекомендациями ведения женщин с подобными диагнозами, поскольку у всех диагностирована ЗТ 1-го и 2-го типов, и расхождений между разными методами исследования обнаружено не было.
Однако, по данным литературы, частота рецидивирования ВПЧ-инфекции после аблации практически сопоставима с таковой при наблюдательной тактике [1, 9, 22], поэтому назначение в период аблации дополнительной терапии в виде иммуномодулирующего и ранозаживляющего препарата после аблации обосновано [1, 2, 4, 11, 13, 23].
Исследования показали, что лавомакс стимулирует синтез всех 3 типов интерферонов в организме, активизирует клеточные иммунные механизмы, которые в совокупности прерывают размножение различных вирусов и других внутриклеточных агентов в инфицированных клетках или вызывают гибель и способствуют элиминации возбудителей из организма. Синтез интерферонов при введении лавомакса (пик продукции ИНФ (интерферон) в крови определяется через 4–24 часа после приема препарата), сбалансирован и контролируется организмом [4, 16]. Считают, что отличительной особенностью лавомакса как индуктора интерферона является способность вызывать длительную циркуляцию в крови терапевтических доз ИФН, которые предотвращают инфицирование незараженных клеток и создают барьерное антивирусное состояние, подавляющее синтез вирусоспецифических белков и внутриклеточное размножение ВПЧ. Более того, индукцию эндогенного ИФН можно рассматривать как физиологический механизм ИФН-генеза [23]. В отечественной литературе присутствует ряд публикаций, показавших эффективность препарата лавомакс таблетки при различных вирусных инфекциях, хламидиозе и др. 2, 16–18, 20]. Схема применения при вирусных инфекциях варьирует, но в данном исследовании женщинам 1-й группы рекомендовали прием препарата лавомакс за 7 дней до аблации в следующем режиме: первые двое суток по 1 таблетке, затем по 1 таблетке через день, курсовая доза 20 таблеток.
Затем после аблации для стимуляции эпителиазации рекомендовали депантол, комбинированный отечественный препарат для местного применения, оказывающий антисептическое (противомикробное и противопротозойное), регенерирующее, метаболическое действия. Препарат состоит из декспантенола 0,1 г и хлоргексидина биглюконата раствора 20% 0,0852 г. Как известно, хлоргексидин активен в отношении грамположительных и грамотрицательных бактерий: Treponemapallidum, Chlamidiaspp., Ureaplasmaspp., Neisseriagonorrhoeae, Gardnerellavaginalis, Bacteroidesfragilis; простейших Trichomonasvaginalis, не нарушает функциональную активность лактобацилл. Декспантенол – провитамин В5, производное пантотеновой кислоты – эффективный стимулятор процессов регенерации тканей, нормализует клеточный метаболизм, ускоряет митоз и увеличивает прочность коллагеновых волокон. Пантотеновая кислота как компонент коэнзима А (кофермента А) присутствует во всех живых тканях, участвует в процессах ацетилирования и окисления, углеводном и жировом обмене, цикле трикарбоновых кислот, в синтезе ацетилхолина глюкокортикостероидов, порфиринов, нормализует клеточный метаболизм. Считается, что декспантенол также оказывает слабое противовоспалительное действие и способствует росту эпидермиса – верхнего слоя кожи, восстановлению слизистой оболочки. Его гидрофильность и низкая полярность делает возможным медленное и глубокое проникновение в кожу и слизистые оболочки. За счет стимуляции процессов миграции эпителиальных клеток под воздействием декспантенола происходит более ранняя реэпителизация раневой поверхности, cнижается риск инфекции. При местном применении декспантенол быстро абсорбируется и превращается в пантотеновую кислоту, а также хорошо проникает в пораженную ткань 1]. В отечественной литературе имеются публикации, показавших эффективность депантола при различных травмирующих агентах [17, 18, 20, 24] и для стимуляции эпителизации ШМ после деструктивных воздействий [24].
В данном исследовании установлено статистически достоверное повышение эффективности терапии препаратами лавомакс и депантол в сочетании с аблацией ШМ по сравнению с таковой в группе монотерапии аблацией. Так, у пациенток, которым был проведен курс терапии препаратом лавомакс до проведения аблации, а после (через две недели) лечение депантолом, достоверно чаще удавалось добиться элиминации ВПЧ по данным исследования ПЦР, исчезновения клинических проявлений и улучшение цитологической картины (P<0,05). Зачастую после осуществления деструктивных методов лечения врач сталкивается с проблемой длительного заживления шейки матки, особенно на фоне факторов риска, поэтому вопросы стимуляции регенерации многослойного плоского эпителия шейки матки после деструктивных методов воздействия с помощью препарата депантол представляют значительный интерес для практических врачей. Оперативные вмешательства на шейке матки требуют проведения комплекса мероприятий, направленных на предотвращение развития различного рода воспалительных осложнений и на ускорение процессов эпителизации. Эти результаты согласуются с данными, полученными Л.И. Мальцевой, О.Г. Пекаревым, М.С. Селиховой и др. [17, 18, 20]. Более высокая эффективность комбинированного метода лечения объясняется коррекцией имеющегося иммунологического дефицита у больных ПВИ и создает предпосылки для дальнейшего изучения положительных эффектов иммунотропной терапии.
Применение препарата лавомакс в период деструктивного лечения заметно уменьшает вирусную нагрузку благодаря стимуляции образования в организме α-, β-, γ-интерферонов. Лавомакс обладает иммуномодулирующим и противовирусным эффектом, стимулирует стволовые клетки костного мозга, в зависимости от дозы усиливает антителообразование, уменьшает степень иммунодепрессии, восстанавливает соотношение Т-хелперы/ Т-супрессоры [25], которые нарушаются в процессе манифестации ВПЧ инфекции [15, 26–28].
Особую клиническую значимость сегодня имеет проблема хронических вялотекущих цервицитов, протекающих на фоне обширных эктопий ШМ, сопровождающихся большой площадью незрелого метапластического эпителия с нормальной с позиций дисплазии зоной трансформации. При данном состоянии женщины нередко предъявляют жалобы на обильные бели, дискомфорт, зуд и жжение в области вульвы и влагалища. Хронические цервициты могут беспокоить женщину на протяжении месяцев и даже лет. Такие пациентки нередко обращаются к разным врачам, неоднократно получают антибактериальную терапию, при этом спектр выявляемых возбудителей может изменяться. Однако фоновое воспаление значительно замедляет процессы метаплазии при эктопии, формирующийся новый плоский эпителий незрелый и уязвимый, что способствует инфицированию и манифестации дисплазии ШМ. В данной ситуации целесообразно назначение антисептика с позитивным влиянием на эпителий [3, 21].
Известно, что вагинальные суппозитории депантол, содержащие в своем составе антисептик хлоргексидин и стимулятор регенерации декспантенол, обычно рекомендуются к применению после деструктивных методов лечения шейки матки. Это позволяет одновременно проводить профилактику инфекционных осложнений после вмешательства, сокращать сроки лечения и повышать качество жизни пациенток. Сравнительное наблюдение за пациентками 3-й и 4-й группы с цервицитом/эктопией в течение 6 месяцев показало, что по совокупности показателей (динамика жалоб, кольпоскопическая картина, цитология) имеются основания отметить позитивный эффект депантола при его назначении женщинам с цервицитом/эктопией в течение 20 дней. У женщин 3-й группы после лечения препаратом депантолом жалобы достоверно редуцировались по сравнению с пациентками 4-й группы, где данный показатель практически не менялся, кольпоскопическая картина улучшилась у 70 против 15% соответственно, цитологическая картина свидетельствовала об улучшении в 90% случаев против 20% соответственно.
Выводы
Пациенткам с вирус-ассоциированными заболеваниями шейки матки целесообразно включение в традиционные схемы лечения препаратов лавомакс (за 7 дней до деструктивного лечения заболеваний шейки матки по 1 таблетке (125 мг) первые двое суток, а затем через день в той же дозировке – курсовая доза 20 таблеток по 125 мг), а также через 14 дней после деструкции – препарата депантол по 1 свече 2 раза в сутки в течение 10 дней. Женщинам с хроническими вялотекущими цервицитами, протекающими на фоне эктопии с обширной зоной трансформации без признаков дисплазии, целесообразно назначение депантола по схеме: 1 суппозиторий 2 раза в день в течение 20 дней.



