Согласно последним статистическим данным рак шейки матки (РШМ) продолжает занимать лидирующие позиции в структуре женской онкологической заболеваемости. Только за 2020 г. в Российской Федерации было выявлено более 15 тыс. новых случаев РШМ [1]. При этом наибольший удельный вес заболеваемости приходится на женщин репродуктивного возраста – 30–34 лет. Эти данные согласуются и с общемировой тенденцией. Так, в рекомендациях Всемирной Организации Здравоохранения (ВОЗ) 2021 г. сообщается о том, что в 2020 г. рост заболеваемости РШМ составил 6%, а смертности – 9% по сравнению с 2019 г. [2].
Как известно, основным этиологическим фактором развития РШМ является вирус папилломы человека (ВПЧ). В настоящее время считается, что практически в 100% случаев РШМ ассоциирован с ВПЧ [3]. Рак шейки матки – один из немногих видов рака, для которого существуют рекомендации по скринингу среди населения. Скрининг РШМ обладает высокой эффективностью в силу длительного периода предраковых заболеваний, возможности эффективного их лечения и наличия достаточно чувствительных и специфичных методов диагностики. Так, в рамках скрининга РШМ наравне с цитологическим методом исследования применяется и тестирование на ВПЧ.
На сегодняшний день в мире выявлено более 200 генотипов ВПЧ, которые принято делить на 2 категории: ВПЧ высокого и низкого канцерогенного риска. Согласно российским клиническим рекомендациям к ВПЧ высокого канцерогенного риска (ВПЧ ВКР) относятся 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 генотипы [4]. Разные генотипы ВПЧ характеризуются разной распространенностью как в структуре заболеваемости предраковыми заболеваниями шейки матки – HSIL (плоскоклеточные интраэпителиальные поражения высокой степени), так и среди плоскоклеточных интраэпителиальных поражений легкой степени – LSIL. Так, по данным разных авторов 16, 18, 31, 33, 52 генотипы ВПЧ встречаются значительно чаще и ассоциируются с более агрессивным течением по сравнению с остальными типами ВПЧ [3, 5–7]. При этом также следует отметить, что до 70% РШМ во всем мире вызывается ВПЧ 16 и 18 типов [8]. В крупном систематическом обзоре и метаанализе M. Farahmand et al. (2020), включающем в себя 62 статьи и данные 21 402 пациенток, было проведено изучение распределения генотипов ВПЧ среди женщин преимущественно африканского и азиатского регионов [8]. Обращает на себя внимание широкая диагностическая панель, включающая 52 генотипа ВПЧ (рис. 1).
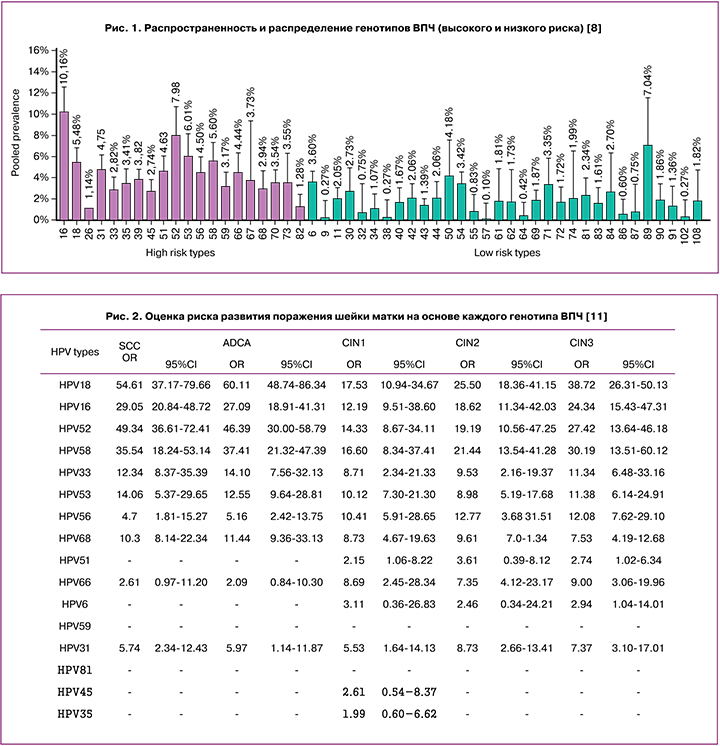
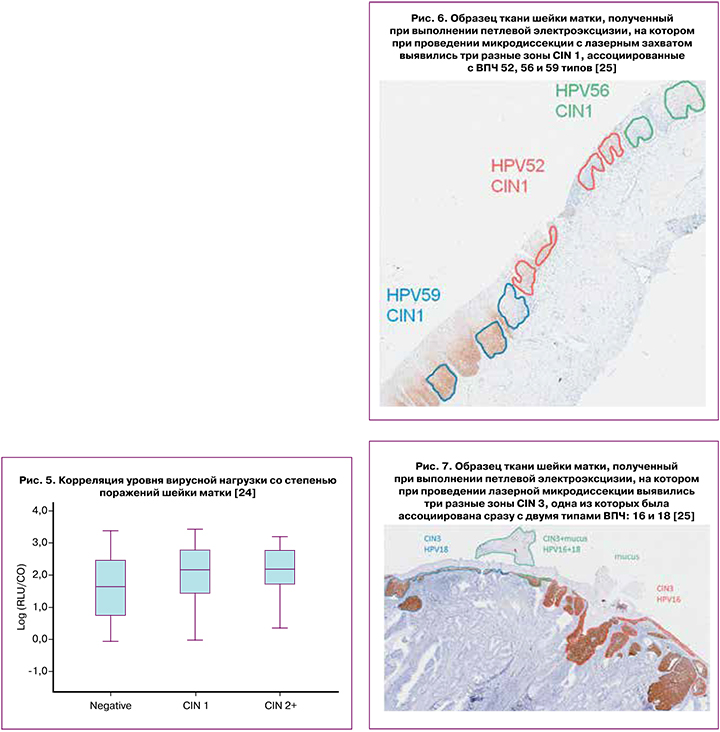
Так, среди ВПЧ высокого канцерогенного риска наиболее распространенными типами явились 16 (10,1%), 52 (7,9%), 53 (6,0%), 58 (5,6%), 18 (5,4%) и 31 (4,75%); ВПЧ низкого канцерогенного риска так же часто наблюдались, и среди них наиболее часто выявляемыми были 89 (7,0%), 50 (4,1%), 6 (3,6%), 54 (3,4%) и 71 (3,3%) типы ВПЧ [8]. Эти данные согласуются с результатами недавно опубликованного систематического обзора A. Seyoum et al. (2022), где также отмечается особая роль 16, 18 и 52 типов ВПЧ в общей структуре распространенности ВПЧ. Показано, что среди 3 075 пациенток из 19 стран африканского континента 16 генотип ВПЧ был обнаружен в 13,8% всех случаев, 52 – в 9,9%, а 16 – в 9,0% [9]. Генотипирование ВПЧ является чрезвычайно важным в силу того, что даже среди группы высокого канцерогенного риска такие типы ВПЧ как 16, 18, 52, 31 ассоциируются со значительно менее благоприятным прогнозом в отношении предраковых поражений шейки матки и РШМ по сравнению с 33, 39, 45, 56 генотипами [10]. Так, исследование X. Wang et al. (2018) показало, что среди 1867 случаев выявленных SIL (плоскоклеточных интраэпителиальных поражений), ассоциированных с положительным ВПЧ-тестом, в случаях с диагностированным CIN 3 (n=714) и CIN 2 (n=625) доминировали 16 и 18 генотипы ВПЧ. При этом в случаях с диагностированным CIN 1 (n=528) преобладали 33, 53, 56, 68 и 45 генотипы [11]. Наблюдая за 2968 случаями с выявленным одним или несколькими типами ВПЧ, авторы произвели расчет риска развития поражения шейки матки от CIN 1 до плоскоклеточного рака, на основе которого пришли к выводу, что наиболее канцерогенными типами ВПЧ являются 16,18, 52 и 58 (рис. 2).
Нередко наряду с выявлением одного типа ВПЧ в ряде случаев в клинической практике выявляется несколько типов ВПЧ, частота встречаемости которых может достигать 25% [12]. В настоящее время в мировой литературе представлены достаточно противоречивые данные о роли выявления нескольких выявленных типов ВПЧ в структуре развития поражений шейки матки. Однако результаты многих недавно опубликованных работ свидетельствуют о том, что выявление нескольких генотипов ВПЧ не сопряжено с более высоким риском развития тяжелых поражений шейки матки [13, 14]. Кроме того, в ряде работ представлены данные, на основании которых авторы делают вывод о том, выявление нескольких типов ВПЧ коррелирует со значительно меньшим риском прогрессии SIL по сравнению с ПВИ, ассоциированной с одним генотипом [15]. Так, в исследовании M. Bruno et al. (2020) проводили сравнительный анализ результатов прицельной биопсии шейки матки 360 пациенток с выявленным одним типом ВПЧ и 287 пациенток с двумя и более типами ВПЧ. Согласно результатам гистологического исследования обнаружение нескольких типов ВПЧ ассоциировалось с CIN 1 у 60,4% женщин, с CIN 2 – в 43,7%, с CIN 3 – в 22,1% (рис. 3). Важно отметить, что не было выявлено ни одного случая РШМ с несколькими типами ВПЧ.

При этом также проводился анализ выявленных типов ВПЧ в случаях с CIN 3, ассоциированных с несколькими типами ВПЧ. Проанализировав полученные данные, авторы обнаружили, что два типа ВПЧ выявлялись у 82,6% женщин и три типа ВПЧ у 17,4% женщин с CIN 3. Таким образом, среди всех случаев CIN 3 не было ни одного, ассоциированного с более чем 3 генотипами ВПЧ [16].
Однако следует отметить, что ВПЧ – мультифакторный предиктор развития плоскоклеточных интраэпителиальных поражений шейки матки. Иными словами, для верной интерпретации положительного ВПЧ-теста недостаточно знать лишь выявленный генотип [17, 18]. Не менее важным фактором ВПЧ-инфекции является выявляемость типов ВПЧ в зависимости от их территориальной принадлежности. В настоящее время внимание многих исследователей обращено на то, что позиция в структуре поражений HSIL и LSIL, а также общая распространенность среди населения одного и того же генотипа ВПЧ существенно варьирует от региона к региону [19]. Так, в недавно опубликованном систематическом обзоре C. Xia et al. (2021) приводятся данные, демонстрирующие, что разница в канцерогенных свойствах и встречаемости одних и тех же типов ВПЧ существует даже в пределах разных административных субъектов внутри одной страны. На примере проведенного в Китае исследования, в которое были включены данные 700 728 женщин, авторы показали, что встречаемость 16 генотипа ВПЧ варьировала от 1,71 до 8,5% в зависимости от региона страны, 52 генотип – от 0,66 до 5,8%, а 18 генотип – от 0,26 до 2,8%. Наиболее значимой явилась разница в структуре заболеваемости LSIL, HSIL и РШМ: в зависимости от исследуемого региона встречаемость ВПЧ 16 генотипа у женщин с LSIL варьировала от 4,7 до 34,3% всех случаев, с HSIL – от 15 до 60%, с РШМ – от 27,3 до 83,7%. Также авторы обратили внимание на то, что в ряде регионов до 50% всех выявленных случаев LSIL и до 20% случаев HSIL были ассоциированы с ВПЧ низкого онкогенного риска [20]. Таким образом, для более точной оценки риска развития и прогрессии SIL необходимо располагать данными и о территориальных особенностях распределения ВПЧ.
Как известно, ВПЧ обладает способностью к самоэлиминации, особенно у женщин молодого репродуктивного возраста. У женщин до 25 лет вероятность самоэлиминации ВПЧ может достигать 80%. При этом длительная персистенция ВПЧ, характеризующаяся его переходом из эписомальной в интегрированную фазу, является наиболее опасным фактором развития и прогрессии патологии шейки матки [21, 22]. Количественное определение ДНК-копий вируса в исследуемых образцах позволяет прогнозировать возможность элиминации ВПЧ – по мере возрастания вирусной нагрузки снижается вероятность самостоятельного благоприятного исхода ПВИ. Однако вирусная нагрузка является не только предиктором персистенции ВПЧ, но и возможным фактором развития и прогрессии SIL. Так, в недавно опубликованном исследовании J. Cuzick et al. (2019) сообщается о том, что высокая вирусная нагрузка, определенная для 16 типа ВПЧ, значительно чаще ассоциировалась с CIN 3+ по сравнению с низкой вирусной нагрузкой. Также на основе результатов обследования 47 120 женщин были рассчитаны ассоциированные с уровнем вирусной нагрузки риски развития CIN 2+ и CIN 3+ для 13 высокоонкогенных типов ВПЧ (рис. 4).
Проанализировав полученные данные, авторы пришли к выводу, что наиболее онкогенными типами ВПЧ явились 16, 33 и 31, так как доля указанных генотипов в структуре заболеваемости CIN 3+ составила 66,5%. Следует отметить, что с ростом вирусной нагрузки возрастала и вероятность развития CIN для каждого исследуемого генотипа. При этом высокая вирусная нагрузка 18, 35, 52 и 58 типов ВПЧ ассоциировалась с менее благоприятным прогнозом как в отношении CIN 2+, так и CIN 3+ по сравнению с низкой вирусной нагрузкой 16, 33 и 31 типов [23]. Эти выводы согласуются с результатами исследования S. Lee et al. (2015), в рамках которого было проведено гистологическое исследование полученных в результате прицельной биопсии шейки матки и определение типа ВПЧ с его вирусной нагрузкой у 349 женщин, предварительно прошедших цитологическое исследование с заключением ASCUS (атипичные клетки плоского эпителия неясного значения) [24]. На основе данных гистологического исследования авторы выделили три группы женщин с результатом NILM (отсутствие интраэпителиальных поражений или злокачественности, n=162), LSIL (n=135) и HSIL (n=52). Диагностическая панель для определения типа ВПЧ включала в себя 13 высокоонкогенных типов: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 генотипы. Проанализировав распределение вирусной нагрузки в структуре поражений шейки матки, авторы пришли к выводу, что степень выраженности SIL коррелирует с уровнем вирусной нагрузки (рис. 5).
Таким образом, определение вирусной нагрузки ВПЧ не менее важно для стратификации рисков возникновения и прогрессии SIL, чем проведение генотипирования.
Вместе с тем не до конца изученным остается вопрос, как развивается и прогрессирует SIL, ассоциированный с ВПЧ-инфекцией. В настоящее время очевидна причинно-следственная связь при выявлении поражения шейки матки и одного генотипа ВПЧ. Однако при выявлении 2 и более типов ВПЧ определить эту связь достаточно сложно. В последние годы в мире обсуждается гипотеза о том, что один тип ВПЧ вызывает одно поражение шейки матки. Иными словами, поражение шейки матки может быть обусловлено различными типами ВПЧ, при этом разные участки поражения могут быть ассоциированы с различными типами ВПЧ. Например, в исследовании W. Quint et al. (2012) проводилась лазерная микродиссекция 74 фиксированных формалином и залитых парафином биоптатов шейки матки с гистологически подтвержденными LSIL и HSIL. В 50% случаев LSIL наблюдалась одна область поражения эпителиального пласта, за которую отвечал только один тип ВПЧ, в 37,5% случаев выявились две независимых друг от друга области поражения, за которые отвечали два разных типа ВПЧ, и в 12,5% случаев были обнаружены три разных области LSIL, каждая из которых была ассоциирована с разными генотипами (рис. 6).
При этом в 6 из 14 случаев HSIL (CIN 3) авторы установили связь одной области поражения эпителиального пласта сразу с двумя типами ВПЧ (рис. 7).
Таким образом, авторы сделали вывод о том, что для ВПЧ разных типов не характерно одновременное присутствие в одной и той же клетке, и на примере их исследования гипотезу «один тип ВПЧ – одно поражение» можно считать подтвержденной [25].
В настоящее время диагностика и правильная интерпретация результатов теста на ВПЧ имеет чрезвычайно важное значение. Помимо определения генотипа ВПЧ и его вирусной нагрузки следует обращать внимание и на диапазон диагностической панели. Чем больше типов ВПЧ способна выявить панель, тем меньше вероятность пропустить поражение шейки матки и оставить пациентку без необходимого лечения. Во многих современных исследованиях используют тест-системы, определяющие минимум 21 тип ВПЧ, а в ряде случаев даже больше, вплоть до определения 52 типов [8, 20]. Например, на территории Российской Федерации широко применяется тест «HPV квант – 21», способный проводить генотипирование и определять вирусную нагрузку 21 типа ВПЧ (16, 18, 26, 31, 33, 35, 39, 44, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82, 6, 11). Это оправдывается тем, что на больших выборках пациентов каждый из представленных типов ВПЧ ассоциируется с определенным риском развития SIL.
Заключение
Таким образом, проблема ВПЧ-инфекции обладает значительно большим масштабом, нежели было принято считать ранее. Недостаточно проводить только определение генотипа ВПЧ. Крайне важно также учитывать вирусную нагрузку и количество выявляемых типов ВПЧ. Следует отметить, что один и тот же генотип может занимать диаметрально различные позиции в структуре заболеваемости шейки матки вследствие географических особенностей распределения ВПЧ. Не вызывает сомнений, что ВПЧ – мультифакторный предиктор развития поражений шейки матки, и правильная интерпретация, а также последующая экстраполяция результатов ВПЧ-теста на каждый определенный клинический случай возможна только благодаря комплексной оценке факторов папилломавирусной инфекции.



