По данным ВОЗ преэклампсия (ПЭ) занимает третье место в структуре материнской смертности и составляет 16% в экономически развитых странах и 25% в развивающихся странах [1, 2]. Ведущими причинами материнской смертности при преэклампсии являются цереброваскулярные кровоизлияния 15,8%, почечная и печеночная недостаточность 7,2%, HELLP синдром 4,8% [3]. Преэклампсия лежит в основе таких осложнений беременности как преждевременная отслойка нормально расположенной плаценты (ПОНРП) 1–4%, преждевременные роды (ПР) 15–67%, задержка роста плода (ЗРП) 10–25% [4].
Стертые (атипичные) формы ПЭ, являющиеся доминирующей причиной материнской смертности в развитых странах, также представляют собой сложную диагностическую задачу. По мнению Сидоровой И.С., проведшей анализ материнской смертности в России за 2013–2015 гг., именно атипичная клиническая картина ПЭ является современной особенностью тяжелой преэклампсии; такие симптомы, как выраженная артериальная гипертензия (АГ), массивная протеинурия, анасарка, имели место только у 55,6%, 42,9% и 40,7% погибших [5]. Сходные данные были продемонстрированы Савельевой Г.М. в 2010 г. в отношении эклампсии – самого тяжелого осложнения ПЭ, непосредственно угрожающего жизни женщины. Так, только 25,5% пациенток демонстрировали тяжелую АГ, у 25,5% женщин протеинурия отсутствовала, а все 3 симптома ПЭ имели место только у 58,8% пациенток [6].
Актуальной остается дифференциальная диагностика ПЭ от соматических «масок» преэклампсии, когда пациентки нуждаются в специализированной помощи, а вместо этого госпитализируются в отделения патологии родильных домов. Отсутствие единого патогномоничного клинического симптома преэклампсии с одной стороны, и необходимость дифференциальной диагностики ПЭ с другой стороны, заставили исследователей всего мира сконцентрироваться на поиске лабораторного теста – предиктора преэклампсии. Фундаментальные исследования в области патогенеза преэклампсии легли в основу создания лабораторного маркера этого осложнения беременности.
Современная теория возникновения ПЭ, выдвинутая в 1989 г. Maynard, Roberts и другими исследователями, объясняет генерализованную эндотелиальную дисфункцию, а вместе с ней и все клинические симптомы ПЭ, массивным сбросом в материнское русло sFlt-1 плацентарного происхождения [7]. sFlt-1 (растворимая fms-подобная тирозинкиназа) – антиангиогенный протеин, который является растворимой свободной формой рецептора Flt-1 (VEGFR-1) – рецептора к VEGF (васкулоэндотелиальный фактор роста) и его плацентарному аналогу PlGF (плацентарный фактор роста). Flt-1 (VEGFR-1) связан с мембраной эндотелиальных клеток сосудов всего организма, в том числе и плаценты. При связывании VEGF (PlGF) с Flt-1 рецептором (VEGFR-1) стимулируются развитие плаценты, пролиферация эндотелиальных клеток, васкулогенез. При нормально протекающей беременности PlGF, контактируя с VEGFR-1 эндотелия сосудов, оказывает ангиопротективное, антикоагулянтное, вазодилатирующее действие [10]. В условиях формирующейся плацентарной дисфункции, связанной с нарушениями процессов ремоделирования спиральных сосудов (I плацентарная стадия преэклампсии), на фоне снижения плацентарной перфузии и сниженного синтеза PlGF, в материнское русло активно начинает поступать несвязанная с PlGF растворимая fms-подобная тирозинкиназа (sFlt-1), которая оказывает прокоагулянтное, вазоконстрикторное действие, повреждает эндотелиоциты, приводя к повышению сосудистой проницаемости. С повышением сывороточной концентрации sFlt-1 связывают переход преэклампсии из I плацентарной стадии во II материнскую стадию, в которой появляются клинические симптомы преэклампсии [11, 12].
Доминирующий уровень sFlt-1 над PlGF и, соответственно, высокое соотношение sFlt-1/PlGF в крови беременных пациенток может служить хорошим лабораторным предиктором преэклампсии. Диагностическая значимость определения соотношения sFlt-1/PlGF у беременных с целью исключения или подтверждения диагноза преэклампсия впервые была установлена в ходе проспективного мультицентрового исследования PROGNOSIS (Prediction of Short-Term Outcome in Pregnant Women with Suspected Preeclampsia Study), завершенного в 2016 году [13]. В результате исследования установлено пороговое значение («cut off») соотношения sFlt-1/PlGF для предикции преэклампсии. При sFlt-1/PlGF<38 преэклампсия исключается в течение последующей недели на 99,3% (NPV 99,3%, чувствительность 80,0, специфичность 78,3), при sFlt-1/PlGF>38 развитие преэклампсии ожидается в течение 4-х недель с вероятностью 36,7% (PPV36,7%, чувствительность 66,2, специфичность 83,1).
Однако до настоящего времени нет четкого понимания, какова практическая ценность определение соотношения sFlt-1/PlGF, может ли данный тест использоваться в качестве дополнительного инструмента для выявления преэклампсии на доклинической стадии преэклампсии или в случае стертого/атипичного течения этого осложнения беременности.
Целью настоящего исследования явилось изучение эффективности определения соотношения sFlt-1/PlGF в диагностике преэклампсии на доклинической стадии и в случаях стертого/атипичного течения.
Материал и методы
Исследование проведено на базе Перинатального Медицинского Центра Группы Компаний «Мать и Дитя», Кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова, лаборатории Клинического Госпиталя Лапино Группы Компаний «Мать и Дитя». В исследование были включены 206 беременных со сроком гестации 20–39 недель.
Критериями включения в исследование явились:
- наличие у пациенток факторов высокого риска ПЭ без клинических симптомов ПЭ: хроническая артериальная гипертензия (ХАГ), хронические заболевания почек, ревматологические заболевания, сахарный диабет, высокий риск ПЭ по результатам комбинированного скрининга I триместра, ПЭ в анамнезе, другие проявления плацентарной дисфункции в анамнезе, такие ПОНРП, ЗРП, антенатальная гибель плода в анамнезе;
- наличие отдельных симптомов, указывающих на возможное развитие преэклампсии: отеки, патологическая прибавка веса (более 1 кг в неделю), изолированная протеинурия, изолированная АГ, повышение печеночных трансаминаз (АЛТ>35 Ед/л, АСТ>35 ед./л), снижение уровня тромбоцитов ≤150 тыс./мкл, ЗРП, нарушение показателей допплерометрии кровотока в маточных сосудах;
- наличие у пациенток диагноза преэклампсия, установленного в соответствии с клиническими рекомендациями «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия: АГ (Систолическое артериальное давление – САД ≥140 мм рт.ст. и/или диастолическое артериальное давление ДАД ≥90 мм рт.ст.) в сочетании с протеинурией (0,3 г белка и более в суточной моче) после 20 недель беременности [14].
Критерии исключения: пациентки со сроком гестации менее 20 недель и пациентки, беременность которых завершилась вне стационаров ГК «Мать и Дитя».
Сывороточная концентрация PlGF и sFlt-1 в крови беременных определена с помощью электрохемилюминесцентных диагностических тестов Elecsys sFlt-1 концерна «Ф. Хоффманн-Ля Рош» (Швейцария) на автоматических анализаторах Cobas e 411. Для каждого образца крови рассчитано соотношение sFlt-1/ PlGF.
В зависимости от уровня соотношения sFlt-1/ PlGF все 206 беременных разделены на 2 группы: 1 группу составили 118 пациенток с sFlt-1/ PlGF<38 (отрицательный тест), во 2 группу были отнесены 88 пациенток с sFlt-1/ PlGF>38 (положительный тест).
Статистический анализ проводили при помощи программного пакета IBM SPSS Statistics 23,0. Описательная статистика для количественных переменных представлена в виде среднего ± стандартное отклонение М(SD) или медиана, интерквартельный интервал Mе(Q1;Q3) в зависимости от нормальности распределения переменной. Нормальность распределения переменной определяли при помощи построения частотных диаграмм и проверяли при помощи критерия Колмогорова-Смирнова. Описательная статистика для порядковых и качественных переменных представлена в виде частоты и доли (%) каждой категории. Во всех случаях применяли двусторонние варианты статистических критериев. Нулевую гипотезу отвергали при р<0,05.
Для сравнения частот категорий зависимой качественной переменной использовался критерий χ2 или, в случае ожидаемого числа хотя бы одной ячейки таблицы <5, точный критерий Фишера. В случае количественной переменной при количестве категорий независимой переменной более 2, для сравнения использовали дисперсионный анализ (ANOVA).
Результаты исследования
Исследуемые группы не отличались друг от друга по фоновым показателям: возраст, ИМТ, наличие ХАГ, гестационного сахарного диабета (ГСД), хронических заболеваний почек, ЭКО и многоплодия (табл. 1). Однако, первобеременные пациентки чаще встречались во 2 группе: 52,3% vs 29,7% (р< 0,01).
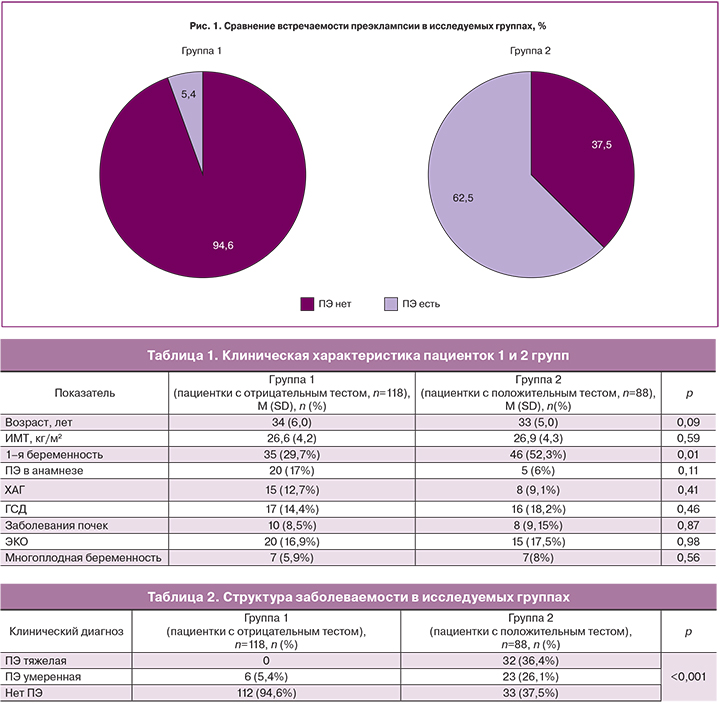
Из 118 пациенток 1-й группы (sFlt-1/ PlGF<38) беременных с диагнозом тяжелая преэклампсия не было, умеренная преэклампсия диагностирована у 6 (5,4%), т.е. имел место ложноотрицательный тест, преэклампсии не было у 112 (94,6%). Средний срок гестации и средний возраст 6 женщин с умеренной преэклампсией составили 36,3 (1,6) недель и 35 (5,7) лет соответственно. 3 из 6 (50%) страдали хронической артериальной гипертензией, 1 пациентка ревматоидным артритом и ГСД, а у 2 ИМТ был более 30, что делало вероятным у них наличие ГСД или не выявленной ранее ХАГ. Возможно, что диагноз ПЭ умеренной был установлен у этих 6 пациенток формально, а реально имелась протеинурия, вызванная беременностью, на фоне хронической артериальной гипертензии, не диагностированной ранее.
Из 88 пациенток 2-й группы с положительным тестом (sFlt-1/ PlGF>38) диагноз тяжелая преэклампсия установлен у 32 беременных (36,4%), умеренная преэклампсия у 23 (26,1%), 33 пациентки (37,5%) не развили клиническую картину преэклампсии (табл. 2, рис. 1, рис. 2).
Изучен уровень соотношения sFlt-1/ PlGF в исследуемых группах. Выявлено, что при тяжелой преэклампсии показатель sFlt-1/ PlGF статистически значимо отличался от показателей при преэклампсии умеренной и при отсутствии у пациенток диагноза преэклампсии: 268 (128–540) vs 81 (62–116) vs 58 (43–110), р1<0,0001 и р2<0,0001. Соотношение sFLt-1/ PLGF у беременных с любой преэклампсией также было выше, чем у пациенток без преэклампсии (табл. 3). Схожие результаты получены профессором Verlohren, в его исследовании уровень sFlt-1/ PlGF для ранней ПЭ составил 506 (54,3) и для поздней ПЭ – 168 (17,7) [15]. В исследовании Theng Theng Chah et all уровень sFlt-1/PlGF при преэклампсии был 146 (61,9–318,5), в случае ранней ПЭ – 292 (132,3–556), поздней ПЭ – 63 (28,8–150,8) [16].
Исследованы перинатальные исходы в обеих группах. Выявлено, что срок родоразрешения в группе 2 статистически значимо был меньше, чем срок в группе 1: 35,8 (4,2) нед. vs 37,8 (2,2) нед. p<0,0005. Такие же данные получены в отношении веса и роста новорожденного, в группе 2 преобладали дети с низкой массой тела при рождении: 2567 (1010) г vs 3230 (627) г, p<0,0005, что связано как с более ранними сроками родоразрешения, так и с более частой встречаемостью фето-плацентарной недостаточностью в данной группе. Оценка по шкале Апгар на 5 мин составила 8,8 (0,6) в 1-й группе и 8,1 (0,7) во 2-й группе, р=0,01. В группе положительного теста достоверно чаще рождались дети с выраженной задержкой роста плода по сравнению с группой отрицательного теста: с массой новорожденного менее 5 перцентиля – 24 пациентки (27%), от 5 до 10 перцентиля –14 (16,0%) vs 8 (6,7%), 4 (3,4%) соответственно, р=0,014 [17]. Перинатальные потери (антенатальная гибель плода, n=4 и постнатальная гибель плода, n=4) зафиксированы у 8 пациенток из группы положительного теста при сроке гестации 21–29 недель, причем у всех 8 беременных имела место выраженная задержка роста плода (масса новорожденного менее 5 перцентиля), а у 6 пациенток – сопутствующая тяжелая преэклампсия (табл. 4).
Проведено сравнение исследуемых групп по клинической симптоматике. Уровень САД, ДАД, протеинурия были выше в группе положительного теста по сравнению с группой отрицательного теста: 137 (17) мм.рт.ст, 87 (9 ) мм.рт. ст, 983 (1017) мг/л/сут vs 121 (14) мм.рт. ст, 78 (11) мм.рт. ст, 92 (25) мг/л/сут соответственно, p<0,001. Такие симптомы, как головная боль и боли в эпигастрии, также чаще зарегистрированы в группе пациенток с положительным тестом, чем с отрицательным, 16 (18%), 3 (3%) vs 6 (5%), 0 соответственно, р=0,001, 0,043. Острая почечная недостаточность, транзиторная ишемическая атака имели место только у пациенток 2-й группы. Время пролонгирования беременности от забора теста до родов у пациенток с положительным тестом было статистически значимо меньше, чем в группе отрицательного теста, 11 (11) vs 55 (33) дн (p<0,0001)(табл. 5).
Обсуждение
В нашем исследовании мы показали, что диагноз преэклампсия статистически значимо чаще был установлен у пациенток с положительным тестом по сравнению с отрицательным: 62,5% vs 5,4%, p<0,05, что может оказывать существенную помощь при постановке диагноза преэклампсии, особенно в случае стертых/ атипичных форм этого осложнения беременности.
Так же было установлено, что диагноз тяжелой преэклампсии имел место только при положительном значении теста (sFlt-1/ PlGF>38), таким образом, при отрицательном результате теста диагноз тяжелой преэклампсии исключен.
Диагноз преэклампсия умеренная также доминировал у пациенток при sFlt-1/ PlGF>38 (23 из 29 пациенток с ПЭ умеренной), однако 6 пациенток с ПЭ умеренной имели соотношение sFlt-1/ PlGF<38. Таким образом, отрицательный результат теста не исключает диагноз умеренной преэклампсии, но у таких пациенток возможно наличие сопутствующей соматической патологии, которая может скрываться за маской преэклампсии.
В ходе исследования показано, что уровень соотношения sFlt-1/ PlGF был выше у пациенток с тяжелой преэклампсией по сравнению с беременными с умеренной ПЭ и без преэклампсии: 268 (128–540) vs 81 (62–116) vs 58 (43–110), р1<0,0001 и р2<0,0001, что так же может оказывать помощь в ранней диагностике тяжелой преэклампсии.
Нами установлено, что клинические симптомы преэклампсии были более выражены при sFlt-1/ PlGF>38: уровень артериального давления и степень протеинурии были достоверно выше среди пациенток этой группы. Такие симптомы преэклампсии, как головная боль и боли в эпигастрии, встречались чаще в группе положительного теста. Осложнения преэклампсии: острая почечная недостаточность и транзиторная ишемическая атака имели место только при положительном тесте, что указывает на возможность использования уровня соотношения sFlt-1/ PlGF для определения степени тяжести преэклампсии и прогнозирования неблагоприятных материнских исходов. Более раннее родоразрешение, низкая масса новорожденного и оценка по шкале Апгар, перинатальные потери, косвенно характеризующие степень тяжести преэклампсии, доминировали среди пациенток 2-й группы, поэтому метод определения соотношения sFlt-1/ PlGF может быть ценным для прогнозирования неблагоприятных перинатальных исходов.
Заключение
Наше исследование подтвердило, что определение соотношения sFlt-1/ PlGF может использоваться в качестве дополнительного инструмента для постановки диагноза преэклампсия, особенно в случаях атипичного течения заболевания, для оценки степени тяжести преэклампсии, для дифференциальной диагностики преэклампсии от других гипертензивных осложненений беременности и от соматических «масок» преэклампсии, а также с целью прогнозирования неблагоприятных материнских и перинатальных исходов.



