От 2 до 4% беременных женщин страдают заболеваниями сердечно-сосудистой системы [1].
Декомпенсация сердечной деятельности на фоне беременности является причиной материнской летальности, нарушений внутриутробного развития плода, самопроизвольных выкидышей и преждевременных родов [2]. В 60–70% случаев пусковым механизмом является поражение клапанного аппарата сердца вследствие ревматической болезни, при наиболее частой заинтересованности митрального клапана [3].
Впервые операция на сердце с искусственным кровообращением (ИК) была выполнена Dubourg в 1959 году у женщины с тетрадой Фалло на 16-й неделе беременности. Послеоперационных осложнений не наблюдалось, но на 24-й неделе беременности произошел самопроизвольный выкидыш [4].
Большинство публикаций, касающихся операций с ИК у беременных, носит характер клинических наблюдений, где конечный результат определяется характером патологии, ургентностью вмешательства, сроком гестации плода и степенью компенсации состояния матери. Тем не менее, кардиохирургическое вмешательство является вынужденной мерой. При этом нередко женщины утрачивают репродуктивную функцию, вследствие возникающей необходимости экстирпации матки на фоне акушерского кровотечения [5].
Наш стационар имеет небольшой опыт кардиохирургических вмешательств с ИК у беременных женщин, находящихся во втором и третьем триместрах беременности, с благоприятным исходом для матери и плода, с сохранением детородной функции матери.
Цель публикации: поделиться успешным клиническим опытом кардиохирургических вмешательств с ИК на сердце и магистральных сосудах у беременных пациенток во втором и третьем триместрах беременности.
Материал и методы исследования
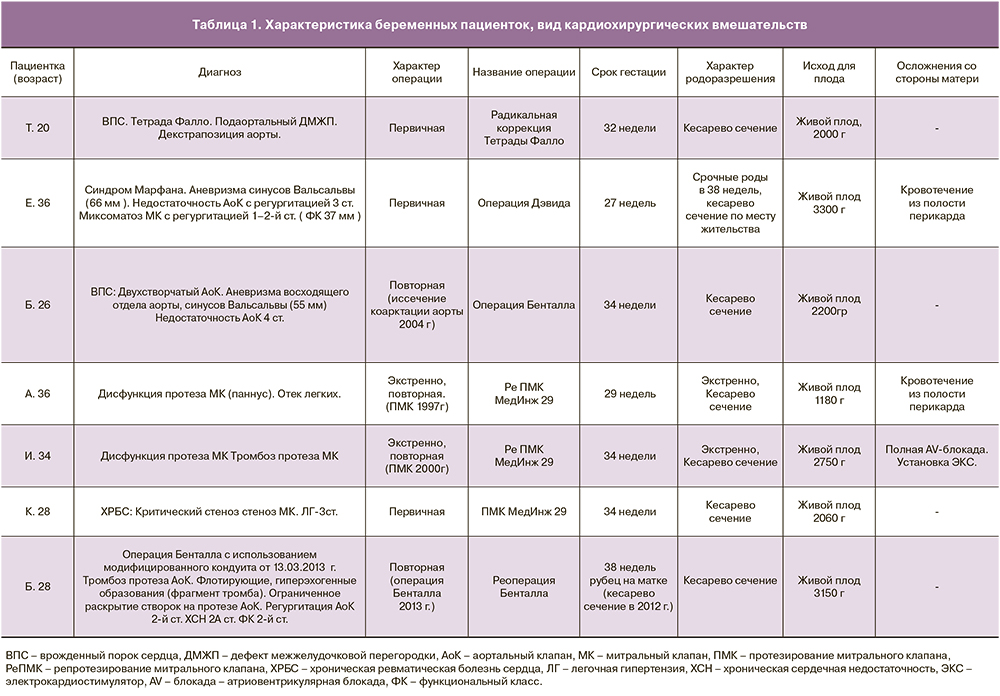
В ФГБУ ФЦССХ (г. Пенза) в период с мая 2009 по октябрь 2017 года было выполнено 7 кардиохирургических вмешательств с ИК на сердце и магистральных сосудах у беременных во втором и третьем триместрах беременности. Характеристика пациенток, вид кардиохирургических вмешательств представлены в табл. 1.
Все женщины относились к 4-му классу анестезиологического риска ASA, средний возраст пациенток составил 31 год (20–36 лет), три пациентки имели патологию митрального клапана. Показаниями для кардиохирургического вмешательства с ИК были: дисфункция ранее имплантированных протезов митрального клапана, недостаточность аортального клапана 4-й ст., наличие аневризмы восходящего отдела аорты, синусов Вальсальвы с быстрым увеличением размеров корня аорты, критический стеноз митрального клапана с нарастающей легочной гипертензией, тромбоз протеза аортального клапана, у пациентки, перенесшей ранее операцию Бенталла. У четырех женщин операции на сердце носили повторный характер. Четыре вмешательства выполнены по неотложным показаниям, два – по экстренным и одно – у пациентки, поступившей в стационар с клиникой интерстициального отека легких вследствие дисфункции (паннуса) протеза митрального клапана, по жизненным.
Пациентки были проинформированы о риске для плода и вероятных осложнениях со стороны репродуктивных органов (возможной экстирпации матки, вследствие акушерского кровотечения); информированное согласие на вмешательство было получено во всех случаях.
Все пациентки подавались в операционную после необходимых дополнительных диагностических мероприятий: ультразвуковой допплерографии брахиоцефальных артерий и сосудов нижних конечностей, трансторакальной эхокардиографии, лабораторных исследований крови, мочи, ультразвукового исследования плода. В предоперационной подготовке принимал участие акушер – гинеколог. Решение о целесообразности превентивно перед кардиохирургическим этапом, провести родоразрешение путем кесарева сечения принималось консилиумом специалистов на основе существующих клинических рекомендаций [6].
При поступлении в операционную обеспечивалось мониторирование витальных функций: 5-канальный мониторинг электрокардиограммы с контролем сегмента ST, пульсоксиметрия, инвазивная манометрия артериального, центрального венозного давления, мониторинг церебральной оксигенации 2-канальным оксиметром INVOS 5100 (COVIDIEN, Somanetics, США), дыхательный мониторинг.
Введение в анестезию у женщин с предстоящим КС было идентичным и проводилось кетамином в дозе 1 мг/кг. После введения листенона 1 мг/кг, выполнялась интубации трахеи. Искусственная вентиляция легких осуществлялась в режиме управления по объему, с фракцией О2 во вдыхаемой воздушной смеси – 70%. Параметры искусственной вентиляции легких корригировались с учетом показателей газов артериальной крови с поддержанием нормокапнии и умеренной гипероксигенации.
Первым этапом, бригадой акушеров-гинекологов выполнялась нижне-срединная лапаротомия, кесарево сечение в нижнем сегменте матки. После извлечения плода вводился фентанил в дозе 3 мкг/кг, рокурония бромид 1 мг/кг, начиналась инфузия окситоцина в дозе 20 МЕ, растворенного в 500 мл 0,9% хлорида натрия, также гинекологами вводилось 5 МЕ окситоцина в толщу миометрия. Далее анестезия поддерживалась внутривенным введением фентанила до общей дозы 20–25 мкг/кг и ингаляцией севофлюрана 1,0–2,0% об.
Результаты исследования
Нами было проведено 6 операций кесарева сечения симультантно с кардиохирургическими вмешательствами. Во всех случая кесарево сечение носило превентивный характер, плод извлекался на третьей минуте. Вес новорожденных составил от 1180 до 3150 г. Новорожденные ввиду недоношенности передавались бригаде неонатологов и переводились для выхаживания в специализированный стационар. Все новорожденные выжили. С целью профилактики акушерского кровотечения перед введением гепарина выполнялась перевязка внутренних подвздошных артерий. В одном случае беременность пролонгирована и закончилась плановым кесаревым сечением на 38-й неделе беременности.
У женщин с повторным характером оперативного вмешательства заранее проводилась подготовка к возможному экстренному периферическому подключению аппарата искусственного кровообращения (АИК). С этой целью параллельно с закрытием лапаротомной раны бригадой кардиохирургов выделялись и, при необходимости, канюлировались бедренная артерия и бедренная вена справа. Далее после продольной стернотомии проводился кардиолиз.
У пациентки с паннусом протеза МК, поступившей в стационар с клиникой отека легких, после экстренного кесарева сечения извлечена живая недоношенная девочка весом 1180 г с оценкой по шкале Апгар 6/7 баллов, которой потребовалась интубация трахеи и перевод на искусственную вентиляцию легких, затем экстренно начато ИК по схеме бедренная артерия – бедренная вена, верхняя полая вена. На момент поступления в операционную частота сердечных сокращений плода составляла 98 уд/мин.
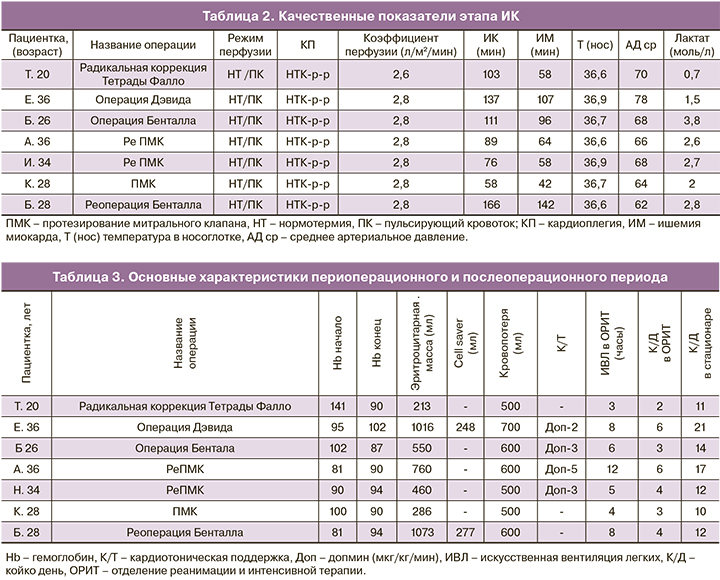
Среднее время ИК составило 96 минут (58–137) минут, среднее время пережатия аорты 61 минута (44–107 минут). Основные качественные показатели, характеризующие период ИК (режим и коэффициент перфузии, длительность искусственного кровообращения, ишемии миокарда, среднее артериальное давление) отражены в табл. 2.
ИК у всех пациенток осуществлялось с объемной скоростью, соответствующей коэффициентам перфузии 2,6–2,8 л/мин/м2, в нормотермическом режиме (температура венозной крови 36,6–36,9°С), с использованием режима пульсирующего кровотока. Среднее артериальное давление поддерживалось в диапазоне 65–75 мм рт. ст. Для защиты миокарда использовалась фармакохолодовая кардиоплегия НТК-раствором. Случаев неадекватной защиты миокарда зафиксировано не было. Каждые 30 минут осуществлялся контроль кислотно-щелочного состава и газов крови. По окончании оперативного вмешательства среднее значение лактата в артериальной крови составило 2,1 ммол/л (0,7–2,0).
Пять пациенток поступили в операционную с выраженной анемией. Для минимизации использования препаратов донорской крови использовалась техника модифицированного заполнения контура АИК. Объем заполнения АИК составлял не более 900 мл, что в совокупности с применением высокопоточной ультрафильтрации крови, аспирацией и удалением кардиоплегического раствора из контура АИК, позволило снизить гемодилюцию и сократить объем использованной донорской крови. Средняя кровопотеря составила 550 мл (500–700 мл), средний объем гемотрансфузии 605 мл (213–1073 мл). По окончании оперативного вмешательства кардиотоническая поддержка допмином в дозе 2–5 мкг/мкг/мин требовалась четырем пациенткам. Потребность в гемотрансфузии, величина кровопотери, значение гемоглобина в начале и конце операции, потребность в кардиотонической поддержке, длительность нахождения в отделении реанимации и в стационаре отражены в табл. 3.
Все женщины, перенесшие кесарево сечение, переводились в отделение реанимации на фоне инфузии окситоцина. В послеоперационном периоде проводилась антибактериальная терапия, назначались антикоагулянты (варфарин, фраксипарин), инфузионная терапия, мероприятия направленные на профилактику пареза кишечника, мониторинг, контроль за состоянием родовых путей. Для подавления лактации применялся бромокриптин в дозе 2,5 мг/сутки. В лечении всех пациенток принимал участие акушер-гинеколог.
Послеоперационный период у всех пациенток протекал без воспалительных изменений полости матки и кишечной недостаточности. У 2 пациенток через 4 и 6 часов соответственно ранний послеоперационный период осложнился кровотечением из полости перикарда, у одной потребовалась имплантация электрокардиостимулятора. Средняя продолжительность искусственной вентиляции легких в отделении реанимации составила 5,5 часов (3–12 часов), пребывания в отделении реанимации – 3,5 суток (2–6 суток), средняя продолжительность пребывания в стационаре – 13 суток (10–21 сутки). Все женщины были выписаны из стационара в удовлетворительном состоянии, летальных исходов не было. Новорожденные дети в связи с недоношенностью переводились для выхаживания в специализированное неонатальное отделение и в последующем выписаны в удовлетворительном состоянии. Во всех случаях детородная функция женщин была сохранена.
Клинический пример пролонгирования беременности у пациентки, перенесшей кардиохирургическое вмешательство с искусственным кровообращением
Первородящей пациентке Е. 36 лет, поступившей в стационар на 26–27-й неделе беременности с диагнозом: Синдром Марфана. Аневризма синусов Вальсальвы (66 мм) и восходящего отдела аорты (50–53 мм). Недостаточность аортального клапана с регургитацией 3–4-й ст. Пациентке выполнено клапансохраняющее протезирование корня аорты по методике Дэвид синтетическим протезом Васкутек Вальсальва № 28. Время ИК – 137 мин, ишемии миокарда – 107 мин. ИК проводилось в нормотермическом, режиме (температура венозной крови 36,6–36,9°С), с использованием режима пульсирующего кровотока и расчетными показателями объемной скорости, соответствующей коэффициентам перфузии 2,6–2,8 л/мин/м2,
значение среднего артериального давления поддерживалось выше 75 мм рт.ст. Весь объем кардиоплегического раствора был удален после вскрытия правого предсердия. Для контроля сердечной деятельности плода, сократительной активности матки использовалась кардиотокография. Также в операционной находилась бригада акушеров-гинекологов и неонатологов на случай необходимости проведения экстренного кесарева сечения и коррекции нарушений витальных функций плода. Частота сердечных сокращений плода во время операции составляла 138–146 уд./мин. Продолжительность пребывания в отделении реанимации составила 6 суток, в стационаре – 21 сутки. Пациентка была родоразрешена путем кесарева сечения по месту жительства на 38-й неделе беременности. Ребенок родился с массой тела 3300 г, ростом 51 см, и оценкой по шкале Апгар 7/8 баллов. Пациентка проходит ежегодное контрольное обследование в нашем стационаре. По данным трансторакальной эхокардиографии через два года после оперативного вмешательства размеры корня аорты соответствуют норме: Синусы Вальсальвы — 36 мм, фиброзное кольцо аортального клапана – 20 мм; Vmax — 1,7 м/с; Gср — 8 мм рт.ст; Gmax — 11 мм рт.ст, регургитация 0–1-й ст.; площадь эффективного отверстия аортального клапана 2,9 см2.
Обсуждение
Результаты оперативного лечения у беременных, нуждающихся как в первичных, так и в повторных кардиохирургических вмешательствах противоречивы. Неблагоприятные исходы обусловлены развернутой клиникой тромбоэмболических, септических осложнений, внутриутробной гипоксией с задержкой внутриутробного развития плода на фоне декомпенсации сердечной деятельности матери [7–9]. Материнская смертность беременных, перенесших кардиохирургические операции с ИК, по данным литературы составляет от 1 до 5% [10]. Фетальная летальность колеблется от 15 до 40% и связана со сроком гестации [11, 12]. Смертность новорожденных достигает 40% при рождении в сроке до 26 недель (при этом у 20% выживших имеется выраженный неврологический дефицит) и снижается до 15% после 30 недель, а после 32 недель соответствует среднему показателю в популяции [13–15].
По рекомендации Европейского общества кардиологов (ESC), после 28-й недели беременности предпочтительным является родоразрешение до использования ИК, симультанно с кардиохирургическим вмешательством. Решение о родоразрешении в сроке от 26 до 28 недель гестации принимается индивидуально. Перед оперативным вмешательством целесообразно проведение антенатальной кортикостероидной терапии [6]. При современных возможностях выхаживания недоношенных детей целесообразность превентивного кесарева сечения перед кардиохирургическим вмешательством с ИК в третьем триместре беременности видится нам предпочтительной. При анализе выживаемости новорожденных, по данным Yuan младенческая смертность ниже, если оперативное родоразрешение выполняется перед кардиохирургическим этапом [16].
В нашей практике шесть пациенток родоразрешались симультанно с кардиохирургическим вмешательством, перед введением гепарина и началом ИК. Благодаря четкой работе акушеров-гинекологов, неонатологов, анестезиологов, кардиохирургов все новорожденные выжили.
Использование гепарина во время ИК не вызывает геморрагических осложнений у плода, но существенно увеличивает риск акушерского кровотечения, у пациенток, которым проводится кесарево сечение [17, 18].
В этом случае для предотвращения акушерского кровотечения нами предпринималась перевязка внутренних подвздошных артерий, что позволило не только избежать острой массивной кровопотери из полости матки на фоне системной гепаринизации, но и сохранить репродуктивную функцию у всех пациенток.
Особая категория – беременные пациентки с ранее протезированными клапанами сердца. Среди беременных, имеющих в анамнезе протезирование биологическими клапанами показатели материнской, перинатальной и младенческой смертности, по данным Salazar не отличаются от таковых в популяции [19].
Использование биологических протезов у нерожавших женщин дает возможность вынашивать беременность без применения антикоагулянтов, в частности кумаринов, проникающих через фетоплацентарный барьер и вызывающих у плода синдром «варфариновой эмбриопатии» [20].
Использование же механических клапанов сопряжено с необходимостью применения антикоагулянтов, бесконтрольный прием которых чреват высоким риском тромбоэмболических осложнений и развитием дисфункции имплантированных протезов. Частота тромбоэмболических осложнений у беременных пациенток с клапанными механическими протезами колеблется от 7,5 до 33% [21, 22].
В нашем клиническом опыте у трех пациенток дисфункция ранее имплантированных клапанных протезов развилась вследствие самовольной отмены и/или бесконтрольного приема антикоагулянтов. Причем длительная необращаемость за медицинской помощью в одном случае привела к формированию паннуса протеза МК, полностью блокировавшего работу запирательного элемента протеза, декомпенсации сердечной деятельности с развитием отека легких, фетоплацентарной недостаточности плода.
Не менее сложным является вопрос пролонгирования беременности у женщин, нуждающихся в кардиохирургических вмешательствах с ИК. В последние годы появляются публикации, в которых авторы пытаются обобщить накопленный опыт [15, 23–26].
По данным отечественных и зарубежных коллег при пролонгировании беременности у пациенток с предстоящим кардиохирургическим вмешательством с ИК, следует придерживаться тактики, направленной на поддержание маточно-плацентарного кровотока. При проведении искусственной вентиляции легких, мониторинге следует избегать гипервентиляции и гипокапнии, которые провоцируют вазоконстрикцию сосудов матки и плаценты с редукцией маточно-плацентарного кровотока в среднем на 25% [27]. Также необходимо использовать препараты с доказанной безопасностью для беременной и плода. При проведении ИК предпочтительной является нормотермическая перфузия в режиме пульсирующего кровотока, с поддержанием среднего артериального давления выше 75 мм рт.ст и высокой объемной скоростью (коэффициент перфузии выше 2,6 л/мин/м2), что также позволяет избежать секвестрации маточно-плацентарного кровотока и циркуляторной гипоксии плода [6].
Методом обязательного интраоперационного контроля сердечной деятельности плода сократительной активности матки является кардиотокография. Также рекомендовано присутствие в операционной бригады акушеров-гинекологов и неонатологов на случай необходимости проведения экстренного кесарева сечения и коррекции нарушений витальных функций плода [6].
При использовании фармако-холодовой кристаллоидной кардиоплегии удаление кардиоплегического раствора из перфузата позволяет предупредить холодовую и гиперкалиемическую остановку сердечной деятельности плода [6, 10]. Также, следует избегать выраженной гемодилюции, так как оптимальное соответствие между потреблением и доставкой кислорода достигается у плода при гематокрите беременной не ниже 28% [6, 28]. С этой целью нами использовалась техника модифицированного заполнения контура АИК, которая позволила снизить объем заполнения АИК до 900 мл, что в совокупности с применением высокопоточной ультрафильтрации крови, аспирацией и удалением кардиоплегического раствора из контура АИК, позволило снизить гемодилюцию [29]. Однако, несмотря на предпринятые меры, средний объем гемотрансфузии составил 605 мл (213–1073 мл), так как шесть из семи пациенток поступили в операционную с анемией, а интраоперационная кровопотеря складывалась из кровопотери на акушерском и кардиохирургическом этапах. Тем не менее, считаем своим достижением благополучный исход у всех женщин и новорожденных.
Заключение
Ведение беременных пациенток, которым необходимо кардиохирургическое вмешательство, является серьезным испытанием для акушеров-гинекологов, кардиохирургов, анестезиологов, реаниматологов. Обмен опытом и слаженная коллегиальная работа является незаменимой составляющей успешного исхода для женщины и плода.



